Atomspektroskopie
Übung Atomspektroskopie
Übung
Atomspektroskopie
SoSe 2022
Abgabedatum
20.06.2022
Expertengruppe 03
Kira Dölemeyer
Malin Janja Kehl
Lena Sasse
Victoria Weger
Inhaltsverzeichnis
Alle Lösungen sind eingeblendet. Alle Lösungen ausblenden
Multiple Choice (MC) Fragen
Es ist immer nur eine Antwortmöglichkeit richtig.
Spektrallinien und Termschema
Welche Aussagen treffen nicht zu?
- Das Emissionsspektrum ist reicher an Spektrallinien als das Absorptionsspektrum.
- Serien sind definiert als Spektrallinien, die die Übergänge der Rückkehr aus gleichen Energieniveaus in den gleichen Grundzustand darstellen.
- Die Dicke der Linien im Termschema geben die Wahrscheinlichkeit eines Übergangs an.
- Die Natrium D-Linie liegt bei 553 nm.
- Ein Teil der aufgenommenen Energie wird durch strahlungslose Deaktivierung frei.
- nur 2, 4 und 5
- nur 2, 3, 4 und 5
- nur 1, 2 und 5
- nur 1 und 3
- 1 bis 5 (alle)
Antwort A ist korrekt
1 Das Absorptionsspektrum ist reicher an Spektrallinien. Als Beispiel sei das Spektrum des Natriums genannt, welches im Emissionsspektrum vor allem eine gelbe Spektrallinie bei 589 nm zeigt. Das Absorptionsspektrums des Natriums zeigt ein kontinuierliches Spektrum und damit viel mehr Linien. Nur die die absorbierten Spektrallinien fehlen, hier also vor allem bei 589 nm. Absorptionslinien sind dementsprechend als dunkle Linien im Spektrum zu erkennen.
2 Serien sind definiert als Spektrallinien, die aus unterschiedlichen Energieniveaus in denselben Grundzustand zurückkehren.
3 Die Dicke der Linien im Termschema geben Hinweis auf die Wahrscheinlichkeit des Übergangs. Je dicker die entsprechende Termlinie, desto wahrscheinlicher ist der Übergang in das höhere Energieniveau. Die Energiedifferenz zwischen den Termen muss der Energie der einfallenden Strahlung entsprechen.
4 Die Natrium D-Linie liegt bei 598 nm.
5 Sowohl bei der AAS als auch bei der AES kommt es zu keiner Energieabgabe durch strahlungslose Deaktivierung, wie es zum Beispiel bei der Fluorimetrie der Fall ist. Stattdessen kommt es zur Emission von Lichtquanten der Wellenlänge, die der Energiedifferenz zwischen dem angeregten und dem ursprünglichen Energieniveau entsprechen.
1
2
3
4
5
Flammen-Atomabsorptionsspektroskopie (F-AAS)
Welche Aussage zur F-AAS trifft zu?
- Bei der AAS wird die Aussendung elektromagnetischer Strahlung des Analyten gemessen.
- Bei der AAS kommt es zur teilweisen Absorption der Strahlung durch den Analyten.
- Die Winkelveränderung zwischen Brennerspalt und einfallendem Licht der Flamme beeinflusst das Gesetz von Einstein.
- Die Konzentration von 10.000 ppb Natrium ist mittels F-AAS nachweisbar.
- Physikalische Eigenschaften des Analyten sind ohne Bedeutung.
- nur 1, 2 und 4
- nur 1, 3 und 4
- nur 2 und 5
- nur 2 und 4
- 1 bis 5 (alle)
Antwort D ist korrekt
1 Das Prinzip der Atomasorptionsspektroskopie beruht auf der sogenannten Resonanzabsorption. Um die Atome anzuregen, kommt eine Emissionslinie desselben Elements, das analysiert werden soll, zum Einsatz. Angeregt werden Atome zum gleichen, der Emissionslinie entsprechenden Elektronenübergang (Resonanzlinie). So werden spezifische Wellenlängen beim Durchstrahlen der Probe absorbiert und es kommt zur Schwächung der eingestrahlten elektromagnetischen Strahlung durch den Analyten. Die Intensität der Resonanzlinie lässt auf die Konzentration der Teilchen schließen, die in er Probe enthalten sind.
2 Spezifische Wellenlängen aus einer Lichtquelle desselben Elements werden durch den Analyten absorbiert, sollte das entsprechende Element in der Probe enthalten sein.
3 Eine Winkelveränderung zwischen Brennerspalt und einfallendem Licht führt eine Art Konzentrationsänderung der zu analysierenden Probe herbei. Ist die Flamme in einer Linie mit der Lichtquelle ausgerichtet, ist der Weg durch die Flamme am längsten und die Schichtdicke somit maximal. Diese Proportionalität zwischen Schichtdicke und Absorption lässt sich anhand des Lambert-Beer´schen Gesetzes ablesen.
⚠ $$ A = \epsilon ⋅ c ⋅ b ⚠ $$
- ε: molarer Absorptionskoeffizient (L ⋅ mol-1 ⋅ cm-1)
- c: Konzentration des Analyten in der Probe (mol/L)
- b: Schichtdicke (cm)
Das Gesetz von Einstein wird nicht vom Winkel der Brennerflamme beeinflusst, dies lässt sich durch die Formel erkennen.
⚠ $$ 𝐸 = h \cdot 𝑣 = \left(\frac{h\cdot 𝑐}{λ}\right) ⚠ $$
- 𝐸: Energie der Strahlung
- h: Planck´sches Wirkungsquantum [Js]
- 𝑣: Frequenz
- 𝑐: Lichtgeschwindigkeit
- λ: Wellenlänge
4 Die Nachweisgrenze von F-AAS liegt zwischen 0,1 ppb - 40 ppm. Somit fällt eine Konzentration von 10.000 ppb (≙ 10 ppm) in die Nachweisgrenze- Das Element Natrium kann per F-AAS nachgewiesen werden, da atomspektroskopische Verfahren Alkali- und Erdalkalimetalle detektieren können.
5 Diese Aussage trifft auf die Graphikrohr-Technik (GF-AAS) zu, jedoch nicht auf die F-AAS. Als zu analysierende Substanzen kommen nur Metallsalze in Frage, die in wässriger Lösung vorliegen. Suspensionen, Emulsionen oder feste Proben können mittels der F-AAS nicht vermessen werden. Durch Vorhandensein von Begleitsubstanzen in der Probe können ebenfalls Interferenzen auftreten, etwa eine Lichtstreuung an Festpartikeln. Auch eine mögliche Ionisierung der zu analysierenden Substanz nimmt Einfluss auf die Richtigkeit der Messergebnisse.
6
7
Atomabsorptionsspektroskopie (AAS)
Welches dieser Verfahren wird ausschließlich zur Bestimmung von Quecksilber verwendet?
- Graphitrohr-Technik
- Head-space-Analyse
- Kaltdampftechnik
- Flammen-Technik
- ATR-Technik
Antwort C ist korrekt
A Die Graphitrohr-Technik ist eine Technik der AAS. Sie kann für fast alle Metalle und Halbmetalle eingesetzt werden. Thermisch extrem stabile Substanzen wie Thallium oder Wolfram sind nicht nachweisbar. Auch kann das Element Cer ist nicht nachgewiesen werden, da es schon bei 200°C Oxide bildet. 8
B Die Head-Space-Analyse, auch Dampfraumanalyse genannt, ist ein Injektionssystem, welches in der Gaschromatographie Anwendung findet. Es wird oft bei Analyten mit komplexer Probenmatrix verwendet, zum Beispiel bei Blutalkoholmessungen. 9
C Diese Methode ist eine Unterform der Hydrid-Technik, wobei aufgrund des hohen Dampfdrucks von Quecksilber dieses mit einem Inertgasstrom schon bei niedriger Temperatur ausgetrieben werden kann. 10
11
D Die Flammentechnik ist ein klassisches Verfahren in der AAS und AES, womit viele Elemente nachgewiesen werden können, vor allem Metalle und Halbmetalle.12
E Die ATR-Technik (attenuated total reflexion) wird in der IR-Spektroskopie verwendet, um die Reflexion bei nicht IR-durchlässigen Materialien zu messen. Das geschieht mit Hilfe eines Internen Reflexionselement, dazu werden Materialien mit einem hohen Brechungsindex, wie zum Beispiel Diamanten oder Thalliumbromid verwendet. 13
Lichtquellen
Welche Aussage zu Lichtquellen, die bei der AAS eingesetzt werden, trifft nicht zu?
- Argon kann bei der Hohlkathodenlampe als Füllgas fungieren.
- Die Xenonkurzbogenlampe kann eine Temperatur von bis zu 10000 K erreichen.
- Eine Deuteriumlampe kann zur Untergrundkompensation verwendet werden.
- Die Elektrodenlose Entladungslampe lässt sich bei der Bestimmung von Selen, Blei und Natrium einsetzen.
- Die Anode der Hohlkathodenlampe besteht aus dem zu bestimmenden Element oder ist mit diesem gefüllt.
Antwort E ist korrekt
A, E Bei der Hohlkathodenlampe besteht die Anode aus Wolfram oder Nickel und die Kathode aus dem zu bestimmenden Element oder ist mit diesem gefüllt. Dadurch bietet diese Strahlungsquelle eine erhöhte Selektivität gegenüber den anderen möglichen Lichtquellen. Der Glaszylinder ist mit einem Edelgas, häufig Neon oder Argon, gefüllt, welches durch Glimmentladung ionisiert wird und anschließend Metallionen, durch Herausschlagen aus der Kathode, anregt. 14
B Bei der Xenonkurzbogenlampe kommt es nach Zünden mit ca. 30 kV zu einem ionisierten Lichtbogen, der durch kontinuierlichen Gleichstrom gehalten wird. Im Gegensatz zur Hohlkathodenlampe ist hier eine hohe Strahlungsdichte über den gesamten relevanten Spektralbereich gewährleistet. Jedoch erreicht die Lampe hohe Temperaturen von bis zu 10.000 K, weshalb die Anode als Kühlvorrichtung mit Wasserkanälen durchzogen ist. 15
C Wenn es zu Spektralen Interferenzen wie der Untergrundabsorption kommt, kann vor allem bei der F-AAS eine Deuteriumlampe zur Untergrundkorrektur verwendet werden. Bei der GF-AAS wird eine Zeemann-Untergrundkompensation vorgenommen. 16
D Die Elektrodenlose Entladungslampe eignet sich nur zur Bestimmung von leicht verdampfbaren Elementen, wie zum Beispiel Selen, Blei, Natrium, Kalium, Arsen oder Antimon. 17
Interferenzen
Welche Aussagen über Interferenzen bei der Atomspektroskopie treffen zu?
- Als Ionisationspuffer wird in der Regel Calciumbromid verwendet.
- Aus der Boltzmann-Gleichung geht hervor, dass mit steigender Temperatur die Anzahl der angeregten Atome und demnach auch die Intensität der Lichtemission zunimmt.
- Die Emission nimmt stark ab, wenn die Temperatur so groß ist, dass auch Ionen angeregt werden.
- Bei der ICP-OES verursachen Ionisationen häufig eine starke Störung der Messung.
- Um Transportinterferenzen zu kompensieren, kann die Standardadditionsmethode angewendet werden.
- nur 2 und 5
- nur 2 und 3
- nur 1, 2, 4 und 5
- nur 2, 3, 4 und 5
- 1 bis 5 (alle)
Antwort A ist korrekt
1 Als Ionisationspuffer werden häufig Kalium-, Cäsium-, Rubidium- und Strontiumsalze eingesetzt, da diese relativ leicht ionisierbar sind.18
2 Anhand der Boltzmann-Gleichung lässt sich ableiten, dass die Anzahl der angeregten Atome sowohl proportional zur Temperatur als auch zur Emission ist, da die angeregten Atome Licht emittieren. 19
3 Auch hier geht es um einen Rückschluss auf die Boltzmann-Gleichung. Jedoch nimmt die Emission stark zu, wenn es zu einer Anregung von Ionen kommt, da diese ebenfalls Licht emittieren. Dabei entstehen sogenannte Ionenspektren, die meist als Interferenzen auftreten. 20
⚠ $$ \left(\frac{N^*}{N_{0}}\right) = g \cdot e^\left(\frac{-∆E}{k \cdot T}\right) ⚠ $$
- N*: Zahl der angeregten Atome
- N0: Zahl der Atome im Grundzustand
- g: statistischer Faktor
- ΔE: Anregungsenergie
- k: Boltzmann-Konstante [J/K]
- T: Temperatur [K]
4 Bei der ICP-OES kommt es zur Ionisierung aufgrund der hohen verwendeten Temperaturen (6000-10000K). Dies ist jedoch gewollt, da hier Ionenspektren und keine Atomspektren untersucht werden. 21
5 Transportinterferenzen entstehen durch Störungen beim Zerstäuben und die daraus resultierende Variabilität der Tröpfchengröße der Analytlösung, die in die Flamme gelangt. Verhindert werden kann diese Nicht-spektrale Interferenz durch Anpassung der Kalibrierlösung an die Prüflösung, oder durch Anwenden der Standardadditionsmethode, um eine erhöhte Richtigkeit zu erreichen. 22 23
Textaufgaben
Atomemissionsspektroskopie
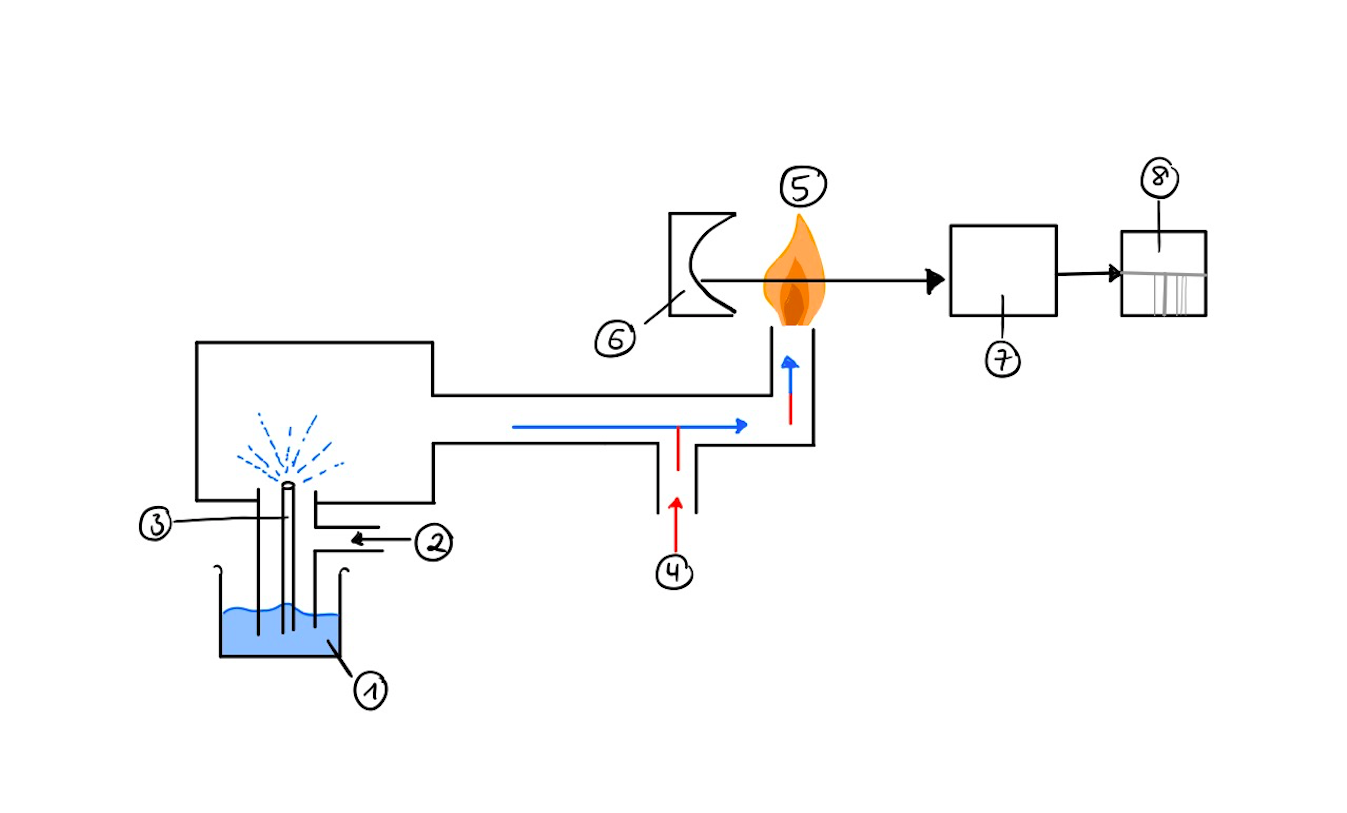
- In Abb.1 sehen Sie den allgemeinen Aufbau eines Flammen-Atomemissionsspektrometers. Benennen Sie alle Bauteile und beschreiben Sie kurz die jeweilige Funktion.
1) Behälter mit gelöster Probe
2) Pressluft: befördert flüssige Probe nach oben in den Zerstäuber und dann weiter Richtung Flamme
3) Zerstäuber: sprüht flüssige Probe in die Zerstäuberkammer
4) Brenngasgemisch: bestehend aus Brenngas und Oxidationsmittel zur Erzeugung einer Flamme
5) Flamme: Atomisierung der Probe
6) Hohlspiegel: Reflexion der entstandenen Emission Richtung Monochromator
7) Monochromator: Umwandlung des emittierten polychromatischen Lichts in monochromatisches
8) Detektor: detektiert Signal, Umwandlung in ein Spektrum
25
- Erläutern Sie den Unterschied zum Aufbau eines Atomabsorptionsspektrometers und geben Sie zwei konkrete Beispiele für Bauteile, die nur bei der AAS zu finden sind.
Der instrumentelle Aufbau eines Atomabsorptionsspektrometers ähnelt dem des Atomemissionsspektrometers. Grundsätzlich wird bei der AAS jedoch anstelle eines Hohlspiegels, der die Emission der Probe in Richtung Detektor reflektiert, eine Strahlungsquelle zur Anregung der Atome verwendet. Demnach ist ausschließlich bei der AAS eine Hohlkathodenlampe, Elektrodenlose Entladungslampe oder eine Xenonkurzbogenlampe zu finden. Des Weiteren allerdings auch Bauteile von Apparaturen der F-AAS, der Graphitrohr-Technik, Hydrid- oder Kaltdampf-Technik. 26
- Eine weitere wichtige Technik aus der AES ist die sogenannte ICP-OES (inductively coupled Plasma emission spectrometry). Beschreiben Sie kurz, wie das Spektrum entsteht, was bei dieser Technik gemessen wird und arbeiten Sie dabei die wichtigsten Unterschiede zur F-AES heraus. Nennen Sie anschließend die Vor- und Nachteile im Vergleich zur F-AES.
Bei der ICP-OES wird ein induktiv gekoppeltes Plasma, also ein ionisiertes Gas, zur Anregung von Elektronen verwendet. Als Plasma wird Argon, Stickstoff oder Helium benutzt. Dieses Gas wird durch eine Induktionsspule, die Teil eines Hochfrequenz-Generators ist, ionisiert, wobei elektrische Energie auf den Gasstrom übertragen wird.
Ein wichtiger Unterschied zur F-AES ist, dass mit sehr viel höheren Temperaturen (ca. 6000-10000K) gearbeitet wird. Aufgrund dieser hohen Temperaturen findet mehr Atomisierung und auch mehr Ionisierung statt. Die Ionisierung ist aber im Gegensatz zu fast allen anderen atomspektroskopischen Methoden (also auch im Gegensatz zur F-AES) gewollt, da hier die Emission von Ionenspektren und nicht von Atomspektren ausgewertet wird.
Ein Vorteil dieser Technik gegenüber der F-AES ist, dass der Atomisierungsgrad, aufgrund der höheren und homogeneren Temperaturen, höher ist, wodurch geringere Nachweisgrenzen (bis zu 10ppt) erreicht werden. Die hohen Temperaturen sorgen auch dafür, dass fast alle Matrixbestandteile veraschen, was zu wenigeren Störungen führt.
Ein weiterer Vorteil ist, dass Simultanbestimmungen durchgeführt werden können.
Jedoch hat die ICP-OES den Nachteil, dass die Methode durch die hohen Kosten des Argons sehr teuer in der Durchführung ist und es auch hier zu spektralen Interferenzen kommen kann.
Man könnte zusätzlich noch erwähnen, dass ein Nachteil von beiden Techniken ist, dass lediglich gelöste Proben untersucht werden können und keine Feststoffe, Suspensionen oder Emulsionen wie bei der GF-AAS. Dieser Nachteil bezieht sich jedoch nicht mehr auf den Vergleich der Techniken F-AES und ICP-OES, weil es ein gemeinsamer Nachteil beider Techniken ist. 27 28
- Ergänzen Sie den unten stehenden Lückentext.
Ionisationsstörungen treten bei Verwendung von zu _________ ______________ auf. Ausgehend von der _____________- Gleichung ist zu erkennen, dass bei einer Zunahme der ________________ mehr angeregte Atome entstehen, jedoch auch immer mehr Atome ionisiert werden. Dabei kommt es zu einer Verschiebung des _________________ zwischen Atom und Ion in der Flamme in Richtung der Metallionen. Dadurch, dass Ionen eine veränderte __________________ besitzen als Atome, entstehen somit auch andere __________________, die die Messung verfälschen. Dies tritt häufig bei leicht ionisierbaren Alkali- und Erdalkalimetallen auf. Dieser Prozess lässt sich durch Nutzung einer ___________ Flamme oder Verwendung eines Ionisationspuffers vermeiden. Ionisationspuffer sind _________ _______________ Verbindungen, wie z.B. _______________.
Ionisationsstörungen treten bei Verwendung von zu hohen Temperaturen auf. Ausgehend von der Boltzmann-Gleichung ist zu erkennen, dass bei einer Zunahme der Temperatur mehr angeregte Atome entstehen, jedoch auch immer mehr Atome ionisiert werden. Dabei kommt es zu einer Verschiebung des Gleichgewichts zwischen Atom und Ion in der Flamme in Richtung der Metallionen. Dadurch, dass Ionen eine veränderte Elektronenstruktur besitzen als Atome, entstehen somit auch andere Absorptionsspektren, die die Messung verfälschen. Dies tritt häufig bei leicht ionisierbaren Alkali- und Erdalkalimetallen auf. Dieser Prozess lässt sich durch Nutzung einer kälteren Flamme oder Verwendung eines Ionisationspuffers vermeiden. Ionisationspuffer sind leicht ionisierbare Verbindungen, wie z.B. Cäsiumchlorid.
Wie bereits in der Lösung zu Frage 1.5 erläutert, eignen sich Kalium-, Cäsium-, Rubidium- und Strontiumsalze als Ionisationspuffer, also wären für die letzte Lücke auch andere Salze möglich. Cäsiumchlorid wurde hier genannt, weil es auch im Praktikum verwendet wurde. 29 30 31
Sie erhalten die Substanz Medizinische Kohle, die auf Kupfer als Verunreinigung geprüft werden soll.
- 190 µg sind in 5 g Substanz enthalten, laut Arzneibuch liegt der Grenzwert bei 25 ppm. Entspricht die Probe den Anforderungen des Arzneibuchs?
⚠ $$ \frac{190 µg}{5 g}\ = 38 \cdot \frac{µg}{g}\ ⚠ $$ ⚠ $$\frac{10^ {-6} g}{g}\ = 1ppm⚠ $$
Die Probe entspricht mit 38 ppm nicht den Anforderungen des Arzneibuchs. 32
- Mit welchem Verfahren ist diese Menge nachweisbar? Geben Sie auch die Nachweisgrenze für dieses Verfahren an.
Mit der F-AAS lässt sich diese Menge nachweisen, dabei liegt die Nachweisgrenze bei 0,1 ppb - 40 ppm. 33
- Von welchen Faktoren ist die Nachweisgrenze abhängig und womit kann man die Selektivität bei der F-AAS erhöhen?
Die Nachweisgrenzen sind abhängig von der Temperatur, dem zu bestimmenden Element und in manchen Fällen auch von der verwendeten Lampe. 34 Die Selektivität kann durch die Verwendung einer Hohlkathodenlampe stark erhöht werden, da dessen Kathode aus dem zu analysierenden Element besteht, beziehungsweise mit diesem gefüllt ist und entsprechend das Emissionsspektrum dieses Elements erzeugt. So kann die Absorption des Analyten selektiver detektiert werden. 35
- Sie verwenden eine Hohlkathodenlampe zur Bestimmung. Es kommt bei der ersten Messung jedoch zu Lichtstreuung. Welche Möglichkeit gibt es, dieses Problem zu umgehen? Erläutern Sie, wie sich in diesem Fall die tatsächliche Absorption berechnet.
Durch die Verwendung einer Deuteriumlampe lässt sich eine Deuterium (D2) - Untergrundkompensation durchführen, bei der die Untergrundabsorption ermittelt wird. Es wird abwechselnd mit beiden Lampen gemessen. Die Deuteriumlampe, ein Kontinuumstrahler, strahlt ein großes Wellenlängenband aus, wodurch sich eine Absorption ermitteln lässt, die fast ausschließlich auf dem Untergrund beruht. Die Hohlkathodenlampe als Linienstrahler misst die Gesamtabsorption. Die Atomabsorption berechnet sich dadurch, dass die Absorption nach der Messung mit der Deuteriumlampe von der Absorption nach der Messung mit der Hohlkathodenlampe subtrahiert wird.⚠ $$A(HKL) - A(D_2) = Atomabsorption⚠ $$ 36
- Bei der AAS ist es auch möglich, mit der Graphitrohrtechnik zu arbeiten. Was sind die Vorteile dieser Technik gegenüber der F-AAS?
Bei der Graphitrohrtechnik kommt es seltener zu Interferenzen, da hier Matrixbestandteile abgetrennt werden können und eine Inertgasatmosphäre herrscht, anders als bei der F-AAS. Dort bestimmen die Flammengase die chemische Umgebung. Ein weiterer Vorteil ist die größere Empfindlichkeit der GF-AAS, da hier die Probe 2-3 mal länger im Absorptionsvolumen verbleibt. Mit der GF-AAS können darüber hinaus durch Anreicherungsverfahren geringere Mengen einer Probe vermessen werden. Auch Suspensionen, Emulsionen und Feststoffe lassen sich ohne weitere Vorbereitung mit der GF-AAS vermessen, was einen großen Vorteil gegenüber der F-AAS darstellt. Die Nachweisgrenze liegt hier bei 0,5 ppt- 0,1 ppm und ist viel geringer als bei der F-AAS (0,1ppb-40ppm). Da die Gerätetechnik komplexer und schwieriger in der Handhabung ist, ist die Technik jedoch fehleranfälliger. 37
Einzelnachweise
1 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 11-12 ⇑
2 Arzneibuch-Kommentar zur Monographie 2.2.23 "Atomabsorptionsspektrometrie". Wissenschaftliche Erläuterungen zum Arzneibuch (2018). Stuttgart: Wiss. Verl.-Ges. ⇑
3 Dr. Thomas Kellner: Optische Methoden: Fluoreszenzspektroskopie WiSe 2021/22, S. 6 ⇑
4 https://www.chemie.de/lexikon/Spektrallinie, abgerufen am 15.06.2022, 20:34 Uhr ⇑
5 http://www-dick.chemie.uni-regensburg.de/studium/files/Elektronische_Uebergaenge_in_Atomen.pdf, abgerufen am 15.06.2022, 20:30 Uhr ⇑
6 Rücker, Neugebauer, Willems: Instrumentelle pharmazeutische Analytik, 5. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft mbH, 2013. S. 88 ⇑
7 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 6, 7, 36, 43, 69 ⇑
8 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 49 ⇑
9 Katharina Beier: Seminar zum Praktikum Instrumentelle Analytik Gaschromatographie, SoSe 2022, S. 10 ⇑
10 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 53 ⇑
11 Rücker, Neugebauer, Willems: Instrumentelle pharmazeutische Analytik, 5. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft mbH, 2013. S. 90 ⇑
12 J.Knecht: Lexikon der Medizinischen Laboratoriumsdiagnostik , 3. Auflage. Springer-Verlag, 2019. S. 222-224 ⇑
13 Dr. Thomas Kellner: Optische Methoden: Infrarot-Spektroskopie WiSe 2021/22, S. 27 ⇑
14 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 35 ⇑
15 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 40 ⇑
16 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 57 ⇑
17 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 38 ⇑
18 J. Knecht: Lexikon der Medizinischen Laboratoriumsdiagnostik, 3. Auflage. Springer-Verlag, 2019. S. 222-224 ⇑
19 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 23 ⇑
20 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 28 ⇑
21 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 28 ⇑
22 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 23, 28, 62 ⇑
23 Dr. Thomas Kellner: Praktikumsskript Instrumentelle Analytik 4. Semester Pharmazie SoSe-2022; Version 10 (Corona), 11. April 2022; S. 61 ⇑
24 eigene Grafik, in Anlehnung an: Rücker, Neugebauer, Willems: Instrumentelle pharmazeutische Analytik, 5. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft mbH, 2013. S. 79. erstellt mit Notability; Urheber: Lena Sasse, 23.05.2022 ⇑
25 Rücker, Neugebauer, Willems: Instrumentelle pharmazeutische Analytik, 5. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft mbH, 2013. S. 79-80 ⇑
26 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 42-53 ⇑
27 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 26-29 ⇑
28 https://pharmchem.de.cool/wiki/Instru/Atomemissionsspektroskopie#toc-1.4.3 | abgerufen am 13.06.2022, 14:44 Uhr ⇑
29 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 64 ⇑
30 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 23-24 ⇑
31 J. Knecht: Lexikon der Medizinischen Laboratoriumsdiagnostik, 3. Auflage. Springer-Verlag, 2019. S. 222-224 ⇑
32 Europäisches Arzneibuch 10. Ausgabe, Grundwerk 2020 inkl. 4. Nachtrag (Monographie: 10.0/0313) ⇑
33 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 69 ⇑
34 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 69 ⇑
35 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 34 ⇑
36 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 58-60 ⇑
37 Christin Scheller: Atomspektroskopische Analyseverfahren, WiSe 2021/22, S. 50-51 ⇑