Atomspektroskopie
Atomabsorptionsspektroskopie
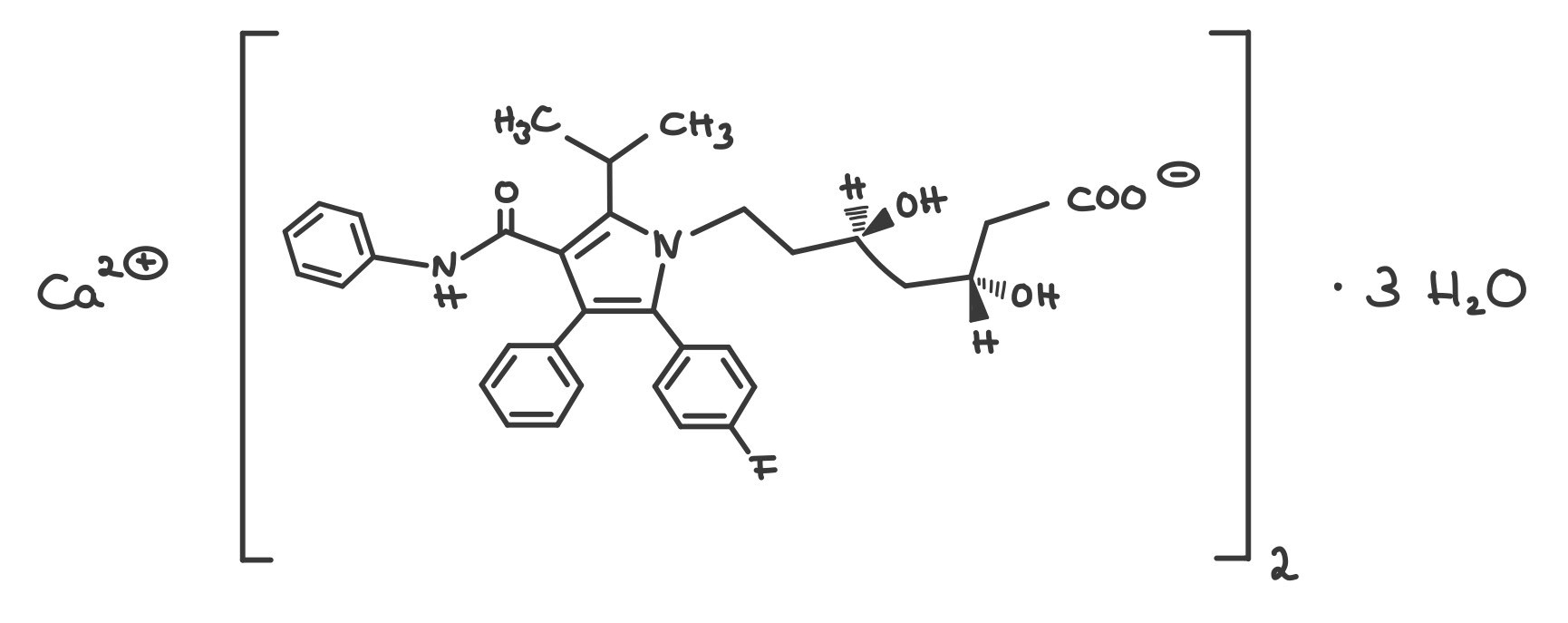
Atorvastatin-Calcium-Trihydrat
Atomabsorptionsspektroskopie
WiSe 2022/2023
Abgabedatum
08.01.2023
Expertengruppe 08
Charlotte Leidner
Anastasia Mironov
Julia Lüneberg
Alina Blomenkamp
Anwendungsbeispiel der Atomabsorptionsspektroskopie aus dem Europäischen Arzneibuch.
Prüfung auf Reinheit von Atorvastatin-Calcium-Trihydrat (Ph.Eur. 10.4/2191) mit der Atomabsorptionsspektroskopie (Ph.Eur. 2.2.23)
Inhaltsverzeichnis
Stoffcharakterisierung
Atorvastatin-Calcium-Trihydrat ist ein geruchloses, weißes bis fast weißes Pulver. Es ist sehr schwer löslich in Wasser, bei pH-Werten unter 4 praktisch unlöslich. Der Arzneistoff ist in Ethanol 96 % schwer, in Methanol hingegen leicht löslich. Der pKa-Wert liegt bei 4,46. Die Substanz zeigt Polymorphie. 2
Atorvastatin gehört zur Arzneistoff-Gruppe der Statine und wird zur Senkung des Cholesterinspiegels bei Atherosklerose und unterstützend bei kardiovaskulären Erkrankungen angewendet. Cholesterin ist ein körpereigener Stoff, der in der Leber gebildet und abgebaut wird. Es ist Bestandteil von Zellmembranen, vielen Hormonen (Corticosteroide, Sexualhormone), Gallensäure und Vitamin D3.
Bei Atorvastatin handelt es sich um einen CSE-Hemmer (CSE = Cholesterin-Synthese-Enzym), denn es hemmt das Enzym HGM-CoA-Reduktase kompetitiv, das in der Leber die Cholesterin-Synthese katalysiert. Durch die Blockade dieses Teilschritts der körpereigenen Cholesterin-Synthese wird das Angebot an Cholesterin im Körper vermindert. In einem Feedback-Mechanismus werden nun vom Körper vermehrt LDL-Rezeptoren (LDL = Low Density Lipoprotein) gebildet. Dies hat zur Folge, dass mehr Cholesterin aus dem Blut aufgenommen wird und damit auch die LDL-Konzentration und der Gesamtcholesterin-Spiegel im Blut sinken, die HDL-Konzentration (HDL = High Density Lipoprotein) hingegen steigt. 3
Versuchsdurchführung
Grundlagen der Atomabsorptionsspektrometrie
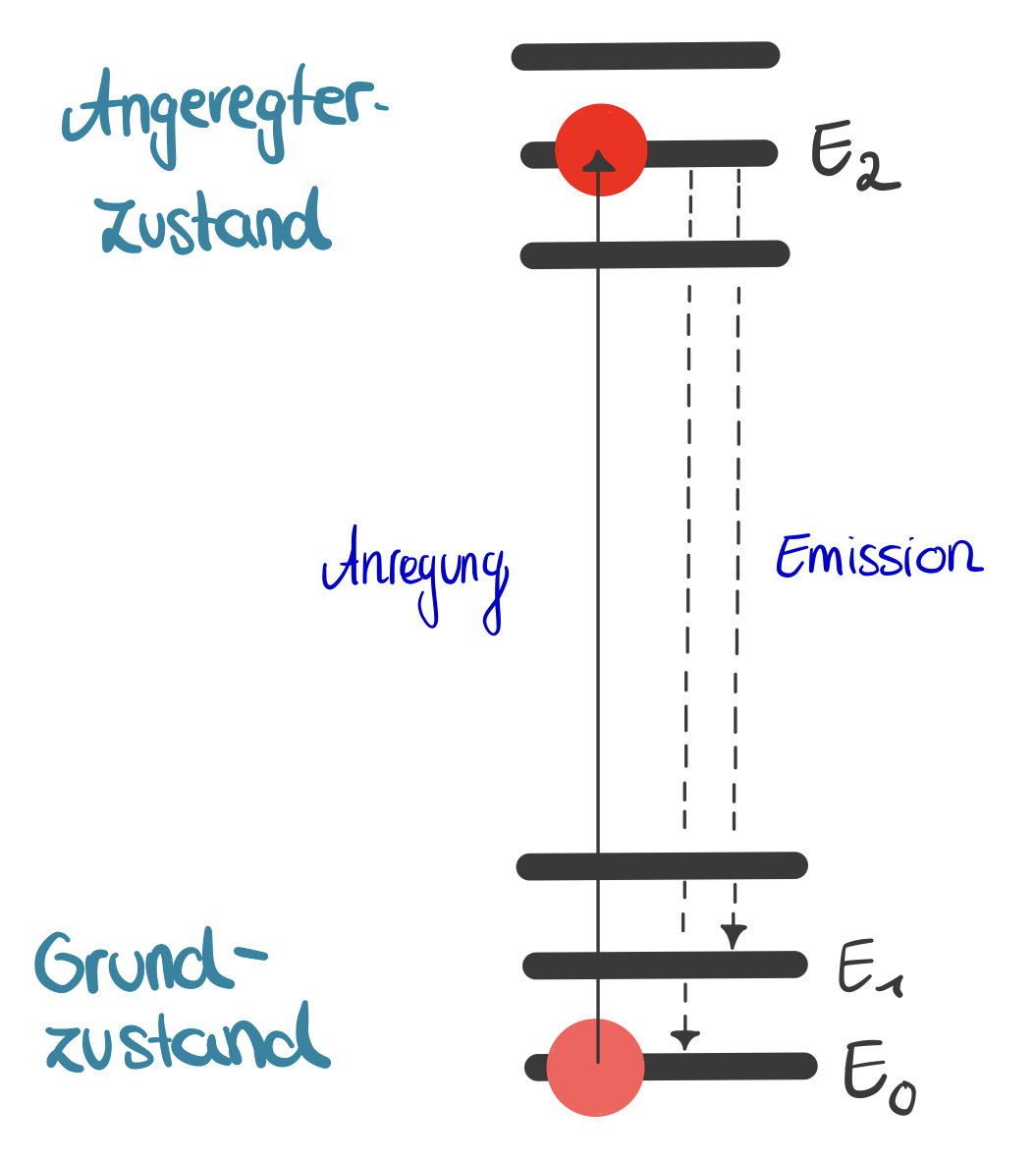
Bei der Atomabsorptionsspektrometrie handelt es sich um eine Methode zur Bestimmung von Elementen oder zur Prüfung auf Reinheit. Sie basiert grundlegend auf der Resonanzabsorption in Gasen. Atome im Grundzustand absorbieren elektromagnetische Strahlung einer spezifischen Wellenlänge und gehen in einen angeregten Zustand über. Dabei absorbieren die Atome im Grundzustand Energie bei ihrer Resonanzfrequenz (maximale Amplitude einer erzwungenen Schwingung), dadurch wird die elektromagnetische Strahlung entsprechend der Resonanzabsorption vermindert. Die Energieabsorption ist proportional zur Anzahl der vorhandenen Atome. 4
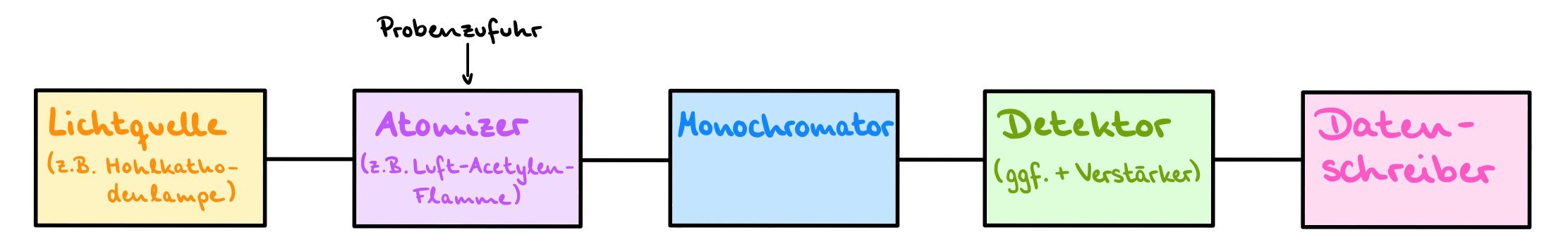
Geräteaufbau
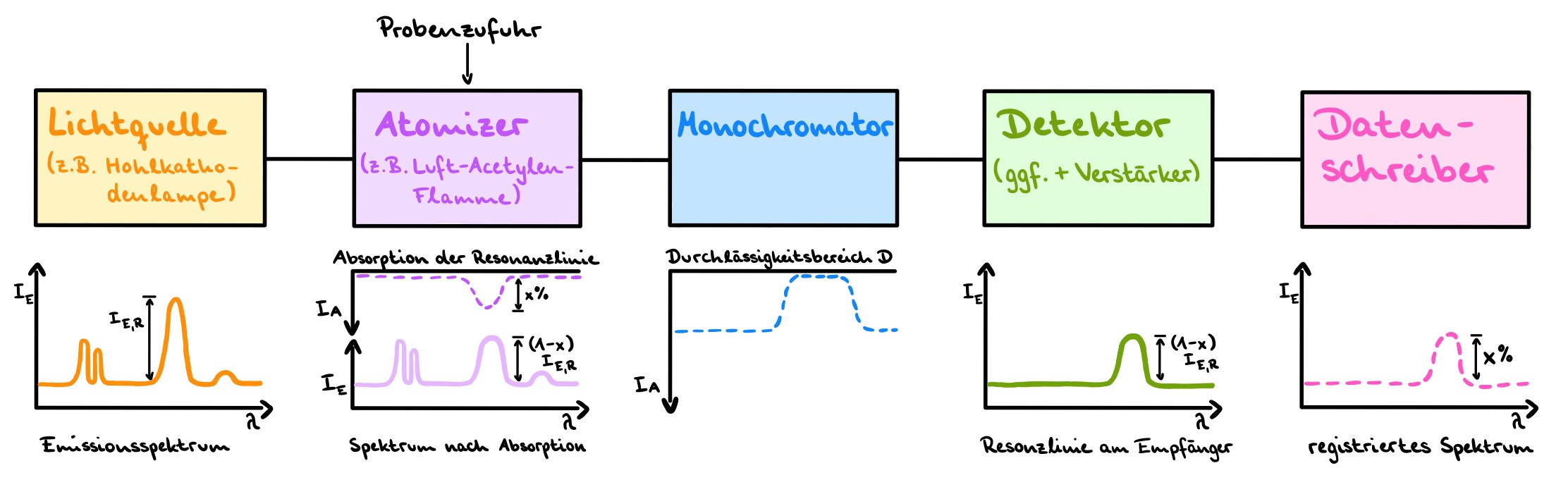
Benötigt wird immer eine Strahlungsquelle (z.B. Hohlkathodenlampe, Xenonkurzbogenlampe), sodass Licht vom zu prüfenden Stoff absorbiert werden kann. Außerdem muss die Probe zunächst atomisiert werden, also thermisch in einzelne Atome gespalten werden. Dies geschieht meistens durch die Flammen- oder die Graphitrohr-Technik. Benötigt wird ebenfalls ein Monochromator, um einen bestimmten Durchlässigkeitsbereich für das Licht einzustellen, ein Detektor und eine Datenverarbeitungseinheit. Das Gerät ist normalerweise ebenfalls mit einem Untergrundkorrektursystem ausgerüstet. 6

Flammen-Absorptionsspektrometer im Praktikum 7
Arzneibuchmethode und Kalibrierung
In der Arzneibuchmonographie von Atorvastatin-Calcium-Trihydrat ist die Atomabsorptionsspektrometrie unter dem Punkt „Prüfung auf Reinheit“ zu finden. Hierbei soll auf Verunreinigungen von Natrium untersucht werden. Bezogen auf die wasserfreie Substanz darf maximal 0,4 % Natrium enthalten sein.8 Dazu wird zuerst eine Kalibrierung durchgeführt, dies erfolgt entweder mit der Methode der direkten Kalibrierung (Methode I) oder mit der Standardadditionsmethode (Methode II). Das Arzneibuch schlägt für Atorvastatin Methode I aus der Monographie der Atomabsorptionsspektrometrie (2.2.23) vor. Diese funktioniert wie folgt:
Es werden mindestens 3 Referenzlösungen des Arzneistoffes und eine Blindlösung hergestellt und geprüft. Die Referenzlösungen werden aus der Natrium-Lösung (50 ppm Na) R durch Verdünnen mit der Lösungsmittelmischung hergestellt. Die Lösungsmittelmischung besteht aus Salzsäure R, Wasser R und Methanol R (2:25:75 V/V/V). Die Referenzlösungen sollten Konzentrationen aufweisen, die im Bereich der vermuteten Konzentrationen der Untersuchungslösung liegen. Nach Arzneibuch liegt ein optimaler
Kalibrierbereich zwischen der Nachweisgrenze und dem 1,2-fachen des festgelegten Grenzwerts für Natrium. Dieser liegt bei höchstens 0,4 %, bezogen auf die wasserfreie Substanz. Alle bei der Herstellung der Untersuchungslösung verwendeten Reagenzien werden in der gleichen Konzentration, den Referenzlösungen und der Blindlösung hinzugesetzt.
Jede Lösung kann nun in das Gerät eingebracht und gemessen werden. Dabei wird darauf geachtet, dass für jede Lösung die gleiche Anzahl an Wiederholungen eingestellt wird, um reproduzierbare Messwerte zu erhalten. Aus den Mittelwerten der erhaltenen Messwerte jeder Referenzlösung wird eine Kalibrierkurve erstellt, sodass die Konzentration von Natrium in der Untersuchungslösung aus der Kurve ermittelt werden kann.
Für die Untersuchungslösung werden 5,0 mg Atorvastatin mit der Lösungsmittelmischung zu 100,0 mL gelöst. 9
Durchführung
Die Messung mit dem Gerät funktioniert folgendermaßen: Als Strahlungsquelle wird eine Natriumhohlkathodenlampe verwendet, die Licht mit einer Wellenlänge von 598 nm emittiert. Sie erzeugt durch eine elektrische Glimmentladung das Emissionsspektrum von Natrium und weist außerdem eine sehr hohe Selektivität auf, da die Kathode aus Natrium besteht.
Der Brennerwinkel wird auf 0° gestellt. Die Probe wird vom Gerät aufgenommen und über einer Luft-Acetylen-Flamme im Strahlengang zerstäubt, wobei die Flamme zur Atomisierung dient. Die Probe wird also in ihre einzelnen Atome gespalten. Sie absorbiert im Bereich der Resonanzlinie. Diese ist eine Absorptionslinie, die sich durch die Absorption eines Photons des eintreffenden Lichts ergibt, wodurch ein Übergang von einem niedrigeren auf ein höheres Energieniveau möglich ist. Es kommt zur Schwächung der Intensität des Primärlichts bei einer bestimmten Wellenlänge. Hierbei wird zusätzlich durch einen Monochromator dafür gesorgt, dass nur der Bereich der Resonanzlinie betrachtet wird. Der Detektor misst das Primärlicht mit abgeschwächter Intensität und die Daten werden von einem Computer erfasst. Die Intensität der Resonanzlinie steht hierbei in Zusammenhang zur Anzahl der absorbierenden Teilchen, da abhängig von der Probe und ihrer Konzentration mehr oder weniger Licht absorbiert wird, wodurch die Probe letztendlich auch qualifiziert werden kann. 11 12
Auswertung/ Interpretation/ Bedeutung und Eignung
Die Nutzung der Flammen-AAS weist viele Vorteile auf. Sie ist geeignet für qualitative und quantitative Analysen, besonders für Alkali- und Erdalkalimetalle. Deswegen ist die Methode auch zur Prüfung auf Verunreinigung durch Natrium bei Atorvastatin-Calcium-Trihydrat geeignet. Durch die Flamme ist eine schnelle Anregung der Atome möglich und durch die Nutzung einer Natriumhohlkathodenlampe, welche durch das Material der Kathode stoffspezifisch ist, ist eine hohe Selektivität gegeben. Durch den Einsatz eines Monochromators ist es ebenfalls möglich, nur den Bereich der Resonanzlinie zu betrachten und die restliche Strahlung auszublenden. Außerdem hat die Methode oft eine sehr geringe Nachweisgrenze von unter einem ppm.
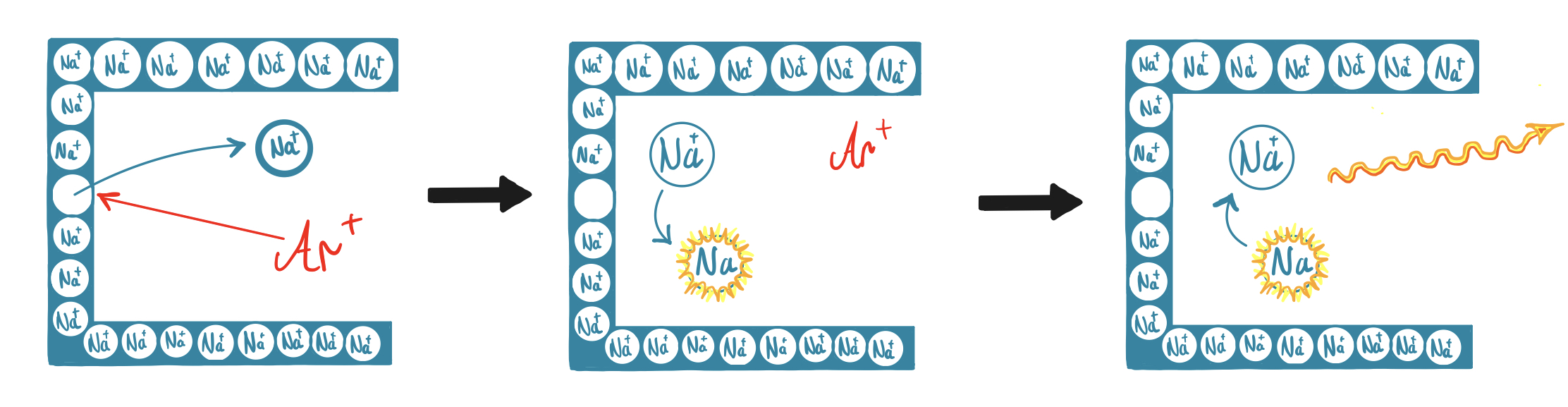
Es sind allerdings auch einige Nachteile gegeben. Bei Natrium kommt es, sowie generell bei Alkali- und Erdalkalielementen, oft zu chemischen Interferenzen durch Ionisationsstörungen. Dabei bilden leicht ionisierbare Elemente in der Flamme zu einem hohen Anteil Ionen und nicht nur Atome aus. Dadurch wird das Messsignal verringert. Die Störungen können jedoch durch den Einsatz eines Ionisationspuffers weitestgehend ausgeglichen werden, indem dieser in der Flamme ionisiert wird und somit die Ionisation des Analyten verhindert. Beim Nachweis von mehreren Elementen nebeneinander kann es selten auch zu spektralen Interferenzen kommen, indem sich die benachbarten Spektrallinien verschiedener Elemente überlagern. Gerade bei der Flammen-AAS werden auch große Probenvolumina benötigt, da das Gerät kontinuierlich Lösung aufnimmt. Dies ist bei der Graphitrohr-Technik nicht der Fall. Generell weist die Graphitrohr-Technik einige Vorteile gegenüber der Flammen-Technik auf, weshalb nach Möglichkeit diese genutzt werden sollte. 14 15
Übungsaufgaben
Multiple Choice (MC) Frage
Welche Vorteile bietet die Flammen-AAS bei der Prüfung auf Reinheit von Atorvastatin?
- Geringe Probenvolumina können vermessen werden.
- Die Substanz kann als Feststoff vermessen werden.
- Die Methode ist durch die Natriumhohlkathodenlampe selektiv.
- Die Methode hat eine geringe Nachweisgrenze.
- Nur der Bereich der Resonanzlinie wird betrachtet.
- Nur 1 ist richtig.
- 2 und 3 ist richtig.
- 4 und 5 sind richtig.
- 3, 4 und 5 sind richtig.
- Alle sind richtig.
Antwort D ist korrekt.
1: Nicht möglich, da das Gerät kontinuierlich Probelösung aufnimmt und dafür ein relativ großes Volumen notwendig ist.
2: Falsch, durch Geräteaufbau nicht möglich.
3: Richtig, die Kathode besteht aus demselben Material wie die zu analysierende Substanz und weist daher eine hohe Selektivität auf.
4: Richtig, die F-AAS hat oft eine Nachweisgrenze von unter einem ppm.
5: Richtig, da durch den Monochromator ein Durchlässigkeitsbereich eingestellt werden kann. 16
Textaufgabe
In folgendem Beispiel soll eine Hämodialyselösung mithilfe eines atomsprektroskopischen Verfahrens auf Reinheit geprüft werden. Aluminium darf zu höchstens 10 µg/L enthalten sein. Bei der Gehaltsbestimmung wird unter anderem auf Natrium und Magnesium geprüft. Als Reinheitsbestimmung auf Aluminium soll eine Graphitrohr-AAS und für die Gehaltsbestimmung von Natrium und Magnesium eine Flammen-AAS angewendet werden.
- Warum macht eine GF-AAS bei Aluminium mehr Sinn als eine F-AAS?
Da Aluminium zu höchstens 10 µg/L enthalten sein darf, bietet sich in diesem Fall eine GF-AAS an, da die Nachweisgrenze bei dieser Methode geringer ist als bei der F-AAS. 17
- Es soll ebenfalls auf Cer geprüft werden. Ist dies mit der GF-AAS möglich? Begründen Sie Ihre Antwort.
Da wir bei der GF-AAS im hohen Temperaturbereich arbeiten und man Temperaturen bis zu 3000 °C erreicht, ist die Prüfung auf Cer nicht möglich, da es bereits ab einer Temperatur von 200 °C Oxide bildet und hochreaktiv ist. 18
- Zeichen Sie den schematischen Aufbau eines Atomabsorptionsspektrometers.
- Nennen Sie zwei mögliche Strahlungsquellen und zwei mögliche Atomizer.
Strahlungsquellen: Hohlkathodenlampe, Xenonkurzbogenlampe, (elektrodenlose Entladungslampe)
Atomizer: Flamme, Graphitrohr, Quarzküvette 20
- Nennen Sie jeweils zwei spektrale und zwei nicht-spektrale Interferenzen und erklären Sie diese kurz.
Spektrale Interferenzen:
Überlappung: Überlappung von zwei benachbarten Spektrallinien von verschiedenen Elementen, Abstände von kleiner als 0,01 nm sind dabei problematisch.
Untergrundabsorption: Die Strahlungsintensität der Strahlungsquelle wird durch Nebeneffekte aus Begleitsubstanzen vermindert.
Nicht-spektrale Interferenzen:
Transportinterferenz: Störung bei der Zerstäubung, daraus folgt eine Beeinflussung der Ansaugrate des Zerstäubers und variierende Tröpfchengrößen, die pro Zeiteinheit zur Flamme gelangen.
Verdampfungsinterferenzen und Ionisationsstörungen: Durch Nebenreaktionen mit Probenbestandteilen, Bestandteilen der Flamme oder des Lösungsmittels, sind Bildungen von schwer schmelzbaren oder verdampfbaren Verbindungen möglich. Dadurch wird Anzahl der gebildeten Atome verringert. 21
Einzelnachweise
1 Eigene Zeichnung von Julia Lüneberg ⇑
2 Kommentar zur Ph. Eur. 10.4/2191: Atorvastatin-Calcium-Trihydrat (https://arzneibuch.de/arzneibuch/arzneibuch/start.xav#__arzneibuch__%2F%2F*%5B%40attr_id%3D%27abk_mono-2191%27%5D__1673035293321) 25.11.2022, 17.23 Uhr ⇑
3 https://flexikon.doccheck.com/de/Atorvastatin?utm_source=www.doccheck.com&utm_medium=DC%2520Search&utm_campaign=DC%2520Search%2520content_type%253Aall&utm_content=DC%2520Search%2520Atorvastatin; 28.11.2022, 15:30 Uhr ⇑
4 Europäisches Arzneibuch Online: Monographie 2.2.23 Atomabsorptionsspektrometrie (https://arzneibuch.de/arzneibuch/arzneibuch/start.xav#__arzneibuch__%2F%2F*%5B%40attr_id%3D%27eab_numtext-2.02.23.00%27%5D__1673035428530) 25.11.2022, 18.02 Uhr ⇑
5 Eigene Zeichnung von Anastasia Mironov ⇑
6 Seminarskript Instrumentelle Analytik: Atomspektrometrische Analyseverfahren; Christin Scheller; Seite 17 ff. (WiSe 21/22) ⇑
7 Eigenes Foto von Julia Lüneberg ⇑
8 Kommentar zur Ph. Eur. 10.4/2191: Atorvastatin-Calcium-Trihydrat (https://arzneibuch.de/arzneibuch/arzneibuch/start.xav#__arzneibuch__%2F%2F*%5B%40attr_id%3D%27abk_mono-2191%27%5D__1673035293321) 25.11.2022, 17.46 Uhr ⇑
9 Europäisches Arzneibuch Online: Monographie 2.2.23 Atomabsorptionsspektrometrie (https://arzneibuch.de/arzneibuch/arzneibuch/start.xav#__arzneibuch__%2F%2F*%5B%40attr_id%3D%27eab_numtext-2.02.23.00%27%5D__1673035428530) 25.11.2022, 17.58 Uhr ⇑
10 Eigene Zeichnung von Anastasia Mironov ⇑
11 Seminarskript Instrumentelle Analytik: Atomspektrometrische Analyseverfahren; Christin Scheller; Seite 17 ff. (WiSe 21/22) ⇑
12 Praktikumsskript Instrumentelle Analytik Version 11: Bestimmung von Na, K, Ca und Mg in einer Hämodialyselösung (F-AAS/-AES); Seite 62-65 ⇑
13 Eigene Zeichnung von Charlotte Leidner ⇑
14 Seminarskript Instrumentelle Analytik: Atomspektrometrische Analyseverfahren; Christin Scheller; Seite 17 ff. (WiSe 21/22) ⇑
15 Praktikumsskript Instrumentelle Analytik Version 11: Bestimmung von Na, K, Ca und Mg in einer Hämodialyselösung (F-AAS/-AES); Seite 62-65 ⇑
16 Seminarskript Instrumentelle Analytik: Atomspektrometrische Analyseverfahren; Christin Scheller; Seite 17 ff. (WiSe 21/22) ⇑
17 Seminarskript Instrumentelle Analytik: Atomspektrometrische Analyseverfahren; Christin Scheller; Seite 44 ff. (WiSe 21/22) ⇑
18 Seminarskript Instrumentelle Analytik: Atomspektrometrische Analyseverfahren; Christin Scheller; Seite 44 ff. (WiSe 21/22) ⇑
19 Eigene Zeichnung von Charlotte Leidner ⇑
20 Seminarskript Instrumentelle Analytik: Atomspektrometrische Analyseverfahren; Christin Scheller; Seite 17 ff. (WiSe 21/22) ⇑
21 Seminarskript Instrumentelle Analytik: Atomspektrometrische Analyseverfahren; Christin Scheller; Seite 55 ff. (WiSe 21/22) ⇑