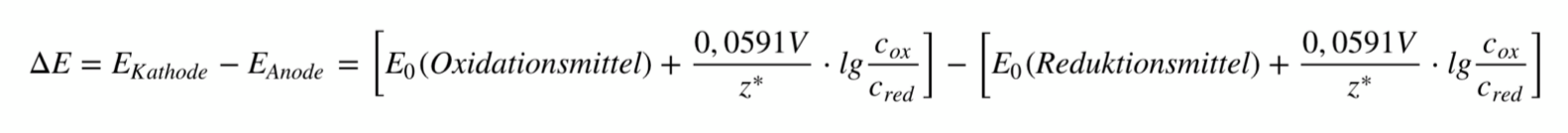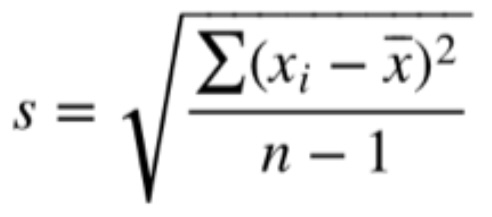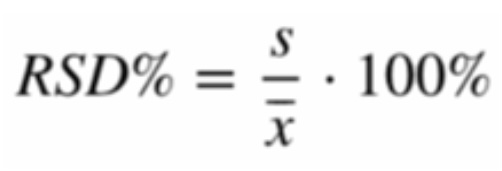Potentiometrie
Titelblatt
Anwendungsbeispiel
Potentiometrie
WiSe 2022/2023
Abgabedatum
29.11.2022
Expertengruppe 01
Moritz Henze
André Rux
Georg Schewtschuk
Luis Scheltdorf
Anwendungsbeispiel der Potentiometrie aus dem Europäischen Arzneibuch.
Potentiometrische Gehaltsbestimmung von Thiamphenicol
Inhaltsverzeichnis
Stoffcharakterisierung
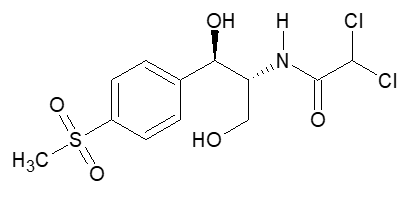
Thiamphenicol ((1R,2R)-2,2-Dichlor-N-[1,3-dihydroxy-1-(4-methylsulfonylphenyl)-propan-2-yl]-acetamid) ist ein breitspektral wirksames Antibiotikum. Es ist ein Derivat des Chloramphenicols und unterscheidet sich von diesem lediglich durch einen Substituenten am Phenylring; statt der Nitrogruppe ist hier ein Methyl-Sulfonyl-Rest substituiert. Dies bedingt eine verlangsamte Resorption und Ausscheidung im Vergleich zu Chloramphenicol, der Wirkmechanismus sowie das Wirkspektrum bleiben hiervon weitestgehend unberührt.2 Bei dem Stoff handelt es sich um ein feines, weißes bis gelblich weißes, kristallines Pulver oder Kristalle.3
Thiamphenicol wirkt über eine irreversible Bindung des Wirkstoffs an die Akzeptorstelle der 50S Untereinheit an den prokaryotischen 70S-Ribosomen, wodurch die Transpeptidierung verhindert wird. Es können keine zur mRNA komplementären tRNA Basentripletts an die durch Translokation freiwerdende Akzeptorstelle binden; die Proteinbiosynthese kommt somit zum Erliegen.4 Thiamphenicol sowie Chloramphenicol wirken somit bakteriostatisch.5
Thiamphenicol wird vor allem in der Veterinärmedizin genutzt. Anwendbar ist der Wirkstoff bei Urogenital-, Atemwegs- und Darminfektionen durch N.gonorrheoeae, H.influenzae oder enterische Salmonellen.6 Besonders bei der Therapie von chloramphenicolresistenten Bakterien kann Thiamphenicol eine wichtige Rolle spielen.7
Versuchsdurchführung
Die Potentiometrie ist eine Methode, bei der die Potentialdifferenz im stromlosen Zustand gemessen wird. Dies ist notwendig, damit die dabei gemessene Potentialdifferenz nicht verfälscht wird. Den stromlosen Zustand erreicht man durch Verwendung eines hochohmigen Voltmeters.8 Diese Potentialdifferenz kommt dadurch zustande, dass man zwei Halbzellen mit unterschiedlichen Potentialen miteinander verbindet. Eine Halbzelle besteht aus einem Metallstab und einer Lösung, in dem das entsprechende Metall als Ion gelöst ist. Halbzellen werden in der Potentiometrie auch als Elektroden bezeichnet. Die Elektrode, an der die Reduktion stattfindet, wird als Kathode bezeichnet. Die Elektrode, an der die Oxidation stattfindet, wird als Anode bezeichnet.9
Die Potentialdifferenz, die dabei entsteht, wird auch als elektromotorische Kraft (kurz: EMK) bezeichnet.10 Berechnen lässt sich die EMK mithilfe folgender Gleichung, die sich aus der Nernst-Gleichung ableitet.
Es werden eine Indikatorelektrode und eine Bezugselektrode zu einer Messkette verbunden, sodass eine Potentialdifferenz zwischen den beiden Elektroden gemessen werden kann.
Im Arzneibuch werden als Indikatorelektroden bzw. Messelektroden Gold-, Platin-, Quecksilber-, Glas- und metallische Silberelektroden verwendet. Als Bezugselektroden bzw. Referenzelektroden werden Silber/Silberchlorid-, Kalomel- und Quecksilbersulfatelektroden genutzt. Bei der Gehaltsbestimmung von Arzneistoffen nach Arzneibuch werden immer häufiger potentiometrische Titrationen eingesetzt, mittlerweile gibt es mehrere hundert Anwendungsbeispiele.12
In unserem Anwendungsbeispiel aus dem Arzneibuch wird der Gehalt von Thiamphenicol mittels potentiometrischer Fällungstitration bestimmt.
Hierzu werden 0,300 g Substanz in 30 mL Ethanol (96%) R gelöst. Dann wird diese Lösung mit 20 mL Kaliumhydroxid R (500 g/L) versetzt, gemischt und anschließend vier Stunden lang zum Rückfluss erhitzt.13 Durch die alkalische Hydrolyse wird hierbei das organisch gebundene Chlor abgespalten.14
Nachdem die Lösung abgekühlt ist, wird diese mit 100 mL Wasser R versetzt, dann mit verdünnter Salpetersäure R neutralisiert und mit 5 mL überschüssiger Salpetersäure versetzt.15 Die Lösung wurde angesäuert, da sonst im Alkalischen bei anschließender Zugabe von Silbernitrat-Lösung Ag+ zu Ag(OH) und anschließend zu Ag2O reagieren würde. Somit würde man bei der Titration falsch positive Werte des Gehalts erhalten.
Schließlich wird mit einer 0,1 M Silbernitrat-Lösung titriert, wobei die frei entstandenen Chlorid-Ionen erfasst werden. Hierbei ist zu beachten, dass pro Mol Thiamphenicol 2 Mol Chlorid-Ionen frei werden. Die Silber-Ionen aus der Maßlösung fallen mit den entstandenen Chlorid-Ionen als schwerlösliches Silberchlorid aus. Der Endpunkt dieser Fällungstitration erfolgt potentiometrisch, wobei ebenfalls eine Blindtitration durchgeführt wird. 1 mL 0,1 M Silbernitrat-Lösung entsprechen 17,81 mg Thiamphenicol (C12H15Cl2NO5S).16

Abb. 3: Beispielhafte potentiometrisch ermittelte Titrationskurven von 0,1 M-Halogenidlösungen mit einer 0,1 M-AgNO3-Lösung18
Auswertung/ Interpretation/ Bedeutung und Eignung
Zunächst wird für die Auswertung der sich ergebende Äquivalenzpunkt nach der Titration benötigt. In unserem Beispiel wird ein Titrierautomat verwendet, bei welchem zum einen die Zugabe an Maßlösung (ML) automatisch gesteuert wird und zum anderen der Äquivalenzpunkt anhand der 1. Ableitung berechnet und digital angezeigt wird. Ohne Titrierautomat kann der Äquivalenzpunkt graphisch mittels Tangenten-Verfahren, Tubbs-Verfahren oder bei ganz exakten Bestimmungen auch mit dem Gran-Verfahren ermittelt werden.19 Nach Möglichkeit erfolgt die Indikation jedoch automatisch, da die Ermittlung des Äquivalenzpunkts aus der Originalkurve zu Fehlern bzw. Ungenauigkeiten führen kann. Insbesondere bei asymmetrischen Kurven, oder durch elektrochemische- sowie Verdünnungseffekte beeinflusste Kurven, bei denen teilweise der Äquivalenzpunkt unerwarteterweise nicht am Punkt der maximalen Steigung liegt, ist ein Titrator definitiv von Vorteil.20 Sonstige Messfehler entspringen in der Regel einem fehlerhaften Potential, welches unter anderem auf einer unbekannten Zusammensetzung des Elektrolyten oder einer Polarisation der Elektroden beruht.21 Bei der Potentiometrie ist generell zu beachten, dass über den Äquivalenzpunkt hinaus titriert werden muss.22
Anschließend kommt es zur Berechnung des Gehalts:
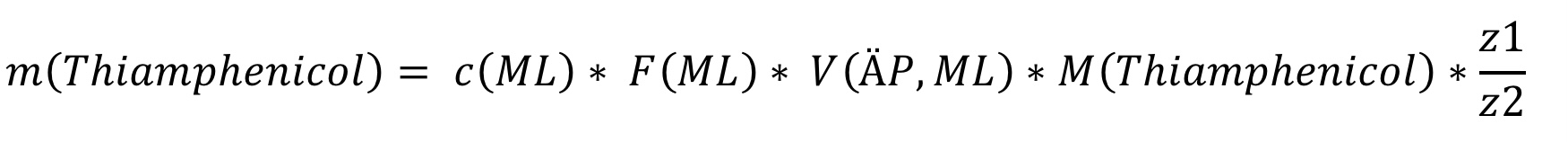
In unserem Beispiel ist das Verhältnis der Äquivalenzzahlen z1 (ML) und z2 (Thiamphenicol) 1:2, weil pro Mol Thiamphenicol 2 Mol Maßlösung umgesetzt werden.
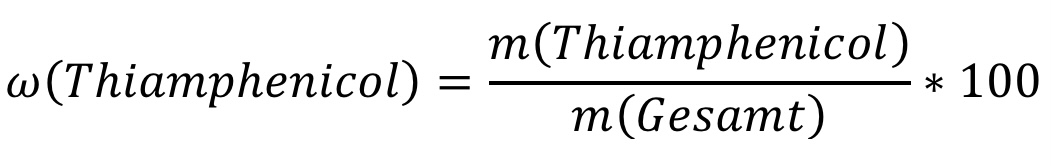
Für m (Gesamt) setzt man die Einwaage ein, in unserem Beispiel waren dies 0,300 g. Damit die mögliche Streuung um einen Mittelwert bei mehrfach durchgeführter Titration berücksichtigt wird, sollte im Anschluss die absolute bzw. relative Standardabweichung (Synonym: Variationskoeffizient) der verschiedenen Werte berechnet werden:
Thiamphenicol wird auch kolorimetrisch quantifiziert. Dabei würde es als 4- Methylsulfonylbenzaldehydhydrazon - nach Vorbereitung - über die Reaktion mit Hydroxylamin/ Eisen (III) kolorimetrisch bestimmt werden. Obwohl Chloramphenicol (Derivat des Thiamphenicol) UV-spektrometrisch bestimmt wird, ist dies bei Thiamphenicol nicht möglich. Das liegt daran, dass das langwellige Maximum des Nitroaromaten fehlt. Daher ist bei einer Messung im langwelligen Bereich die Spezifität der Methode nicht ausreichend.25
Da die UV-Spektroskopie wegfällt und eine kolorimetrische Bestimmung nie so genau sein kann, wie eine automatisch erfasste potentiometrische Gehaltsbestimmung, halten wir die Methode für die sinnvollste, um Thiamphenicol zu quantifizieren. Außerdem handelt es sich um ein relativ günstiges Verfahren.
Übungsaufgaben
Multiple Choice (MC) Frage: Quantifizierung von Thiamphenicol
Welche Aussagen treffen zu?
Thiamphenicol kann theoretisch mit folgenden Methoden quantifiziert werden:
1) Potentiometrisch als Fällungstitration
2) UV-VIS-spektrometrisch
3) Kolorimetrisch
4) Biamperometrisch/Bivoltametrisch
- nur 1 trifft zu.
- 1 und 3 treffen zu.
- nur 4 trifft zu.
- 1, 2 und 3 treffen zu.
- alle Aussagen treffen zu.
Antwort C ist korrekt
Aussage 1: Diese Aussage ist korrekt, weil durch eine alkalische Hydrolyse die Chlorid-Ionen freiwerden und diese mit einer Silbernitrat-Maßlösung über eine Fällungstitration mit potentiometrischer Endpunktbestimmung erfasst werden können.
Aussage 2: Eine Bestimmung mittels UV/VIS-Spektroskopie ist theoretisch möglich. Da das UV-Spektrum von Thiamphenicol aber wenig charakteristisch ist und nur eine dominierende Bande mit einem Maximum bei 224 nm sowie zwei sehr flache Maxima bei 266 und 273 nm zeigt, gibt es wie hier vorgestellt bessere Methoden. Außerdem kann es leicht mit Chloramphenicol verwechselt werden, welches durch einen Nitroaromaten substituiert ist und ein ausgeprägtes Maximum bei 278 nm besitzt.
Aussage 3: Eine kolorimetrische Bestimmung ist möglich, aber aufgrund der geringen Genauigkeit zu vernachlässigen. Auch hier findet zunächst eine alkalische Hydrolyse statt, mit nachfolgender Oxidation durch Periodat und anschließender Reaktion mit Hydrazin. Das hierbei entstehende 4-Methylsulfonylbenzaldehydhydrazon kann kolorimetrisch erfasst werden. Des Weiteren ist eine Reaktion mit Hydroxylamin/ Eisen(III) möglich.
Aussage 4: Dies ist nicht möglich, da Thiamphenicol über kein reversibles Redoxsystem verfügt.27
Textaufgabe:
- Wieso ist bei der potentiometrischen Gehaltsbestimmung von Thiamphenicol als Fällungstitration mit AgNO3 als Maßlösung eine alkalische Hydrolyse notwendig?
Die alkalische Hydrolyse ist notwendig, da so die beiden organisch gebundenen Chlorid-Ionen des Thiamphenicols frei werden und per Fällungstitration erfasst werden können.29
- Thiamphenicol wurde in 25 mL Ethanol gelöst und anschließend potentiometrisch nach alkalischer Hydrolyse und anschließendem Ansäuern mit 0,1 M Silbernitrat-Lösung bestimmt. Der Verbrauch an Silbernitrat-Lösung lag bei 22,16 mL. Der Faktor der Maßlösung beträgt 1,001. Die Molare Masse von Thiamphenicol beträgt 356,223 g/mol. Bestimmen Sie den Gehalt an Thiamphenicol in g/100mL.
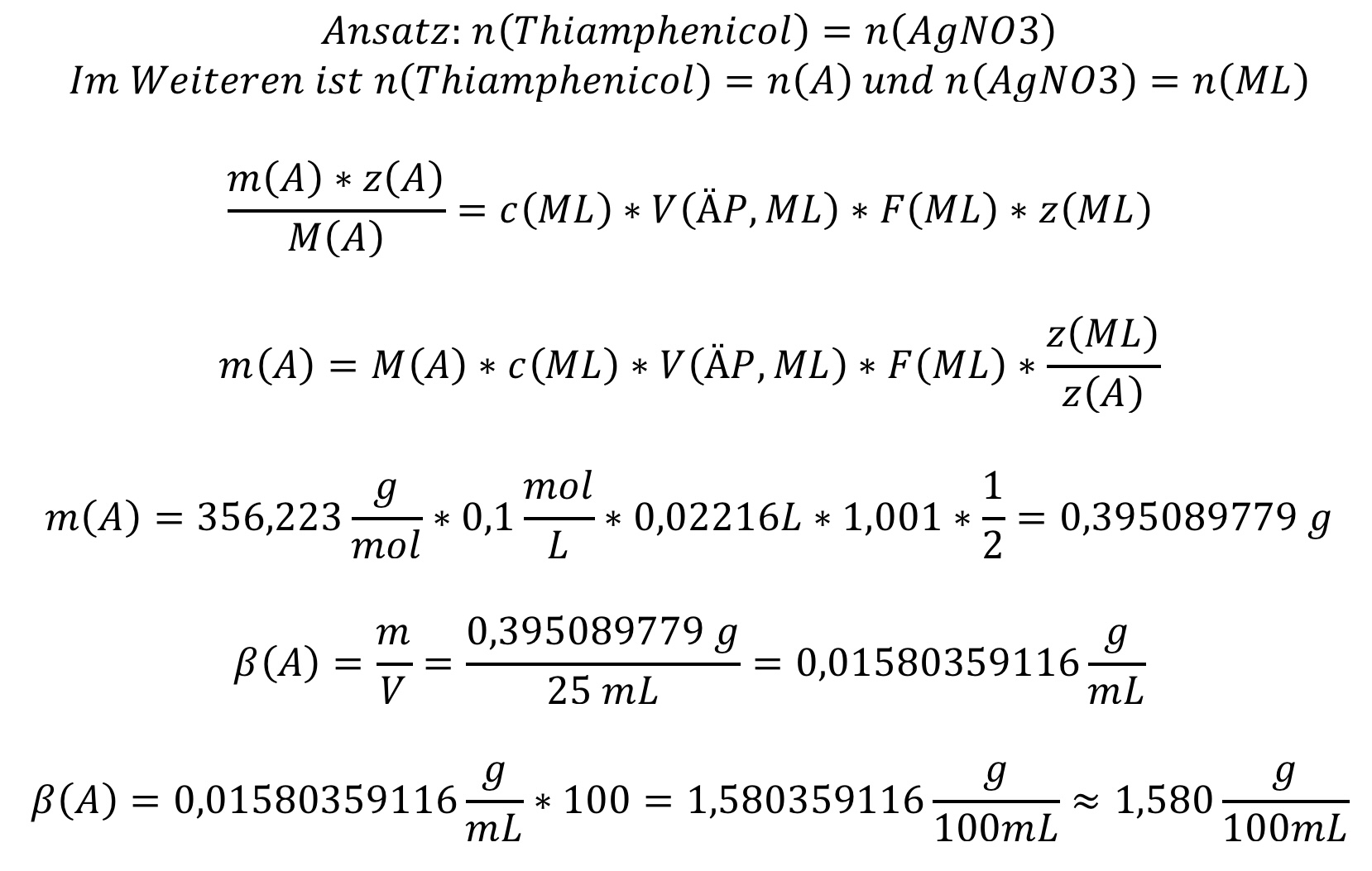
- Mit welcher Gleichung lässt sich das Potential einer Halbzelle berechnen und wie lautet diese?
Es handelt sich hierbei um die Nernst-Gleichung:
- Erklären Sie das Zustandekommen eines elektrochemischen Potentials am Beispiel eines Zink-Stabs in einer Zinksulfat-Lösung.
Taucht man einen Zink-Stab in eine Lösung seiner eigenen Ionen wie z.B. eine Zinksulfat-Lösung, gehen einzelne Zink-Ionen in Lösung, wobei im Metallstab die dazugehörigen Valenzelektronen verbleiben. Es baut sich damit zwischen dem negativ geladenen Zinkstab und der positiv geladenen Lösung ein elektrisches Potential auf, welches dem weiteren Übergehen von Zink-Ionen in Lösung entgegenwirkt. Es werden auch wieder einzelne Zink-Ionen von dem Zink-Stab aufgenommen.
Es stellt sich im Folgenden ein Gleichgewicht ein, wenn pro Zeiteinheit genauso viele Zink-Ionen in Lösung gehen, wie Zink-Ionen wieder vom Zink-Stab aufgenommen werden. Zwischen dem Metallstab und der Lösung besteht dann ein definiertes Potential, was zum einen von der Zinkionen-Konzentration in der Lösung, als auch von der Temperatur abhängig ist. Dieses Halbzellen-Potential ist entsprechend mit der Nernst-Gleichung (s. vorherige Aufgabe) berechenbar.31
Einzelnachweise
Welche Quellen wurden verwendet.
1 ChemDraw, erstellt von André Rux ⇑
2 https://www.spektrum.de/lexikon/biologie/thiamphenicol/66363, Entnahmedatum 21.11.2022, 16:54 Uhr ⇑
3 https://arzneibuch.de/arzneibuch/arzneibuch/start.xav?lang=de#__arzneibuch__%2F%2F*%5B%40attr_id%3D%27eab_mono-0109%27%5D__1669218281003, Entnahmezeitpunkt 23.11.2022, 17:20 Uhr ⇑
4 https://www.vetpharm.uzh.ch/Wirkstoffe/000000000005/6757_02.html, Entnahmezeitpunkt 23.11.2022, 17:34 Uhr ⇑
5 Mutschler Arzneimittelwirkungen, Geisslinger/Menzel/Gudermann/Hinz/Ruth, 11. Auflage, veröffentlicht 2019, S. 1026 ⇑
6 https://ch.oddb.org/de/gcc/fachinfo/reg/31921, Entnahmezeitpunkt: 23.11.2022, 19:02 ⇑
7 https://journals.asm.org/doi/epdf/10.1128/AAC.19.2.294, Entnahmedatum 21.11.2022, 18:28 Uhr ⇑
8 Vorlesungsskript von Dr. Orban: Einführung in die Instrumentelle Analytik: Elektrochemische Methoden, S.27 ⇑
9 Vorlesungsskript von Dr. Orban: Einführung in die Instrumentelle Analytik: Elektrochemische Methoden, S.32 ⇑
10 Vorlesungsskript von Dr. Orban: Einführung in die Instrumentelle Analytik: Elektrochemische Methoden, S.37 ⇑
11 https://pharmchem.de.cool/wiki/Instru/Potentiometrie#fn1_2, Entnahmezeitpunkt 27.11.2022, 13:50 ⇑
12 Instrumentelle pharmazeutische Analytik, Rücker/Neugebauer/Willems, 5. Auflage, veröffentlicht 2013, S. 578 ⇑
13 https://arzneibuch.de/arzneibuch/arzneibuch/start.xav?lang=de#__arzneibuch__%2F%2F*%5B%40attr_id%3D%27eab_mono-0109%27%5D__1669396961788, Entnahmedatum 25.11.2022, 18:24 ⇑
14 https://arzneibuch.de/arzneibuch/arzneibuch/start.xav?lang=de#__arzneibuch__%2F%2F*%5B%40attr_id%3D%27abk_mono-0109%27%5D__1669397138442, Entnahmedatum 25.11.2022, 18:26 ⇑
15 https://arzneibuch.de/arzneibuch/arzneibuch/start.xav?lang=de#__arzneibuch__%2F%2F*%5B%40attr_id%3D%27eab_mono-0109%27%5D__1669396961788, Entnahmedatum 25.11.2022, 18:24 ⇑
16 https://arzneibuch.de/arzneibuch/arzneibuch/start.xav?lang=de#__arzneibuch__%2F%2F*%5B%40attr_id%3D%27eab_mono-0109%27%5D__1669396961788, Entnahmedatum 25.11.2022, 18:24 ⇑
17 Das Gerät aus dem Praktikumslabor, aufgenommen von Moritz Henze und bearbeitet von Georg Schewtschuk ⇑
18 Instrumentelle pharmazeutische Analytik, Rücker/Neugebauer/Willems, 5. Auflage, veröffentlicht 2013, S. 569 ⇑
19 Instrumentelle pharmazeutische Analytik, Rücker/Neugebauer/Willems, 5. Auflage, veröffentlicht 2013, S. 575 ⇑
20 https://www.titrationen.de/physikalisch-indizierte-titrationsmethoden/potentiometrische-titration/#Auswertung_potentiometrischer_Titrationen , Entnahmedatum: 29.12.2022 11:17 Uhr ⇑
21 Instrumentelle Analytik kompakt, Dominik/Steinhilber/Wurglics; 3. Auflage; erschienen 2013; S.292 ⇑
22 Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; 5. Auflage; 2013; S.566 ⇑
23 Quantitative und Instrumentelle Pharmazeutische Analytik; Ehlers, Hofheim/Taunus; 12. Auflage, 2016; S.18 ⇑
24 Quantitative und Instrumentelle Pharmazeutische Analytik; Ehlers, Hofheim/Taunus; 12. Auflage, 2016; S.18 ⇑
25 https://arzneibuch.de/arzneibuch/arzneibuch/start.xav?lang=de#__arzneibuch__%2F%2F*%5B%40attr_id%3D%27abk_mono-0109%27%5D__1669223000207, aufgerufen am 24.11.22 um 18:55 Uhr ⇑
26 ChemDraw, erstellt von André Rux ⇑
27 https://arzneibuch.de/arzneibuch/arzneibuch/start.xav?lang=de#__arzneibuch__%2F%2F*%5B%40attr_id%3D%27abk_mono-0109%27%5D__1669563003974 ⇑
28 ChemDraw, erstellt von André Rux ⇑
29 https://arzneibuch.de/arzneibuch/arzneibuch/start.xav?lang=de#__arzneibuch__%2F%2F*%5B%40attr_id%3D%27eab_mono-0109%27%5D__1669396961788, Entnahmedatum 25.11.2022, 18:24 ⇑
30 Chemie, Mortimer/Müller, 12. Auflage, herausgegeben 2015, S.352 ⇑
31 Chemie, Mortimer/Müller, 12. Auflage, herausgegeben 2015, S.345 ⇑