Hochleistungsflüssigkeitschromatographie
Titelblatt
Anwendungsbeispiel: Reinheitsprüfung Rivaroxaban
Hochleistungsflüssigkeitschromatographie
WiSe 2022/2023
Abgabedatum
23.12.2022
Expertengruppe 04
Aleyna Aslan
Nouralhuda Bitar
Josephine Raabe
Elvira Weber
Anwendungsbeispiel der Hochleistungsflüssigkeitschromatographie aus dem Europäischen Arzneibuch.
Prüfung auf Identität von Rivaroxaban mit der Hochleistungsflüssigkeitschromatographie
Inhaltsverzeichnis
Stoffcharakterisierung
Aussehen:
Rivaroxaban ist ein weißes bis leicht gelbliches, nicht hygroskopisches, geruchloses Pulver. 1
Löslichkeit:
Rivaroxaban ist praktisch unlöslich in Wasser, leicht löslich in Dimethylsulfoxid und praktisch unlöslich in wasserfreiem Ethanol und in Heptan. 2
Indikation:
Der Arzneistoff Rivaroxaban gehört zur Gruppe der Oxazolidinone und ist ein Antikoagulanz 3, welches den Faktor Xa selektiv direkt und reversibel hemmt. 4 Rivaroxaban wird eingesetzt zur Behandlung und Prophylaxe thromboembolischer Erkrankungen (z.B. koronare Herzkrankheit (KHK) oder periphere arterielle Verschlusskrankheit (pAVK)). 5
Metabolismus:
Nach peroraler Einnahme ist die Resorption des Arzneistoffes nahezu vollständig, da
die Bioverfügbarkeit bei ca. 80-100 % im Serum vorliegt. 6
Analytik:
Eine Überprüfung der Identität erfolgt nach Ph.Eur. durch IR-Spektroskopie. Die Reinheitsprüfung wird mittels HPLC durchgeführt. 7
Versuchsdurchführung
Was ist die HPLC?
HPLC steht für high perfomance liquid chromatography und gehört zu den analytischen Trennverfahren zur Identitäts-, Reinheits- und Gehaltsprüfung. Die zu untersuchende Substanz wird dabei mit der mobilen Phase durch eine Trennsäule, welche die stationäre Phase enthält, gepumpt. Je nach Analyten können unterschiedliche Trennmechanismen gewählt werden: Normal-Phase (polare Substanzen), Reversed-Phase (unpolare Substanzen), Trennung nach Molekülgröße (Größenausschluss), Trennung nach Ladung (Ionenaustausch) oder Trennung nach Affinität zu einem Liganden. 8
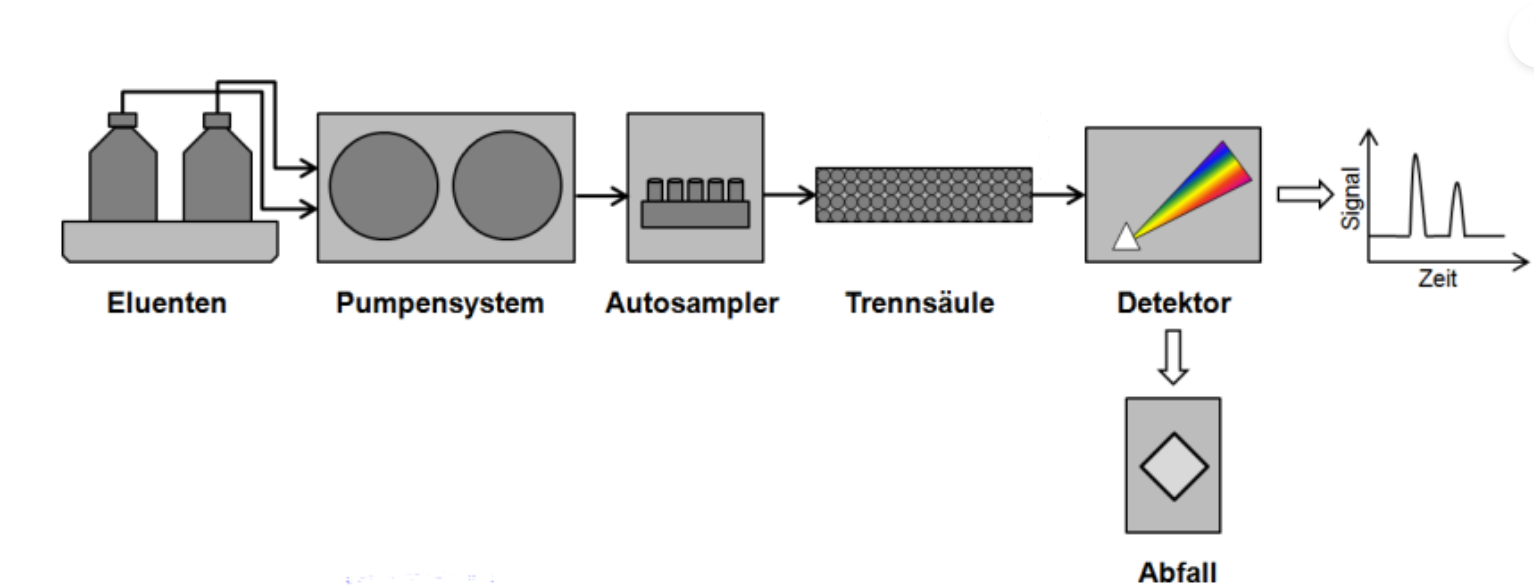
Instrumenteller Aufbau
Die Edelstahlsäule enthält eine stationäre Phase, welche je nach Trennmechanismus beschichtet ist (v.a. SiO2 ).Um das Elutionsmittel pulsfrei in die Säule zu befördern, werden hierfür zwei Pumpen verwendet. Die Probenaufgabe erfolgt entweder manuell oder per Autosampler (siehe Bild). Durch die Säule fließt das hochreine Fließmittel mit dem jeweiligen Analyten. Aufgrund der unterschiedlichen Wechselwirkungen kommt es zur Trennung der einzelnen Komponenten und somit kommen diese zeitversetzt beim Detektor an (meist UV/VIS-Detektor). In einem Chromatogramm werden die Peaks der Probenbestandteile abgebildet, welche qualitativ über die Retentionszeiten und quantitativ über die Peakflächen analysiert werden können. 9
 Autosampler 10
Autosampler 10
HPLC bei Rivaroxaban
In unserem Beispiel erfolgt die Trennung zur Reinheitsprüfung nach Enantiomeren (R-Enantiomer).
Enantiomere lassen sich nicht einfach mit den uns bekannten Säulen trennen, da sich ihre physikalischen und chemischen Eigenschaften kaum unterscheiden. Jedoch unterscheiden sich ihre Wechselwirkung mit linear polarisiertem Licht und chiralen Reagenzien 11, weshalb eine Trennung durch letztere Eigenschaft ermöglicht wird. Es gibt drei Möglichkeiten diese zu trennen: Man kann Enantiomere derivatisieren, jedoch ist dies eine relativ unzuverlässige Methode, da nicht garantiert werden kann, dass alle Enantiomere nach der Reaktion derivatisiert wurden. Eine weitere Möglichkeit wäre, dass Zumischen von chiralen Komponenten in das Elutionsmittel, jedoch hat diese Methode viele Nachteil, da man spezielle Zusätze benötigt, die sehr teuer sind und außerdem nicht für jeden Stoff existieren. Aus diesem Grund verwendet man in dieser Monographie eine chirale stationäre Phase 12 bestehend aus Kieselgel-Cellulosederivaten mit einer Länge von 0,25 m und einem Innendurchmesser von 2,0 mm. Die Trennung erfolgt bei 50 °C. Die mobile Phase besteht aus wasserfreiem Ethanol R und Heptan R (30:70 V/V). Die Detektion erfolgt mittels UV-Detektor bei 250 nm.
Bevor die eigentliche Trennung mit der Untersuchungslösung erfolgt, muss eine Systemeignung durchgeführt werden. Hierbei wird eine Referenzlösung A wie folgt hergestellt: 1 mg Rivaroxaban-Verunreinigung A CRS (R-Enantiomer) wird in 5 ml Acetonitril R gelöst. Diese Lösung wird mit wasserfreiem Ethanol R zu 10 ml verdünnt. Nun wird eine zweite Referenzlösung (Referenzlösung B) hergestellt. Für diese wird 20 mg Substanz in 25 ml Acetonitril R gelöst. Diese wird mit wasserfreiem Ethanol R zu 50 ml aufgefüllt. In diese Lösung wird 1 ml der Referenzlösung A hinzugegeben. Diese Lösung wird nun in die Säule gegeben. Bei einer Durchflussrate von 0,2 ml/min sollte es zwischen der Probe und Verunreinigung zu einer Auflösung von mindestens 1,5 kommen.
Erst jetzt erfolgt die eigentliche Trennung der Untersuchungslösung. Hier werden 20 mg Substanz in 25 ml Acetonitril R gelöst, in wasserfreien Ethanol R zu 50 ml verdünnt und anschließend vermessen. 13
Auswertung/ Interpretation/ Bedeutung und Eignung
Im UV-Spektrum sollten bei einer Verunreinigung zwei Peaks zu sehen sein, von denen der größte Peak unserem Arzneistoff entspricht und der andere Peak dem R-Enantiomer. Anhand beider Peakflächen kann nun das Verhältnis der Enantiomerenverunreinigung zum Arzneistoff Rivaroxaban berechnet werden. Dabei wird der Quotient aus der Peakfläche der Verunreinigung und der Summe der beiden Peakflächen gebildet. Nach Ph.Eur. darf der Grenzwert von 0,5 % nicht überschritten werden. 14 Diese Methode zur Enantiomerentrennung mittels HPLC ist für Rivaroxaban besonders geeignet, da aufgrund der unterschiedlichen Affinitäten zu der chiralen stationären Phase es so zu einer guten Trennung kommt, welche durch eine vorherige Systemeignung gewährleistet wird. Eine mögliche Fehlerquellen kann sein, dass das Elutionsmittel bereits verunreinigt ist und es so zur zufälligen Peaküberlappung kommen kann und man die eigentliche Verunreinigung nicht mehr identifizieren kann. Hinzu kommen allgemeine Fehlerquellen bei der HPLC: z.B. falsche Elutionsmittelzusammmensetzung, verunreinigte Säule, falsche Fließmittelgeschwindigkeit und Temperaturschwankungen. 15
Übungsaufgaben
Multiple Choice (MC) Frage: Prüfung auf Reinheit von Rivaroxaban mit der Hochleistungsflüssigkeitschromatographie
Welche Aussagen treffen nicht zu?
I) Eine Reversed Phase Säule reicht für die Trennung von Enantiomeren aus.
II) Chirale Komponenten in der stationären Phase sind notwendig, um eine Trennung zu erzielen.
III) Chirale Komponenten in der mobilen Phase zerstören die Säule.
IV) Enantiomere sind Spiegelbilder, die nicht zur Deckung gebracht werden können.
V) Chirale Komponenten in der mobilen Phase sind besser als chirale Komponenten in der
stationären Phase.
A. nur I ist falsch
B. nur III ist falsch
C. I, II, III sind falsch
D. I, III, V sind falsch
E. I, III,IV, V sind falsch
Antwort D trifft zu: Die Reversed Phase reicht nicht für die Trennung von Enantiomeren; chirale Komponenten zerstören die Säule nicht; chirale Komponenten in der stationären Phase sind besser als chirale Komponenten in der mobilen Phase. All diese Informationen lassen sich aus unserem Artikel entnehmen.
Textaufgabe: Prüfung auf Reinheit von Rivaroxaban mit der Hochleistungsflüssigkeitschromatographie
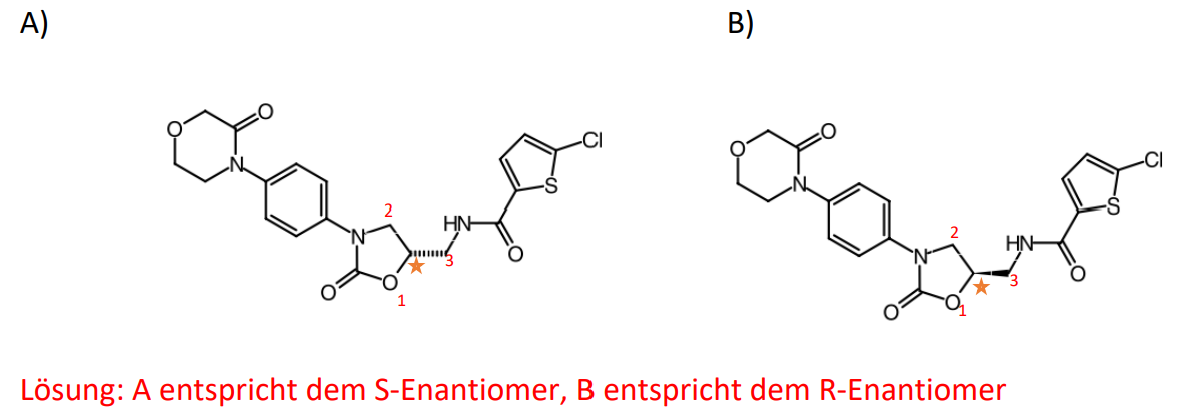
- Im Folgenden ist das Racemat des Rivaroxabans zu sehen.
Ordnen Sie zu: Welches ist das R-Enantiomer und welches das S-Enantiomer?
- Rivaroxaban soll nach obiger Monographie auf Reinheit geprüft werden. Für die Systemeignung ergaben sich folgende Messwerte: t Totzeit = 4 min, tRetentionszeit 1 = 14 min, t Retentionszeit 2 = 17 min, w1;0,5 = 0,75 min, w2; 0,5 = 1,45 min.
Entscheiden Sie, ob eine ausreichende Trennung im nächsten Schritt gewährleistet werden kann?

- Nach Ph.Eur. darf der Grenzwert von 0,5 % für das Verhältnis der Enantiomerenverunreinigung für den Arzneistoff Rivaroxaban nicht überschritten werden. Nach erfolgreicher Trennung sind folgende Werte zu entnehmen: Area 1= 51072 und Area 2 = 9846122. Überprüfen Sie, ob der Arzneistoff den Anforderungen des Ph.Eur. entspricht?

- Skizzieren Sie den Geräteaufbau von der HPLC-Anlage!
Einzelnachweise
Folgende Quellen wurden verwendet.
1 Kommentar zu Ph.Eur.10.3/2932, 69. Aktualisierungslieferung ⇑
2 Ph.Eur. 10.3/2932, S. 7389, 10. Ausgabe Grundwerk 2022 ⇑
3 https://de.wikipedia.org/wiki/Rivaroxaban, entnommen am: 29.11.2022, 17:29 ⇑
4 Ph.Eur. 10.3/2932, S. 7389 10. Ausgabe Grundwerk 2022 ⇑
5 https://flexikon.doccheck.com/de/Rivaroxaban, entnommen am: 29.11.2022, 17:32 ⇑
6 Kommentar zu Ph.Eur. 10.3/2932, 69. Aktualisierungslieferung ⇑
7 Ph.Eur. 10.3/2932, S. 7389 und 7390, 10. Ausgabe Grundwerk 2022 ⇑
8 Seminarskript von Sebastian Bendas: High Performance Liquid Chromatography (HPLC) Hochleistungs-Flüssigchromatographie Einführung und Grundlagen, S. 51 ⇑
9 Vorlesungskript von Prof. Dr. rer. nat. Hermann Wätzig: High Performance Liquid Chromatography S. 33; Seminarskript von Sebastian Bendas: High Performance Liquid Chromatography (HPLC) Hochleistungs-Flüssigchromatographie Einführung und Grundlagen, S. 45 (HPLC) ⇑
10 Eigene Aufnahme; Urheber: Nouralhuda Bitar, entstanden am 18.11.2022 ⇑
11 Seminar Stereochemie, Prof. Dr. rer. nat. Conrad Kunick, SoSe 2022; Kapitel 4, S.6 ⇑
12 https://blog.sepscience.com/liquidchromatography/enantiomer-separations, entnommen am 20.11.2022, 17:59 ⇑
13 Ph.Eur. 10.3/2932, S. 7390, 10. Ausgabe Grundwerk 2022 ⇑
14 Ph.Eur. 10.3/2932, S. 7390, 10. Ausgabe Grundwerk 2022 ⇑
15 Seminarskript von Sebastian Bendas: High Performance Liquid Chromatography (HPLC) Hochleistungs-Flüssigchromatographie Einführung und Grundlagen, S. 36 ⇑
16 Ph.Eur. 10.3/2932, S.7390, 10. Ausgabe Grundwerk 2022 ⇑
17 Seminarskript von Sebastian Bendas: High Performance Liquid Chromatography (HPLC) Hochleistungs-Flüssigchromatographie Einführung und Grundlagen, S.26 ⇑