UV-VIS-Spektroskopie
Titelblatt
Bericht der Expertengruppe für
UV/VIS-Spektroskopie
SoSe 2021
Abgabedatum
21.06.2021
Über-/Expertengruppe 16
Rebecca Bergsträsser
Silvia Sikora
Jana Hemme
Svenja Kerls
Onejda Ndreu
Parisa Ganji
UV/VIS-Spektroskopie
Inhaltsverzeichnis
Einleitung
Die UV/Vis-Spektroskopie stellt eine optische Methode in der instrumentellen Analytik dar. Wie der Name andeutet, wird im UV- (ultravioletten) oder Vis- (sichtbaren) Bereich des Lichts gearbeitet. Die Analyse wird erst durch das Messen der Absorptionen und der daraus resultierenden Spektren möglich, welche durch Detektoren und EDV erstellt werden. Anwendung findet die UV/Vis-Spektroskopie besonders in der quantitativen Analytik, wobei sie auch mit der HPLC gekoppelt werden kann. Des Weiteren wird sie zum Teil in der qualitativen Analyse eingesetzt und eignet sich somit zur Bestimmung physikalischer und chemischer Eigenschaften. 1
Grundlagen
Die UV/Vis-Spektroskopie nutzt die Eigenschaft von Molekülen, Licht bei spezifischen Wellenlängen absorbieren zu können. Licht wird hierbei als elektromagnetische Strahlung verstanden. Dabei liegen die Wellenlängen des ultravioletten (UV) Lichts zwischen 180 bis 400nm und die des sichtbaren (Vis) Lichts zwischen 400 bis 800nm. 2
Elektromagnetische Strahlung
Elektromagnetische Strahlung wird durch den Welle-Teilchen-Dualismus beschrieben. Dieser besagt, dass sie sowohl Wellen- als auch Teilchencharakter besitzt. Zudem wird Strahlung als Strom diskreter energetischer Teilchen definiert, welche Photonen oder Quanten genannt werden. Dabei beträgt die Energie (E) eines Photons:⚠ $$ E = h ⋅ \nu = h ⋅\frac{ c }{ \lambda } ⚠ $$
h (Planck´sches Wirkungsquantum) = 6,626⋅10-34Js
c (Lichtgeschwindigkeit im Vakuum) = 300.000km⋅s-1
Daraus folgt, dass sich die Energie elektromagnetischer Strahlung proportional zur Frequenz (v in 1⋅s-1) und umgekehrt proportional zur Wellenlänge (λ in nm) verhält. 3
Absorption und Elektronenanregung
Absorption (A) bezeichnet die Aufnahme von Energie aus dem Licht und entspricht definitionsgemäß: 4 5
⚠ $$ A = log_{ 10 } \frac{ 1 }{ T } = log_{ 10 } \frac{ I_{ 0 } }{ I } \\\ T = \frac{ I }{ I_{ 0 } } ⚠ $$
T = Transmission
I0 = Intensität einfallender Strahl
I = Intensität der Strahlung nach Durchgang der Probe
Entsprechend gilt, wenn die Absorption Null beträgt, wird das gesamte Licht transmittiert. Geht die Absorption gegen unendlich, bedeutet dies im Umkehrschluss, dass die Probe das gesamte Licht aufnimmt. Durch die Absorption (A) von Licht kommt es zu einem zeitweiligen Übergang eines Elektrons aus dem Grundzustand (S0) auf ein erhöhtes Energieniveau (S1,2 usw.). Das Elektron befindet sich dann in einem angeregten Zustand. Die Aufnahme der Energie wird dabei durch das Lambert-Beer´sche Gesetz beschrieben. Es gilt nur für monochromatisches Licht und verdünnte, klare Lösungen, da nur in diesem Bereich ein linearer Zusammenhang zwischen Konzentration und Absorption besteht. Mit diesem Gesetz lassen sich zudem Stoffe qualifizieren und quantifizieren: 6 ⚠ $$ A = \epsilon ⋅ c ⋅ b ⚠ $$
ε = molarer Absorptionskoeffizient (L ⋅ mol-1 ⋅ cm-1)
c = Konzentration des Analyten in der Probe (mol/L)
b = Schichtdicke (cm)
Anstelle des molaren Absorptionskoeffizienten kann auch der spezifische Absorptionskoeffizient eingesetzt werden. Dieser besitzt den Vorteil, dass er tabelliert ist. Die Absorption berechnet sich dann folgendermaßen: 7⚠ $$ A = A_{ spez } ⋅ c_{ m } ⋅ b ⚠ $$
Aspez = spezifischer Absorptionskoeffizient (100mL ⋅ g-1 ⋅ cm-1)
cm = Massenkonzentration der Substanz (g/100mL)
Grundsätzlich können σ-Elektronen (Elektronen der Einfachbindungen), π-Elektronen (Elektronen der Doppel- und Dreifach-Bindungen) und n-Elektronen (nicht-bindende Elektronen) durch Anregung mit Licht auf nicht-besetzte (anti-bindende) Molekülorbitale (π*- und σ *-Orbital) angehoben werden, welche ein höheres Energieniveau aufweisen. Die Anregung von σ-Elektronen benötigt mehr Energie, weshalb sie nur selten beobachtet werden kann. Die Verweildauer im angeregten Zustand beträgt bei allen Übergängen zwischen 10-7 und 10-9 s. Die Übergänge finden ausschließlich zwischen dem HOMO (highest occupied molecular orbital) und dem LUMO (lowest unoccupied molecular orbital) statt. Damit ein Übergang zwischen zwei Energieniveaus möglich wird, ist genau die Energiedifferenz zwischen dem Grundzustand und dem angeregten Zustand notwendig. Daraus folgt, dass nur Strahlung bestimmter Wellenlänge und Frequenz absorbiert werden kann. 8
Des Weiteren trägt die Überlappung von π- und n-Elektronen mit anderen π- oder n-Elektronensystemen zur Senkung der Energie bei, die für die Anregung nötig ist. Das bedeutet, je größer das chromophore System, desto geringer die Energiedifferenz und somit steigt die Übergangswahrscheinlichkeit. 9 10
Verbotene Elektronenübergänge
Diese Übergänge sind praktisch sehr unwahrscheinlich und selten, treten sie doch auf, ist die Intensität der Absorption sehr gering. Zu ihnen gehören das Spin-Verbot, welches bei einer Anregung den Übergang zwischen Singulett- und Triplett-Zuständen nicht erlaubt. Triplett-Zustände sind energieärmer, da die Atome dort einen parallelen Spin besitzen, im Gegensatz zum antiparallelen Spin in Singulett-Zuständen. Das Überlappungsverbot (Raumverbot) verbietet den Elektronenübergang zwischen zwei Orbitalen, bei der die Überlappung nicht oder nicht ausreichend vorhanden ist. Ebenfalls wird ein Übergang zwischen Elektronenzuständen gleicher Symmetrie nicht gestattet (Symmetrieverbot). 11
Absorptionsspektren
Absorptionsspektren stellen Absorptionen graphisch dar. Dabei wird die Intensität der absorbierten Strahlung in Abhängigkeit der Wellenlänge abgebildet. Es gibt Linien- und Bandenspektren, wobei in der UV/Vis-Spektroskopie nur Banden erhalten werden. Linienspektren kennzeichnen sich durch definierte scharfe Maxima und werden durch Atome diskreter Energieniveaus erzeugt. Bandenspektren werden durch Moleküle hervorgerufen, bei denen aufgrund der sehr nah beieinanderliegenden Rotations- und Schwingungszustände im Molekül, die Absorptionsmaxima als Bande dargestellt werden. Die einzelnen Spektrallinien können nicht mehr aufgelöst werden. Die jeweiligen Banden sind charakteristisch für bestimmte funktionelle Gruppen und Bindungen im Molekül. Sie unterscheiden sich durch ihre Lage (λmax), Höhe (εmax) und Form. 12 13
Verschiebung von Spektren
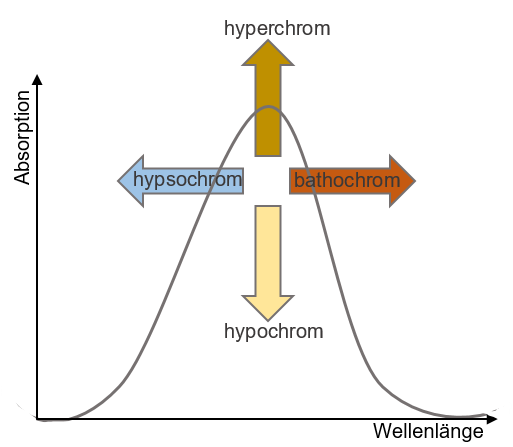
Die Absorptionsmaxima können durch verschiedene Faktoren verschoben werden. Zu einer bathochromen Verschiebung (Verschiebung in den langwelligeren Bereich = „Rotverschiebung“) kommt es durch Bindung von auxochromen Gruppen. Auxochrome Gruppen können auch einen gegenteiligen Effekt haben, in diesem Fall wird von einer hypsochromen Verschiebung (Verschiebung in den kurzwelligeren Bereich = „Blauverschiebung“) gesprochen. Bei einer Erhöhung der Intensität der Absorption spricht man von einer hyperchromen Verschiebung, während es bei einer Intensitätserniedrigung zu einer hypochromen Verschiebung kommt (siehe Abbildung 1). Auch der pH-Wert und das Lösungsmittel können zu Verschiebungen führen und müssen daher angegeben werden. 15 16
Chromophores System und auxochrome Gruppen
Ein chromophores System oder Chromophor ist der Teil eines Moleküls, der anregbare π- und n-Elektronen enthält und somit UV- bzw. Vis-Licht absorbieren kann. Dieser Teil ist auch für die Farbe des Moleküls verantwortlich, da alle nicht absorbierten Wellenlängen einen neuen Farbeindruck vermitteln. Ein Chromophor besteht aus mindestens zwei konjugierten Doppelbindungen. Die zur Anregung benötigte Energie verringert sich mit zunehmender Anzahl der konjugierten Doppelbindungen, da eine vermehrte π-Elektronen-Delokalisierung Elektronenübergänge auf höhere
Energieniveaus begünstigt. Beispiele für Chromophore sind aromatische Systeme und ungesättigte nicht-aromatische Teilstrukturen.
Besitzt das Molekül zudem funktionelle Gruppen, können diese zu einer Verschiebung der Absorptionsmaxima führen. Dazu befähigte Gruppen werden dann auxochrom genannt. Auxochrome Gruppen, die freie Elektronenpaare besitzen (-OH, -NH2,-OR und -NR2), verschieben das Licht in den langwelligeren Bereich. Der Grund dafür sind die +M- und +I-Effekte dieser Gruppen, da es durch diese zu einer Vergrößerung des delokalisierten π-Elektronensystems kommt. Demzufolge sinkt entsprechend die benötigte Anregungsenergie. Im Gegensatz dazu werden Maxima in den kurzwelligen Bereich verschoben, wenn Substituenten die Elektronen(-dichte) durch -M- und -I-Effekte aus dem chromophoren System herausziehen. Beispiele für solche auxochromen Gruppen sind -NO2 und -CHO. 17 18
Instrumenteller Aufbau
Im Folgenden werden die verschiedenen Bestandteile des Spektrometers, welches oft in der UV-Vis-Spektroskopie verwendet wird, näher erläutert.
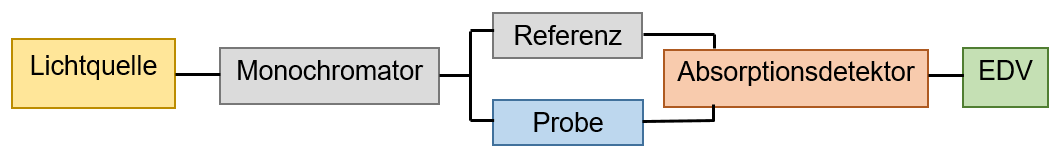
Dabei unterscheidet man zwischen dem Einstrahl- und dem Zweistrahlspektrometer (siehe Abbildung 2). Bei dem Einstrahlspektrometer muss zuerst mit einer lösungsmittelgefüllten Vergleichsküvette der Nullwert bestimmt werden, bevor die Probe vermessen wird. Die Bestimmung des Nullwerts ist wichtig, da das Lösungsmittel eine Eigenabsorption aufweisen kann. Der eingesetzte Spektralfilter muss Licht der Komplementärfarbe, der zur untersuchenden Lösung, durchlassen. 19
Eine Alternative stellt das Zweistrahlspektrometer dar. Dieses ermittelt den Nullwert, im Gegensatz zum Einstrahlspektrometer, automatisch durch eine gleichzeitige Vermessung der Probe und Referenz im Spektrometer. Es gibt zwei verschiedene Funktionsweisen bei Zweistrahlspektrometern. Entweder werden die Vergleichslösung und die Probelösung abwechselnd bestrahlt und vermessen oder der Lichtstrahl wird, beispielsweise durch eine rotierende Scheibe, geteilt. Infolgedessen ergeben sich zwei Teilstrahlen, der Probenstahl und der Vergleichsstrahl, welche die Probe und die Vergleichslösung gleichzeitig durchdringen. Für diese Methode werden Küvetten benötigt, die gleiches Absorptionsverhalten aufweisen, sodass keine Messfehler entstehen. 21
Lichtquelle
Der erste Bestandteil des UV-Vis-Spektrometers ist, wie in Abbildung 2 zu sehen, die Lichtquelle, welche den Monochromator kontinuierlich bestrahlt. Die Strahlungsintensitäten unterscheiden sich über den entsprechenden Spektralbereich nur in geringem Maße. Es können, je nach der geforderten Wellenlänge, verschiedene Lampen genutzt werden. Für den Ultraviolett-Bereich sollte die Deuterium-Lampe genutzt werden (160 bis 380nm), die Wolfram-Lampe kann im sichtbaren Bereich eingesetzt werden (300 bis 2400nm) und die Xenonlampe ist für den gesamten UV-Vis-Bereich kompatibel (190 bis 1000nm), jedoch weist sie ein niedrigeres Signal-Rausch-Verhältnis auf. 22 23
Monochromator
Der Monochromator ist das zweite Bauteil und hat die Funktion, eine Wellenlänge aus dem einfallenden, polychromatischen Licht zu isolieren, sodass monochromatisches Licht entsteht. Dieses Element des UV-Spektrometers besteht aus einem Eintrittsspalt, einem Dispersionselement sowie einem Austrittsspalt. Der Eintrittsspalt braucht eine genügend große Spaltbreite, damit ausreichend Strahlung durchtreten und später auf die Probe treffen kann. Das Dispersionselement kann entweder ein Prisma oder ein Gitternetz sein. Der Austrittsspalt sollte ebenfalls eine gewisse Spaltbreite aufweisen, sodass auch bei einem sehr kleinem Wellenlängenbereich eine ausreichend große Menge an Strahlung auf die Probe oder Referenz treffen kann. 24
Prisma
Fällt polychromatisches Licht durch ein Prisma, wird es in seine Komponenten zerlegt, indem es je nach Wellenlänge unterschiedlich stark gebrochen (abgelenkt) wird. Die verschiedenen Wellenlängen können durch Drehen des Prismas oder Linsen und Hohlspiegel in den Austrittsspalt dirigiert werden. 25
Gitter
In definierten Abständen eingeritzte Flächen (aus Glas oder Metall) bilden ein Reflexionsgitter, welches Licht in seine einzelnen Wellenlängen aufspaltet. Dies geschieht durch Beugung des Lichtes. Gittermonochromatoren werden heutzutage gegenüber Prismen bevorzugt, da ein linearer Zusammenhang zwischen Drehwinkel und eingeblendeten Wellenlängenabschnitten besteht. 26
Probenbehältnis
Als Probengefäße eignen sich Glasfasersonden, Immerstransmissionszellen und Küvetten. Anhand der zu analysierenden Probe wird das Probengefäß ausgewählt. Generell müssen Küvetten eine geringe Eigenabsorption aufweisen. Solche aus hochreinem Quarzglas werden im UV-Bereich eingesetzt und im Vis-Bereich finden Küvetten aus optischem Glas Anwendung. Die Schichtdicke darf bei beiden Materialien maximal um +/- 0,5% von der Standardküvettendicke (1cm) abweichen. Bestehen Küvetten aus Kunststoffen (unterschiedliche Zusammensetzung möglich), können diese nur einmal verwendet werden. Der Messfehler ist hier in der Regel größer, daher erfolgt die Verwendung nur in Ausnahmefällen und ausschließlich nach vorheriger Prüfung.
Ein sorgfältiger Umgang mit den Küvetten ist sehr wichtig, da Kratzer in der Küvettenwand zu unerwünschtem Streulicht führen, welches eine ungleiche Absorption zur Folge hat (Messfehler). Des Weiteren sind Messfehler durch das Vorspülen der Küvette mit der Untersuchungslösung zu minimieren und nach der Messung sollten die Küvetten nur mit Wasser gesäubert werden. 27 28
Detektionselement
Das Detektionselement wandelt die Strahlungsenergie in ein elektrisches Signal um und wird meistens in Form von Photomultipliern und Diodenarray-Detektoren eingesetzt. 29 Der Photomultiplier ist ein Sekundärelektronenvervielfacher. Dabei lösen die Photonen beim Auftreffen auf die Photokathode Elektronen heraus, welche durch ein elektrisches Feld beschleunigt werden und so nacheinander auf Dynoden treffen. An den Dynoden werden weitere Elektronen herausgeschlagen, somit nimmt die Anzahl der Elektronen von Dynode zu Dynode zu. Am Ende treffen sie auf die Anode, bei der sie zur Masse über einen Widerstand abfließen und somit einen Spannungsabfall bewirken, welcher als Messsignal verstanden wird. 30
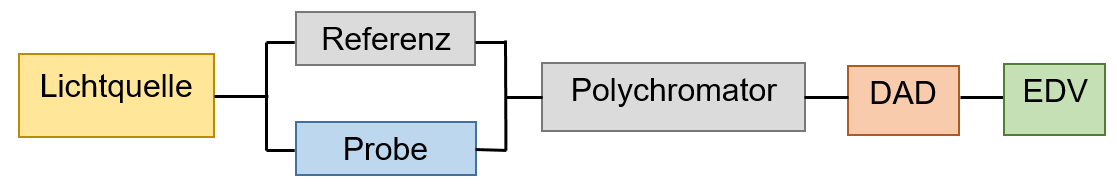
Bei dem Diodenarray-Detektor (DAD) entfällt der Monochromator zwischen Lichtquelle und Probe/Referenz, somit wird die Probe/Referenz mit allen Wellenlängen der Lampe gleichzeitig bestrahlt. Stattdessen befindet sich hinter der Probe /Referenz ein Reflexionsgitter (Polychromator) (siehe Abbildung 3), welches die nicht-absorbierten Wellenlängen auftrennt und auf verschiedene Photodioden lenkt, wobei jede einen bestimmten engen Wellenlängenbereich detektiert. 32 Die meisten Diodenarray-Detektoren besitzen 1024 Photodioden, welche durch Anlegen einer entgegengesetzten Spannung an einer Halbleiterschicht (z.B. Silicium) eine Verarmungsschicht erzeugen. Diese weist keine Ladung auf und leitet auch keinen Strom. Erst wenn Strahlung auf die Schicht fällt, bilden sich freie bewegliche Elektronen und positiv geladene Teilchen, sodass ein Strom fließt, der proportional zur Intensität der Strahlung und der Transmission ist. 33 34
Datenverarbeitungs-& Evaluierungssystem (EDV)
Das System wandelt die elektrischen Signale in auswertbare Spektren und Werte um. 35
Einzelnachweise
1 Kommentar zu Ph. Eur. 10.0/ 2.02.25.00 1 ⇑
2 Ph. Eur. 10.0/ 2.02.25.00 3 ⇑
3 Kommentar zu Ph. Eur. 10.0/ 2.02.25.00 1 ⇑
4 Kommentar zu Ph. Eur. 10.0/ 2.02.25.00 1 ⇑
5 Rücker, G., Neugebauer, M.& Willems, G. G. (2013): Instrumentelle Pharmazeutische Analytik. Stuttgart, Germany: Wissenschaftliche Verlagsgesellschaft Stuttgart. Seite: 101 2 ⇑
6 Kommentar zu Ph. Eur. 10.0/ 2.02.25.00 1 ⇑
7 Kommentar zu Ph. Eur. 10.0/ 2.02.25.00 1 ⇑
8 Rücker, G., Neugebauer, M.& Willems, G. G. (2013): Instrumentelle Pharmazeutische Analytik. Stuttgart, Germany: Wissenschaftliche Verlagsgesellschaft Stuttgart. Seiten: 97, 98, 108 2 ⇑
9 Kommentar zu Ph. Eur. 10.0/ 2.02.25.00 1 ⇑
10 Ehlers, E. (2016): Analytik II. Stuttgart, Germany: Deutscher Apotheker Verlag. Seiten: 382 - 383 5 ⇑
11 Rücker, G., Neugebauer, M.& Willems, G. G. (2013): Instrumentelle Pharmazeutische Analytik. Stuttgart, Germany: Wissenschaftliche Verlagsgesellschaft Stuttgart. Seite: 110 2 ⇑
12 Rücker, G., Neugebauer, M.& Willems, G. G. (2013): Instrumentelle Pharmazeutische Analytik. Stuttgart, Germany: Wissenschaftliche Verlagsgesellschaft Stuttgart. Seiten: 110-111 2 ⇑
13 Ehlers, E. (2016): Analytik II. Stuttgart, Germany: Deutscher Apotheker Verlag. Seite: 386 5 ⇑
14 eigene Grafik; Urheber: J. Hemme ⇑
15 Kommentar zu Ph. Eur. 10.0/ 2.02.25.00 1 ⇑
16 Ehlers, E. (2016): Analytik II. Stuttgart, Germany: Deutscher Apotheker Verlag. Seite: 387 5 ⇑
17 Rücker, G., Neugebauer, M.& Willems, G. G. (2013): Instrumentelle Pharmazeutische Analytik. Stuttgart, Germany: Wissenschaftliche Verlagsgesellschaft Stuttgart. Seite: 108 2 ⇑
18 Instrumentelle Analytik (Skript): Optische Methoden: UV/VIS-Spektroskopie, Kellner, T., 2021, Folien: 25-27 6 ⇑
19 Kommentar zu Ph. Eur. 10.0/ 2.02.25.00 1 ⇑
20 eigene Grafik; Urheber: J. Hemme ⇑
21 Kommentar zu Ph. Eur. 10.0/ 2.02.25.00 1 ⇑
22 Ph. Eur. 10.0/ 2.02.25.00 3 ⇑
23 Kommentar zu Ph. Eur. 10.0/ 2.02.25.00 1 ⇑
24 Ph. Eur. 10.0/ 2.02.25.00 3 ⇑
25 Rücker, G., Neugebauer, M.& Willems, G. G. (2013): Instrumentelle Pharmazeutische Analytik. Stuttgart, Germany: Wissenschaftliche Verlagsgesellschaft Stuttgart. Seite: 106 2 ⇑
26 Rücker, G., Neugebauer, M.& Willems, G. G. (2013): Instrumentelle Pharmazeutische Analytik. Stuttgart, Germany: Wissenschaftliche Verlagsgesellschaft Stuttgart. Seite: 106 2 ⇑
27 Kommentar zu Ph. Eur. 10.0/ 2.02.25.00 1 ⇑
28 Rücker, G., Neugebauer, M.& Willems, G. G. (2013): Instrumentelle Pharmazeutische Analytik. Stuttgart, Germany: Wissenschaftliche Verlagsgesellschaft Stuttgart. Seite: 131 2 ⇑
29 Kommentar zu Ph. Eur. 10.0/ 2.02.25.00 1 ⇑
30 Instrumentelle Analytik (Skript): Optische Methoden: UV/VIS-Spektroskopie, Kellner, T., 2021, Folie: 11 4 ⇑
31 eigene Grafik; Urheber: J.Hemme ⇑
32 Rücker, G., Neugebauer, M.& Willems, G. G. (2013): Instrumentelle Pharmazeutische Analytik. Stuttgart, Germany: Wissenschaftliche Verlagsgesellschaft Stuttgart. Seite: 128 2 ⇑
33 Kommentar zu Ph. Eur. 10.0/ 2.02.25.00 1 ⇑
34 Rücker, G., Neugebauer, M.& Willems, G. G. (2013): Instrumentelle Pharmazeutische Analytik. Stuttgart, Germany: Wissenschaftliche Verlagsgesellschaft Stuttgart. Seite: 129 2 ⇑
35 Kommentar zu Ph. Eur. 10.0/ 2.02.25.00 1 ⇑
Monographiebeispiel: Betacarotin, Prüfung auf Identität
Stoffcharakterisierung
Eigenschaften
Betacarotin (auch β-Carotin, all-trans-β-Carotin, CL 40800, C-Orange 11 oder E160a) ist ein braunrotes bis bräunlich rotes, kristallines Pulver, welches die Strukturformel C40H56 besitzt. 1
Das Betacarotin gehört zu den 11- oder 12-fach ungesättigten Tetraterpenen und wird daher zu den Carotinoiden gezählt. Es besitzt eine relative Molekülmasse von 536,9 und der Gehalt der getrockneten Substanz schwankt zwischen 95,0 bis 102,0 %. Die Substanz ist praktisch unlöslich in Wasser und wasserfreiem Ethanol, löst sich aber in Tetrahydrofuran. Wenn sie in Benzol oder in Methanol gelöst vorliegt, bilden sich tiefrote, hexagonale Prismen und in Petrolether gelöst entstehen rhombische Plättchen. Im Bereich zwischen 176 und 182 °C schmilzt das Betacarotin unter Zersetzung. Liegt es in Lösung vor, ist es besonders empfindlich gegenüber Licht, Hitze und Luftsauerstoff. 2 3
Wirkung
Betacarotin fungiert als Radikalfänger, insbesondere als Antioxidans, indem es Singulett-Sauerstoff inaktiviert. Ob die Einnahme von Betacarotin das Risko von Erkrankungen, wie Tumoren oder degenerativen Krankheiten, senkt ist nicht bewiesen. Allerdings verhilft es zu einer photoprotektiven Wirkung durch die Einlagerung des Betacarotins in das Unterhautfettgewebe und das Stratum corneum. Des Weiteren trägt das Betacarotin zur Bildung des Vitamins A bei und stellt dessen Provitamin dar. Vitamin A wird für das Wachstum des Körpers, die Differenzierung der Epithelzellen, Sehfunktion, Reproduktion und die damit einhergehende vollständige embryonale Entwicklung benötigt. Eine Überdosierung von Betacarotin ist nicht möglich. 4
Anwendung
Um einem Mangel an Vitamin A vorzubeugen, wird das Betacarotin unter anderem als Nahrungsergänzungsmittel eingesetzt. Außerdem kann es bei erythropoetischer Protoporphyrie, polymorphen Lichtdermatosen oder Pigmentstörungen verwendet werden. Darüber hinaus dient es als Farbstoff in der Industrie. 5 6
Durchführung der Monographie
Die Prüfung auf Identität, welche vom Ph. Eur. vorgeschrieben wird, sollte so schnell wie möglich ausgeführt werden und die dabei verwendeten Lösungen sind vorher frisch herzustellen. Für die zu untersuchende Lösung müssen 50mg der Probensubstanz in Tetrahydrofuran R gelöst werden, sodass sich insgesamt 100mL ergeben. Nun werden 10mL dieser Lösung mit Tetrahydrofuran R zu 50mL verdünnt, sodass im Anschluss 3mL dieser entstandenen Lösung mit Cyclohexan R zu 100mL verdünnt werden können. 7 8
Mit der hergestellten Probelösung kann die UV-Vis-Spektroskopie durchgeführt werden. Dafür wird die zuvor hergestellte, zu untersuchende Lösung bei 455 und 483nm vermessen und mithilfe der dabei resultierenden Absorptionswerte wird deren Verhältnis berechnet. Das Verhältnis der Absorptionen bei 455nm und 483nm sollte dabei im Bereich zwischen 1,14 und 1,18 liegen. Das Absorptionsmaximum liegt bei 455nm.9
Es sollte immer darauf geachtet werden, dass sorgfältig und sauber gearbeitet wird, sodass es nicht zu Verunreinigungen und damit verbundenen Fehlern kommt.
Auswertung der analytischen Methode
Die UV/Vis-Spektroskopie eignet sich gut für die Prüfung auf Identität von Betacarotin, da durch die elf konjugierten Doppelbindungen (Chromophor) ein, für Betacarotin, charakteristisches Absorptionsspektrum entsteht. Befindet sich das Verhältnis der Absorptionen in dem oben angegebenen Wertebereich und liegt das Absorptionsmaximum bei der vorgegebenen Wellenlänge von 455nm, kann die Identität von Betacarotin bestätigt werden. 10 Ein bedeutender Vorteil der UV/Vis-Spektroskopie zu anderen Verfahren ist die geringe Probenvorbereitung und die schnelle Durchführung. 11
Einzelnachweise
1 Ph. Eur. 10.0/1069 Betacarotin 1 ⇑
2 Ph. Eur. 10.0/1069 Betacarotin 1 ⇑
3 Kommentar zu Ph. Eur. 10.0/1069 Betacarotin 2 ⇑
4 Kommentar zu Ph. Eur. 10.0/1069 Betacarotin 2 ⇑
5 Kommentar zu Ph. Eur. 10.0/1069 Betacarotin 2 ⇑
6 https://www.pharmawiki.ch/wiki/index.php?wiki=Betacarotin, letzter Zugriff: 23.05.2021 3 ⇑
7 Ph. Eur. 10.0/1069 Betacarotin 1 ⇑
8 Kommentar zu Ph. Eur. 10.0/1069 Betacarotin 2 ⇑
9 Ph. Eur. 10.0/1069 Betacarotin 1 ⇑
10 Kommentar zu Ph. Eur. 10.0/1069 Betacarotin 2 ⇑
11 Instrumentelle Analytik (Skript): Optische Methoden: UV/VIS-Spektroskopie, Kellner, T., 2021, Folie: 24 4 ⇑
TU-Braunschweig Institut für Medizinische und Pharmazeutische Chemie Seminar: Instrumentelle Analytik Kontakt: tubs@t-kellner.de