Dünnschichtchromatographie
Titelblatt
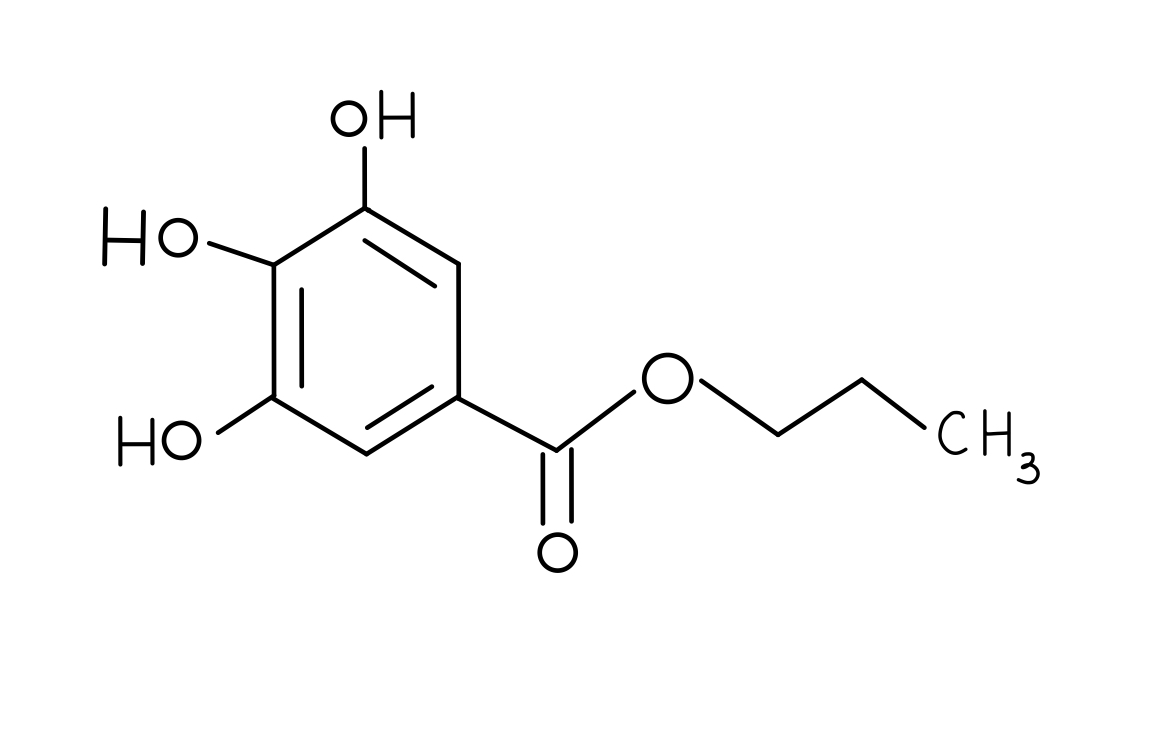
Propylgallat
Dünnschichtchromatographie
WiSe 2022/2023
Abgabedatum
30.11.2022
Expertengruppe 15
Lynn Ghannam
Ranim Alkanj Abseh
Yousef Bahbooh
Dominik Buchholz
Anwendungsbeispiel der Dünnschichtchromatographie aus dem Europäischen Arzneibuch. Monographiebeispiel: Propylgallat (Ph. Eur. 10.0/1039)
Prüfung auf Identität von Propylgallat mit der Dünnschichtchromatographie
Inhaltsverzeichnis
Stoffcharakterisierung
Propylgallat ist eine chemische Verbindung aus der Gruppe der Gallate und Ester der Gallensäure. Propylgallat ist ein weißes bis cremefarbiges, geruchloses oder fast geruchloses, schwach hygroskopisches und kristallines Pulver von leicht bitterem Geschmack. 2
Die physikalischen und chemischen Eigenschaften
Propylgallat ist schwer löslich in Wasser, aber löslich in Ethanol und Öl. Die Substanz löst sich in verdünnten Alkalihydroxidlösungen. Die Dichte beträgt 1,21 g*cm-3. Der Schmelzpunkt liegt bei 148 bis 151 Grad Celsius. 3
Propylgallat-Wirkung
Anwendung findet Propylgallat in Pestiziden, Lebensmittelindustrie sowie Kosmetika als Antioxidationsmittel. 4 Bei Oxidationsreaktionen entstehen freie Radikale, die aggressiv sind und oft Zellschäden verursachen.5
In Abwesenheit von Antioxidationsmitteln kann das Fett in Lebensmitteln schnell ranzig werden. Zudem fördert der Sauerstoff in der Luft den schnellen Verderb von Lebensmitteln. Durch die antioxidative Wirkung von Propylgallat wird diesem Prozess entgegengewirkt, indem Propylgallat die freien Radikale abfangen.
Außerdem ist Propylgallat nicht sehr hitzeempfindlich, daher besonders für Frittierfette und Aromastoffe geeignet.
6 7
Darüber hinaus wird es in der Fluoreszenzmikroskopie verwendet, um das Ausbleichen von fluoreszierenden Proben zu vermindern. Dies erfolgt ebenfalls durch die antioxidativen Eigenschaften des Propylgallat. 8
Gesundheitliche Risiken
Propylgallat verursacht bei Säuglingen eine lebensbedrohliche Blausucht (eine violette bis bläuliche Verfärbung der Haut, der Schleimhäute, der Lippen und der Fingernägel). Obwohl es in Säuglingsnahrung nicht erlaubt ist, darf es in typischen Kinderprodukten wie Marzipan, Nougat, Snacks oder vorgekochten Getreideprodukten verwendet werden. Auf der Zutatenliste von Lebensmitteln steht dieser Zusatzstoff unter der Bezeichnung Gallat. 9
Versuchsdurchführung
Dünnschichtchromatographie
Die Dünnschichtchromatographie ist eine Trennmethode zur qualitativen und quantitativen Analyse von Substanzen. Dabei handelt es sich um ein inneres Chromatogramm. Das bedeutet, dass die zu detektierenden Substanzen auf der DC-Platte verbleiben und nicht aus dem chromatographischen System eluiert werden müssen. 10
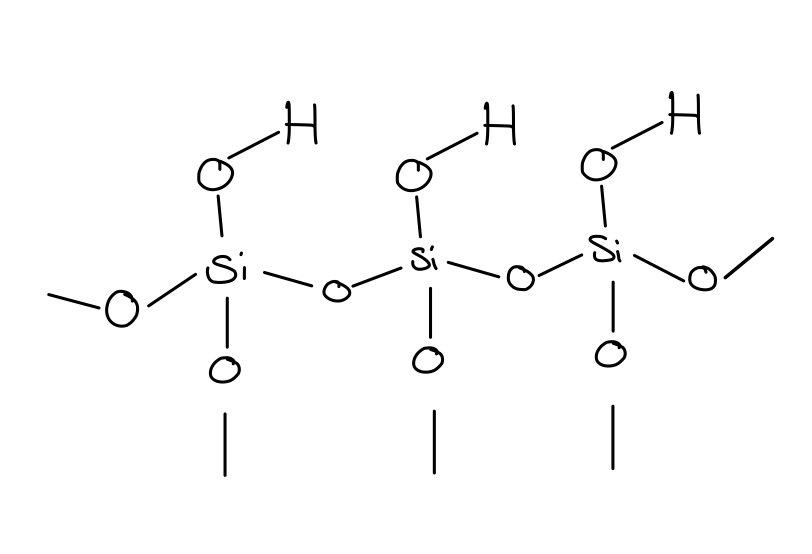
Das klassische für die stationäre Phase verwendete Material ist Kieselgel, dessen Oberfläche eine polare Silanole-Gruppierung (Si-OH) aufweist. Als mobile Phase oder Fließmittel können Gemische wie z.B. wasserfreie Ameisensäure R/ Ethylformiat R/ Toluol R dienen. 11
Der Affinitätsunterschied kommt durch verschiedene Polarität und andere Wechselwirkungen (z.B. Wasserstoffbrückenbindungen) der Substanz mit der stationären Phase zustande. 12
Die Entwicklung der Platte erfolgt entweder horizontal oder vertikal. 13
Für die Detektion gibt es drei verschiedenen Möglichkeiten.
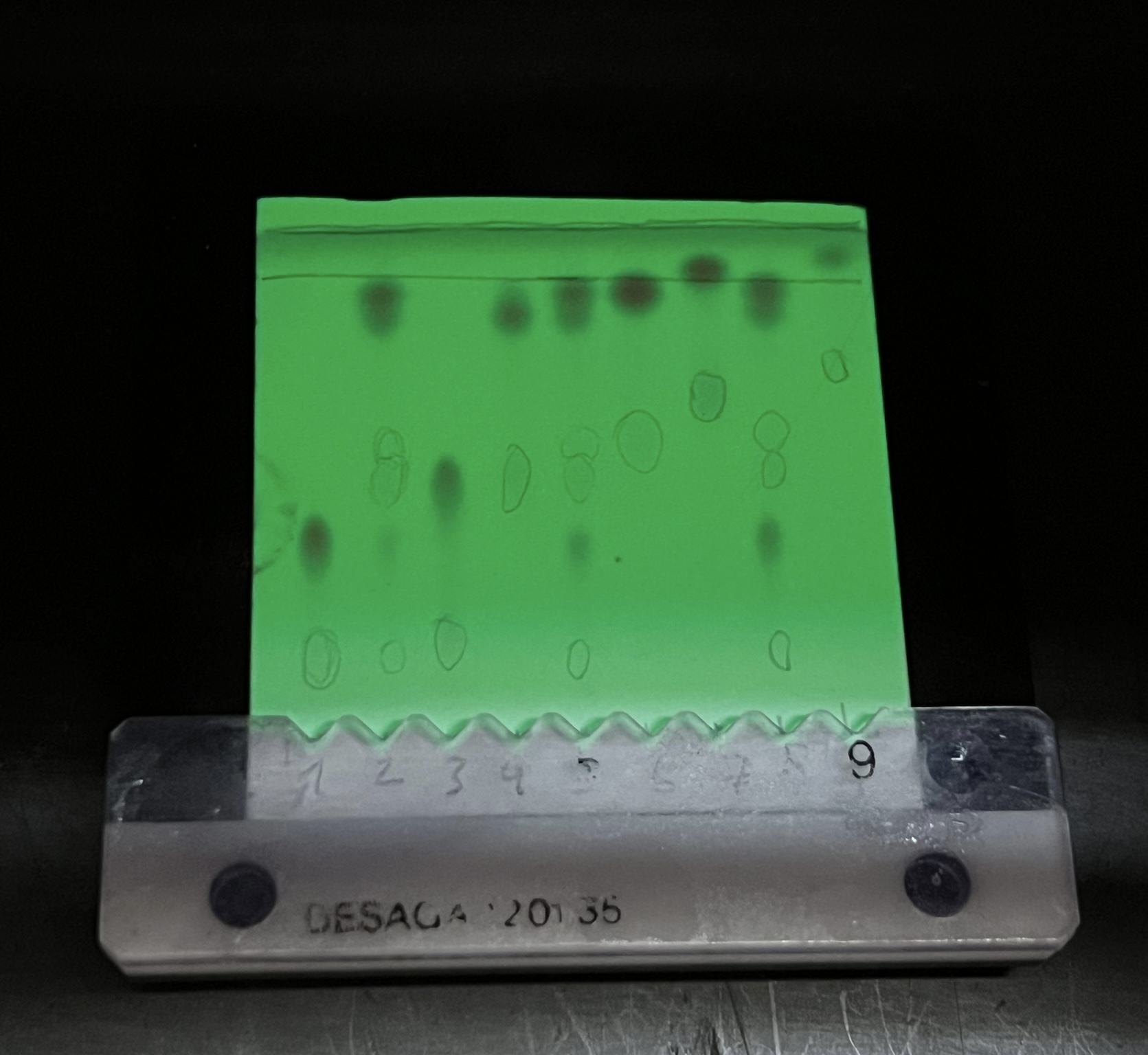
HPTLC-Platte unter UV-Lampe bei 254 nm14
- Anregung der Fluoreszenz ist für Stoffe geeignet, die im langwelligen UV-Licht zur Selbstfluoreszenz angeregt werden können. Unter der UV-Lampe bei 366 nm werden die Substanzen als hell leuchtende Flecken auf der dunklen Platte erkannt.
- Lumineszenzminderung geeignet für DC-Patten mit einer Schicht von Fluoreszenz bzw. Phosphoreszenzindikator. Dadurch kann die Fluoreszenz bzw. Phosphoreszenz des Indikators unter der UV-Lampe bei 254 nm angeregt werden. Dabei erscheinen die Substanzen als dunkle Flecken auf der hell leuchtenden Oberfläche.
- Die Platte wird mit einem geeigneten Detektionsreagenz besprüht oder durch Eintauchen in ein Derivatisierungsreagenz aufgebracht. Dabei reagiert die zu untersuchende Substanz mit dem Detektionsreagenz und es bildet sich gefärbte Flecken. 15
HPTLC
Eine Weiterentwickelung der DC ist die HPTLC. In diesem Fall wird eine kleinere Korngröße und eine engere Partikelgrößenverteilung für die Platte gewählt, was zu einer höheren Trennleistung führt. Zudem wird in kleineren Kammern gearbeitet, sodass weniger Substanz benötigt wird. 16
Durchführung
Für die Prüfung auf die Identität von Propylgallat wird hier die Methode Dünnschichtchromatographie behandelt. Bei dieser Methode bereitet man die Untersuchungslösung vor, indem man 10 mg Substanz in Aceton zu 10 mL löst. Für die Referenzlösung nimmt man 5 mg Propylgallat zur Identitätsprüfung und zur Gehaltsbestimmung. Dies wird in Aceton R zu 5 mL gelöst. Als Platte wählt man hier eine DC-Platte mit Kieselgel G R. Als Fließmittel verwendet man eine Mischung aus wasserfreier Ameisensäure R, Ethylformiat R und Toluol R in (10:40:40 V/V/V). Die Probe wird punktuell auf ein Ende der Platte aufgetragen und diese wird möglichst vertikal in eine geschlossene Kammer mit der mobilen Phase platziert. Aufgetragen werden also ca. 5 μl. Die mobile Phase bewegt sich nun mithilfe der Kapillarkräfte auf der Platte und die Probe bewegt sich aufgrund ihrer Affinität zur stationären Phase bzw. mobilen Phase unterschiedlich schnell mit. Die Laufstrecke beträgt hier 2/3 der Platte. Wenn die mobile Phase ca. 1 cm unter dem Plattenrand erreicht, wird die Platte aus der Kammer genommen und luftgetrocknet. Zu Detektionszwecken wird die Platte mit einer Mischung von 1 Volumenteil Eisen(III)-chlorid R 1 und 9 Volumenteilen Ethanol 96 % R besprüht. Die getrennten Komponenten erscheinen nun als farbige Flecken. 17
Auswertung/ Interpretation/ Bedeutung und Eignung
Die Dünnschichtchromatographie eignet sich für die Prüfung auf Identität, denn Propylgallat wechselwirkt mit der stationären Phase (Kieselgel/SiO2). Das Verhältnis der Fließmittel zB. Ethylformiat R, wasserfreie Ameisensäure R und Toluol R ist so gewählt, dass sie auf die Polarität so angepasst sind,dass Propylgallat ca. 2/3 der maximalen Laufstrecke am Kieselgel entlang fließen kann. Zur Detektion der Flecken, wird die Platte mit Eisen(III)-Chlorid-Lösung besprüht. Dadurch reagiert der Analyt mit dem Reagenz und es entstehen gefärbte Flecken. In diesem Fall bildet Propylgallat mit der Eisen(III)-Chlorid-Lösung, das für Pyrogallole typische, blauschwarze Eisenchelat. Für die Prüfung auf Identität wird der Hauptfleck der zu untersuchenden Substanz mit dem Hauptfleck der Referenzlösung bezogen auf die Lage, Farbe und Größe verglichen. Die Referenzlösung soll gleich weit wandern wie die Untersuchungslösung. Zur Auswertung wird der Retentionsfaktor (Rf) mithilfe der Retentionsfaktorformel berechnet, wobei b die Laufstrecke des Analyten darstellt und a die Laufstrecke des Fließmittels. 18
⚠ $$Rf= \frac{{b}}{{a}} ⚠ $$
Bei der Dünnschichtchromatographie ist zu beachten, dass sich die zu untersuchende Substanz im Fließmittel löst, sodass die mobile Phase den Analyten mittransportieren kann. Die Polarität der mobilen Phase ist sehr wichtig. Zu unpolare mobile Phasen können das Propylgallat nicht über die DC-Platte transportieren, der Analyt würde am Startfleck verbleiben. Anderseits darf die mobile Phase nicht zu polar sein, da der Analyt sonst nicht mit der stationären Phase wechselwirkt und nicht auswertbar ist. Damit eine verwertbare Auftrennleistung erfolgt, werden mobile Phasen an die zu trennenden Komponenten und verwendete stationäre Phase angepasst.
19
Von der Anschaffung bis zu den verwendeten Chemikalien und Verbrauchsobjekten handelt es sich um ein sehr kostengünstiges Verfahren. Zumal der präparative Aufwand und die Durchführung im Gegensatz zu anderen Methoden sehr schnell durchführbar ist. Somit ergeben sich für die DC und HPTLC tatsächlich wirtschaftliche Anwendungsmöglichkeiten im Apotheken Alltag. Dort müssen Verfahren günstig in der Anschaffung sein und schnell gehen, um Beschaffungs- und Gehaltskosten für Fachpersonal gering zu halten. Hinzu kommt, dass verunreinigungen oder falsche Identitäten einfach und sicher erkannt werden können. Falsche Identitäten ergeben falsche Retentionsfaktoren und Verunreinigungen zusätzliche Flecken. Somit ist dieses Verfahren aufgrund von Kosten/Nutzen Abwägungen und hoher Verlässlichkeit aus unserer Sicht das praktischste Verfahren zur Identitätsbestimmung von Propylgallat.
Übungsaufgaben
Multiple Choice (MC) Frage: HPTLC
Welche Aussagen zur HPTLC treffen zu?
- Die HPTLC-Platte zeichnet sich durch kleinere Korngrößen, eine engere Partikelgrößenverteilung und eine homogene Schichtdicke aus.
- Aufgrund der spezifischen Trennschichten der HPTLC-Platte, kommt es zu einer Verlängerung der Trennstrecken.
- Der DC-Scanner ermöglicht eine quantitative Auswertung auf der Grundlage des Remissionsspektrums; zu diesem Zweck sollte eine HPTLC-Platte verwendet werden.
- Die Fließmittelgeschwindigkeit kann bei der HPTLC gesteuert werden.
- Eine Detektionsmöglichkeit ist das Besprühen mit Derivatisierungsreagenzien.
- nur 4
- nur 2, 4 und 5
- nur 1, 2 und 4
- nur 1, 3 und 5
- 1 bis 5 (alle)
Antwort D ist korrekt.
(1) Die HPTLC ist eine Weiterentwicklung der DC. Ihre Platte zeichnet sich durch kleinere Korngrößen, eine engere Partikelgrößenverteilung und eine homogene Schichtdicke aus.20
(2) Die spezifischen Trennschichten der HPTLC-Platte verleihen der Platte eine höhere Trennleistung, wodurch die Laufstrecke kürzer wird( ca. 7 cm).21
(3) Der DC-Scanner ermöglicht eine quantitative Auswertung auf der Grundlage des Remissionsspektrums; zu diesem Zweck sollte eine HPTLC-Platte verwendet werden. Der Grund dafür ist, dass die HPTLC-Platte eine höhere Trenneffizienz und ein geringeres Untergrundsignal aufweist.22
(4) Die Fließmittelgeschwindigkeit kann weder bei der HPTLC noch bei der DC gesteuert werden.23
(5) Eine Detektionsmöglichkeit ist das Besprühen mit Derivatisierungsreagenzien wie z.B Eisen(III)-Chlorid R124
Textaufgabe: Dünnschichtchromatographie
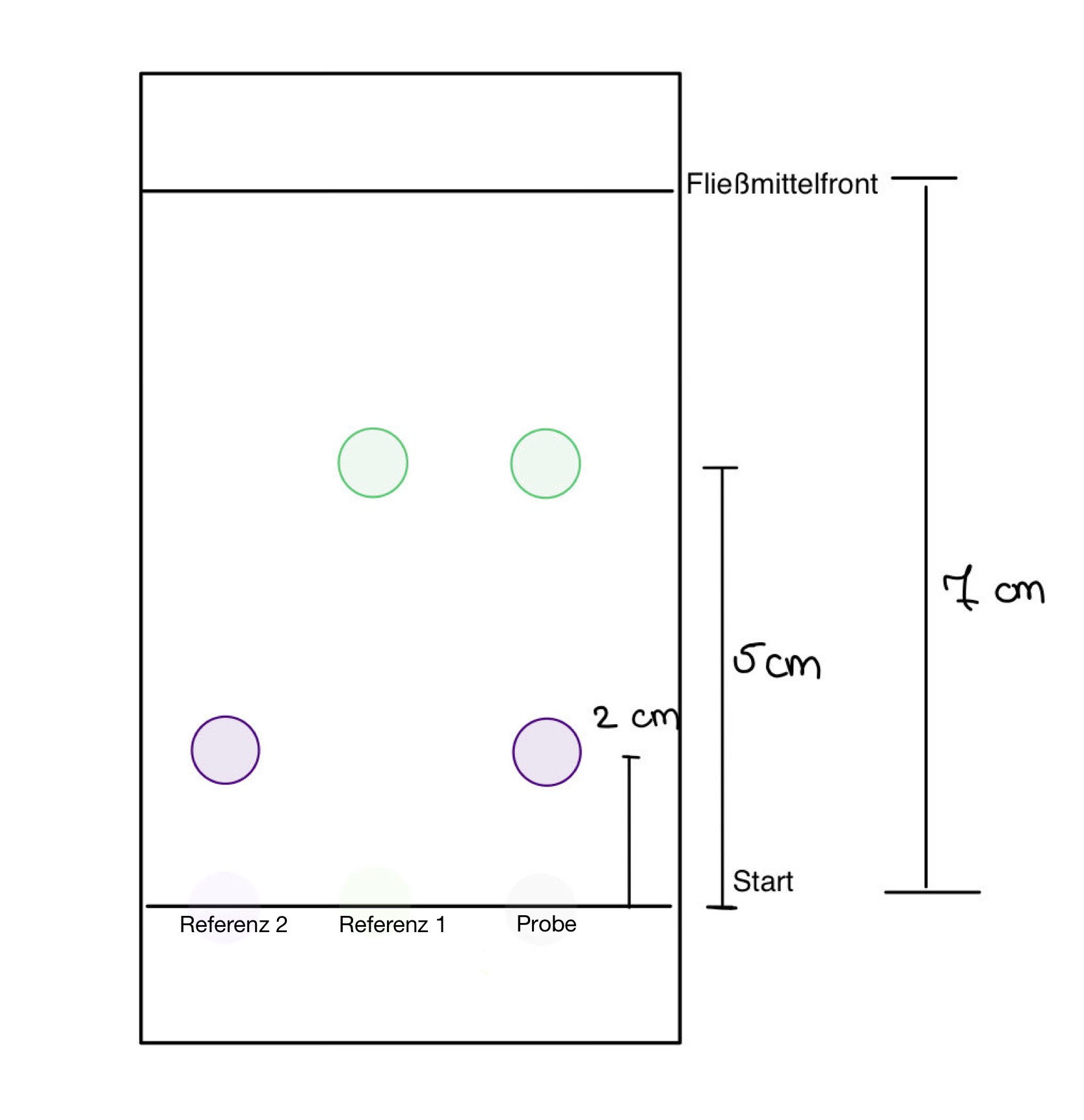
DC-Platte: Probemischung (grün und violett) mit Referenzensubstanzen; stationäre Phase: Kieselgel G R; Fließmittel: Ethylacetat, Toluol ( 30:70)25
- Berechnen Sie den Rf-Wert für jede der beiden Substanzen.
Rf( grün)= 5/7= 0,7
Rf(violett)= 2/7= 0,3
- Im Hinblick auf das verwendete Fließmittel und die Positionen der Flecken auf der Platte, sind die beiden Substanzen eher polar oder unpolar?
Toluol besteht aus einer Methylgruppe, die an einem Benzenring verknüpft ist —> unpolarer Aromat26
Ethylacetat ( Essigsäureethylester) ist eine Kohlenstoffkette mit Ester-Gruppe—> Die Substanz löst sich mäßig in Wasser auf.27
70% des Fließmittels besteht aus unpolarem Lösungsmittel—> Es handelt sich um ein relativ unpolares Fließmittel, in dem sich unpolare Stoffe gut auflösen und eine große Strecke zurücklegen können (grün gefärbte Substanz). Polare Stoffe hingegen können sich nur bedingt in diesem Fließmittel lösen. Außerdem gibt es starke Wechselwirkungen zwischen den polaren Substanzen und der polaren stationären Phase. Daher ist die zurückgelegte Strecke geringer (violett gefärbte Substanz).28
- Dieser Versuch wurde mit denselben Substanzen erneut durchgeführt, diesmal unter Verwendung von EtOH / AcOH/ MeOH/H2O (60:15:15:10) als Fließmittel. Welche Unterschiede sind in Bezug auf die Position der Flecken und den jeweiligen Rf-Wert zu erwarten? Begründen Sie Ihre Antwort.
Der Rf-Wert der violett gefärbten Substanz würde größer ausfallen als der, der grün gefärbten Substanz. Der Grund dafür ist, dass die violett gefärbte Substanz polarer ist und gut mit der polaren stationären Phase wechselwirkt, sodass die Substanz eine längere Strecke zurücklegen kann, als die grün gefärbte Substanz.29
- Um ein Substanzgemisch zuverlässig zu identifizieren, muss die Probe gleichzeitig mit Referenzsubstanz auf derselben Platte mitlaufen. Warum kann dies bessere Aussagen liefern als der Rf-Wert? Wovon hängt die Reproduzierbarkeit des Rf-Werts?
Die Reproduzierbarkeit hängt v.a von der Temperatur, der verwendeten Eluentenmischung, dem Sorben und der Kammersättigung ab. 30
- Zeichnen Sie den chemische Aufbau von Kieselgel und beschreiben Sie die chemische Struktur seiner Oberfläche. Welche Molekülteile sind für die Wechselwirkung der stationären Phase mit den Substanzen verantwortlich und welche Wechselwirkungskräfte entstehen dadurch?
Einzelnachweise
1 Eigene Darstellung von Ranim Alkanj Abseh; erstellt am 20.11.2022 ⇑
2 Kommentar zu Ph. Eur. 5.0/1039_ Propylgallat ⇑
3 Vgl. Ph. Eur. 10.0/1039_ Propylgallat ⇑
4 https://de.wikipedia.org/wiki/Propylgallat entnommen am: 29.11.2022, 20:10 Uhr ⇑
5 https://www.lebensmittellexikon.de/a0000780.php entnommen am: 06.01.2023, 20:10 Uhr ⇑
6 https://www.lebensmittellexikon.de/p0002930.php entnommen am: 06.01.2023, 20:15Uhr ⇑
7 https://www.zusatzstoffmuseum.de/lexikon-der-zusatzstoffe/propylgallat.html entnommen am: 06.01.2023, 20:18 Uhr ⇑
8 https://de.wikipedia.org/wiki/Propylgallat entnommen am: 29.11.2022, 20:10 ⇑
9 https://www.zusatzstoffmuseum.de/lexikon-der-zusatzstoffe/propylgallat.html entnommen am: 06.01.2023, 20:23 Uhr ] [^https://www.lebensmittellexikon.de/p0002930.php entnommen am: 06.01.2023, 20:28 Uhr ⇑
10 Vgl. Neugebauer, Michael/Rücker, Gerhard/Willems, Günter/Scriba, Gerhard K. E./Hubert, Marcus A.: Instrumentelle pharmazeutische Analytik, 5. Aufl., Stuttgart, Deutschland: Wissenschaftliche Verlagsgesellschaft, 2013, S. 500f. ⇑
11 vgl. Ph. Eur. 10.0/1039_ Propylgallat ⇑
12 vgl. Skript: Dünnschichtchromatographie, Prof. Dr. Hermann Wätzig und Sami Eldeeb ⇑
13 Vgl. Neugebauer, Michael/Rücker, Gerhard/Willems, Günter/Scriba, Gerhard K. E./Hubert, Marcus A.: Instrumentelle pharmazeutische Analytik, 5. Aufl., Stuttgart, Deutschland: Wissenschaftliche Verlagsgesellschaft, 2013, S. 501. ⇑
14 fotografiert von Lynn Ghannam am 13.12.2022 ⇑
15 Vgl. Neugebauer, Michael/Rücker, Gerhard/Willems, Günter/Scriba, Gerhard K. E./Hubert, Marcus A.: Instrumentelle pharmazeutische Analytik, 5. Aufl., Stuttgart, Deutschland: Wissenschaftliche Verlagsgesellschaft, 2013, S. 507f. ⇑
16 Vgl. Neugebauer, Michael/Rücker, Gerhard/Willems, Günter/Scriba, Gerhard K. E./Hubert, Marcus A.: Instrumentelle pharmazeutische Analytik, 5. Aufl., Stuttgart, Deutschland: Wissenschaftliche Verlagsgesellschaft, 2013, S. 502/507. ⇑
17 Vgl.Ph. Eur.10.0/1039 _ Propylgallat ⇑
18 Vgl.Ph. Eur.10.0/1039 _ Propylgallat ⇑
19 https://pharmchem.de.cool/ entnommen am: 29.11.2022, 20:10 ⇑
20 Vgl. Kommentar zu Ph. Eur. 10.0/2.08.25.00 ⇑
21 Vgl. Kommentar zu Ph. Eur. 9.0/2.02.27.00 ⇑
22 Vgl. Neugebauer, Michael/Rücker, Gerhard/Willems, Günter/Scriba, Gerhard K. E./Hubert, Marcus A.: Instrumentelle pharmazeutische Analytik, 5. Aufl., Stuttgart, Deutschland: Wissenschaftliche Verlagsgesellschaft, 2013, S. 513f. ⇑
23 Vgl. Kommentar zu Ph. Eur. 10.0/2.08.25.00 ⇑
24 Vgl. Kommentar zu Ph. Eur. 10.0/2.08.25.00 ⇑
25 Eigene Darstellung von Ranim Alkanj Abseh; erstellt am 20.11.2022 ⇑
26 https://de.wikipedia.org/wiki/Toluol entnommen am: 28.11.2022, 20:10 ⇑
27 https://de.wikipedia.org/wiki/Essigs%C3%A4ureethylester entnommen am: 28.11.2022, 20:30 ⇑
28 vgl. Skript: Dünnschichtchromatographie, Prof. Dr. Hermann Wätzig und Sami Eldeeb ⇑
29 vgl. Skript: Dünnschichtchromatographie, Prof. Dr. Hermann Wätzig und Sami Eldeeb ⇑
30 vgl. Skript: Dünnschichtchromatographie, Prof. Dr. Hermann Wätzig und Sami Eldeeb ⇑
31 vgl. Skript: Dünnschichtchromatographie, Prof. Dr. Hermann Wätzig und Sami Eldeeb ⇑
32 Eigene Darstellung von Ranim Alkanj Abseh; erstellt am 20.11.2022 ⇑