Massenspektrometrie
Titelblatt
Anwendungsbeispiel
Massenspektrometrie
WiSe 2022/2023
Abgabedatum
09.01.2023
Expertengruppe 07
Bea Frömke
Svenja Willermann
Marieke Grüger
Katharina Rist
Anwendungsbeispiel der Massenspektrometrie aus dem Europäischen Arzneibuch.
Monographiebeispiel: Weidenrinde (Ph. Eur. 10.0/1583)
Prüfung auf Reinheit von Weidenrinde mit der Massenspektrometrie mit induktiv gekoppeltem Plasma (ICP-MS)
Inhaltsverzeichnis
Stoffcharakterisierung
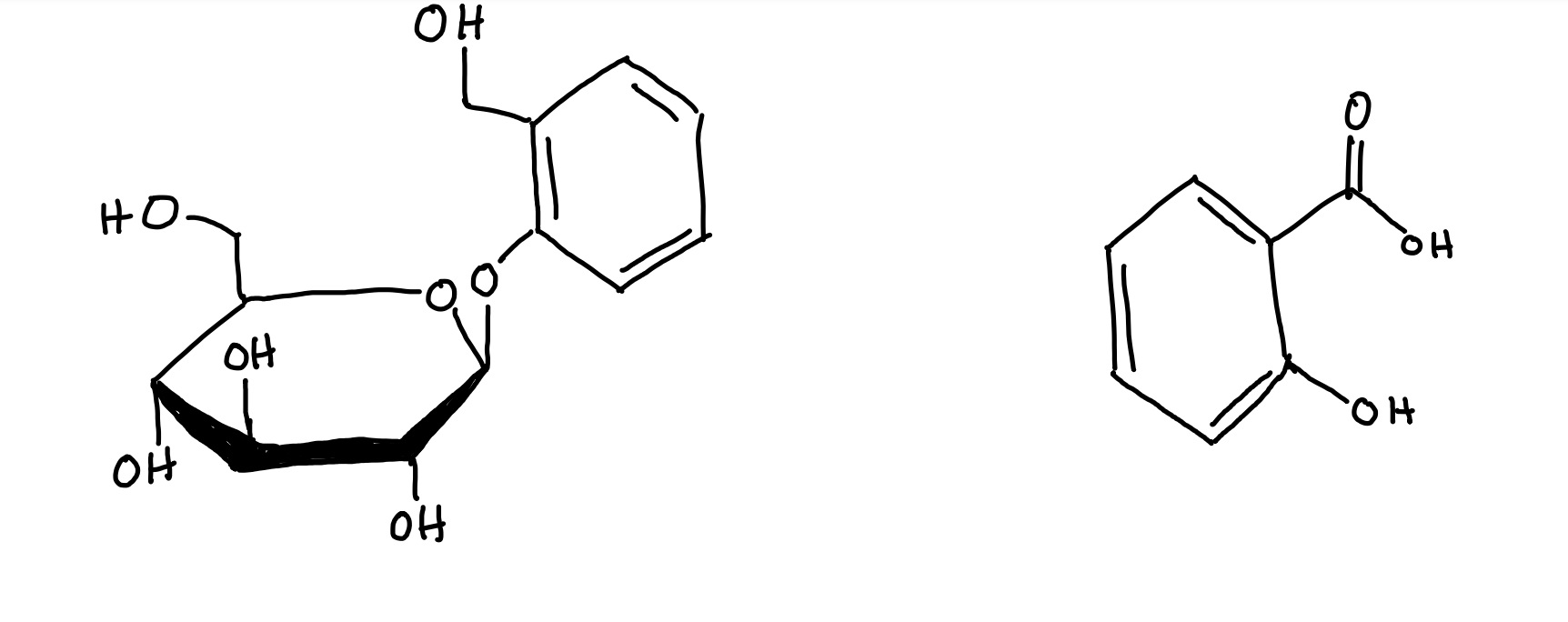
Die Weidenrinde (Salicis cortex) wird seit der Antike als analgetische, antipyretische und antiphlogistische Arzneidroge eingesetzt und hat bis heute einen Stellenwert als Phytotherapeutikum in der Behandlung grippaler Infekte, rheumatischer Beschwerden sowie leichter Schmerzen.1 Hauptsächlich werden Salix purpurea L., Salix daphnoides Vill. und Salix fragilis L., aus der Familie der Salicaceae, als Stammpflanzen für die Droge eingesetzt. Laut Arzneibuch besteht die Droge "Weidenrinde" aus ganzen, zerkleinerten, getrockneten Rinden junger Zweige oder es werden ganze, getrocknete Stücke der Jahrestriebe verwendet.2 Die Wirkung lässt sich auf die Derivate des Salicylalkohols, v.a. Salicin, zurückführen, die in den Stoffwechselprozessen des Körpers zu Salicylsäure metabolisiert werden.3
Versuchsdurchführung
Grundlagen zur Massenspektrometrie
Die Massenspektrometrie wird zur Identitätsprüfung und Reinheitsprüfung eingesetzt, so kann beispielsweise eine Verunreinigung qualifiziert und quantifiziert werden.5 Die Moleküle werden ionisiert und fragmentiert und können so in einem Massenspektrum aufgeführt werden.6
Allgemeiner Aufbau des Massenspektrometers:
In dem Massenspektrometer herrscht ein Hochvakuum, um Signalüberlagerungen der Probe mit von Sauerstoff und Stickstoff verursachten Peaks zu vermeiden. Außerdem wird dadurch die Kollision von Ionen untereinander vermindert.7 Um die Probe in das Gerät einzuführen, wird ein spezieller Probeneinlass verwendet, der das Vakuum nicht zerstört.8 Die Probe gelangt dann in den Ionisator, wird dort ionisiert und je nach noch vorhandener Energie zur Bindungsspaltung auch fragmentiert.9 Es gibt verschiedene Arten der Ionisation.10 Bei der hier aufgeführten Methode dient ein induktiv gekoppeltes Plasma als Ionisationsquelle.11 Im folgenden Massenanalysator werden die geladenen Bruchstücke nach dem Masse-zu-Ladungs-Verhältnis (m/z) aufgetrennt und von einem Detektor mit der entsprechenden Häufigkeit erfasst. Durch die Signalverarbeitung wird ein Massenspektrum erzeugt.12 Eine genauere Beschreibung ist in dem Artikel Massenspektrometrie zu finden.
Durchführung der Reinheitsprüfung
In der Prüfung auf Reinheit wird in der Monographie auf die Verunreinigung mit Cadmium (max. 2,0 ppm) geprüft.13 Die verwendeten Geräte müssen zuvor auf ausreichende Leistungsfähigkeit (u.a. Linearität, Richtigkeit, Wiederholpräzision und Bestimmungsgrenze) überprüft werden.14 Vor Beginn der Reinheitsprüfung werden alle verwendeten Geräte und Glasgeräte mit einer Lösung von Salpetersäure R (10 g/l) gereinigt.15
Untersuchungslösung:
Für die Untersuchungslösung wird die pulverisierte Weidenrinde [0,50 g; 1400] mit schwermetallfreier Salzsäure R [4 ml] und schwermetallfreier Salpetersäure R [6 ml] in einem Aufschlussgefäß gemischt.16
Blindlösung:
Die Blindlösung wird wie die Untersuchungslösung hergestellt. Es wird jedoch keine Weidenrinde verwendet.17
Referenzlösungen:
Um den Gehalt an Cadmium in der Weidenrinde zu bestimmen, wird die Direktkalibrierung angewendet.18 Es werden drei Referenzlösungen mit den Cadmium-Isotopen (106,108,111,114) hergestellt, die ebenfalls die gleichen Reagenzien enthalten wie die Untersuchungslösung.19 20
Die Konzentrationen der Referenzlösungen müssen den Kalibrierbereich der Nachweisgrenze bis zum 1,2-fachen des Grenzwertes (2,0 ppm) abdecken.21
Die Aufschlussgefäße mit den zuvor hergestellten Lösungen werden luftdicht verschlossen in das Mikrowellengerät eingesetzt. Nach Beendigung des 3-stufigen Aufschlusses [15 min 80% Leistung; 5 min 100% Leistung; 20 min 80% Leistung] werden die erkalteten Lösungen in jeweils einen Messkolben [50 ml] überführt. Im Anschluss werden die Aufschlussgefäße mit verdünnter, schwermetallfreier Salpetersäure R mehrmals [2 Mal mit je 15 ml] gespült und die Lösung ebenfalls in den entsprechenden Messkolben gegeben. Mit demineralisiertem Wasser wird bis zum Eichstrich des Messkolbens aufgefüllt.22
Sowohl die Referenzlösungen, die Untersuchungslösung als auch die Blindlösung werden in das ICP-MS-Gerät eingeführt und jeweils mehrfach vermessen. Für ein aussagekräftiges Ergebnis sollte eine gleiche Anzahl an Wiederholungen der Vermessungen der Lösungen erfolgen.23
Auswertung/ Interpretation/ Bedeutung und Eignung
Zur Auswertung wird der ermittelte Blindwert von den erhaltenen Messwerten der Untersuchungslösung und der Referenzlösungen abgezogen.24 Aus den so erhaltenen Werten der Referenzlösungen wird der Mittelwert errechnet und als Kalibrierkurve aufgetragen. Auf der Abszissenachse wird die Konzentration und auf der Ordinatenachse die relative Intensität aufgetragen. Die Konzentration der Cadmium-Verunreinigung in der Weidenrinde kann an der erstellten Kalibriergeraden abgelesen werden. 25 Die Prüfung entspricht den Anforderungen des Arzneibuchs, wenn der geforderte Grenzwert von max. 2,0 ppm eingehalten wird.26
Es können Interferenzen auftreten. Daher ist bei der Untersuchung zu beachten, dass der Analyt mit der Matrix reagieren kann, wodurch es zum Ausbleiben eines Signals kommt. Außerdem können Spezies gleicher Massenzahl den Analyten überlagern. Ein weiteres Problem könnte in der Zusammenlagerung von atomaren Ionen bestehen. Durch die Verwendung von einem inneren Standard oder der Standardadditionsmethode können physikalische Interferenzen verhindert werden.27
Ein großer Nachteil der ICP-MS sind die hohen Kosten in der Anschaffung und im Betrieb. Außerdem ist es sehr aufwendig und daher in kleinen Laboratorien und in der Apotheke nicht einsetzbar.28 Allerdings überzeugt die ICP-MS durch viele Vorteile, so ist der Nachweis nahezu aller Elemente mit sehr geringen Nachweisgrenzen möglich. Dieses bestätigt sich durch die Verwendung in der Spurenanalytik, bei der bis in den sub-ppt Bereich gearbeitet wird.29 Die Auflösung ist sehr hoch, sodass nah zusammenliegende Massen getrennt werden können. Es handelt sich somit um ein sehr leistungsfähiges Verfahren. Ein weiterer Vorteil besteht in der Verwendung von nur kleinen Probenmengen und der einfachen Probenvorbereitung. In der ICP-MS entstehen zur Auswertung einfache Spektren einfach geladener Kationen, da die Matrix durch die hohen Temperaturen des Plasmas entfernt wird.30
Übungsaufgaben
Multiple Choice (MC) Frage
Wie ist der korrekte Aufbau eines Massenspektrometers?
- Detektor - Massenanalysator - Ionisator - Signalverarbeitung - Probeneinlass
- Probeneinlass - Ionisator - Detektor - Massenanalysator - Signalverarbeitung
- Ionisator - Probeneinlass - Massenanalysator - Signalverarbeitung - Detektor
- Probeneinlass - Ionisator - Massenanalysator - Detektor - Signalverarbeitung
- Ionisator - Probeneinlass - Massenanalysator - Detektor - Signalverarbeitung
Textaufgabe
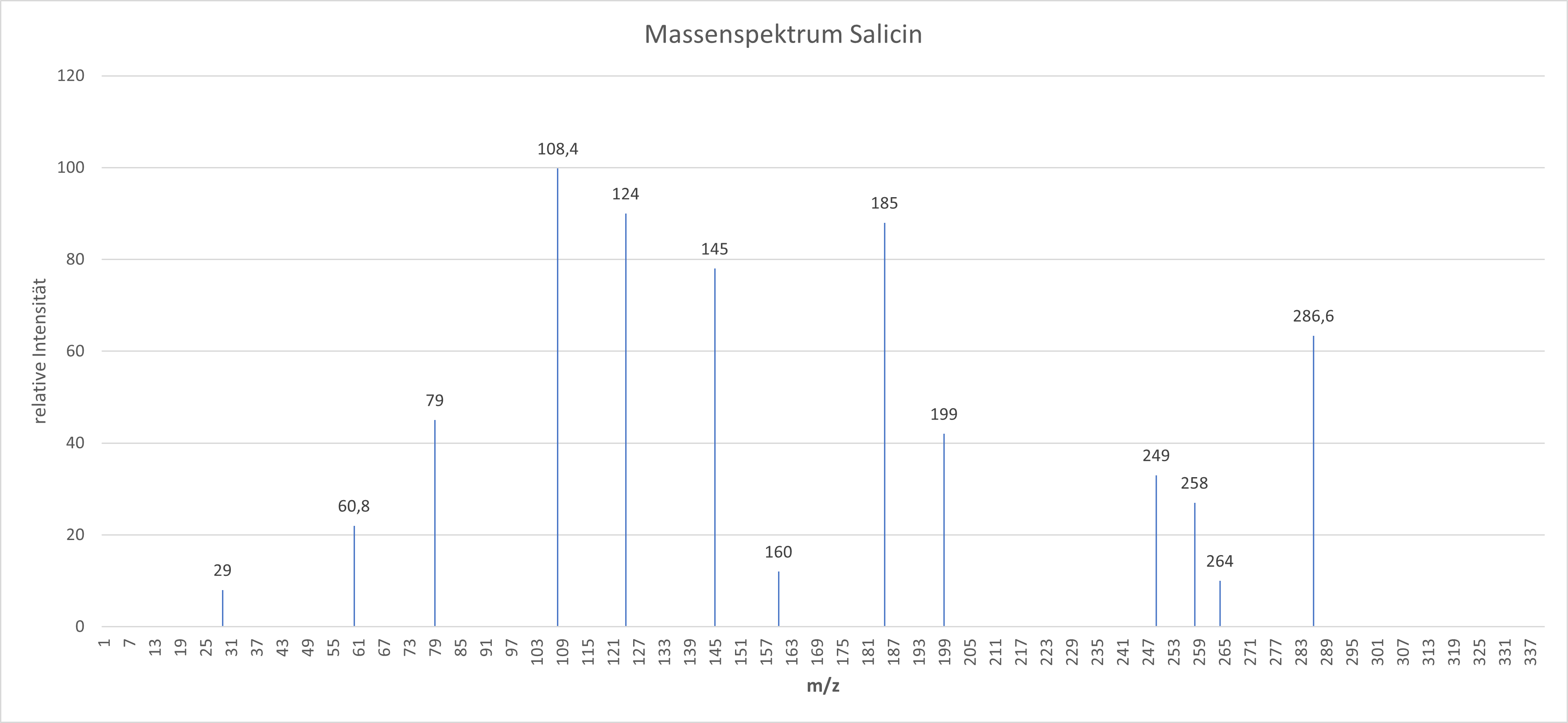
- In der Abbildung 3 ist ein Beispielmassenspektrum von Salicin dargestellt. Identifizieren Sie den Basispeak und den Molekül-Ionen Peak. Erläutern Sie Ihre Entscheidung.
Der Basispeak ist in einem Massenspektrum der höchste Peak und hat somit die höchste relative Intensität. In diesem Spektrum liegt dieser bei einem Masse-zu-Ladungs-Verhältnis bei 108,4 und einer Intensität von 100. Der Molekül-Ionen Peak zeigt im Spektrum das unfragmentierte Molekül, das Masse-zu-Ladungs-Verhältnis ist identisch mit der molaren Masse des vollständigen Moleküls. In diesem Spektrum liegt dieser bei einem Masse-zu-Ladungs-Verhältnis bei 286,6 und einer Intensität von 63.34
- In der Massenspektrometrie wird zwischen harten und weichen Ionisationsverfahren unterschieden. Erläutern Sie die Unterschiede zwischen diesen Verfahren. Nennen Sie für jedes Verfahren ein Beispiel.
Bei der harten Ionisation wird durch Beschuss mit energiereichen Teilchen eine starke Schwingung in den Molekülionen ausgelöst. Die Energie der Teilchen, mit denen beschossen wird, ist höher als die zur Ionisation benötigte Energie. Die überschüssige Energie sorgt deshalb für starke Fragmentierungsreaktionen. Diese Methode wird aufgrund dessen eher für die Strukturaufklärung eingesetzt.
Beispiel: Elektronenstoßionisation
Bei der weichen Ionisation erfolgt die Anregung thermisch, chemisch, elektrisch oder photochemisch. Dabei werden Quasimolekülionen gebildet. Da die Energie der Teilchen, mit denen beschossen wird, geringer ist, finden weniger Fragmentierungen statt.
Beispiel: Chemische Ionisation (CI), Elektronenspray-Ionisation (ESI), Chemische Ionisation unter Atmosphärendruck (APCI), Matrixunterstützte Laserdesorption (MALDI), Fast Atom Bombardement (FAB)35
- Erläutern Sie, warum bei der Massenspektrometrie ein Hochvakuum verwendet wird.
Durch das Hochvakuum wird die Kollision der Ionen untereinander und Signalüberlagerungen der Probe mit durch Sauerstoff oder Stickstoff verursachte Peaks vermieden.36
- Massenspektrometrie wird häufig mit anderen Verfahren gekoppelt. Ein Beispiel ist die Kopplung von Flüssigchromatographie mit der Massenspektrometrie. Erläutern Sie das Ziel der Kopplung und mögliche Probleme.
Gemischspektren sind in der Regel meist wenig aussagekräftig. Das gilt ebenfalls für Massenspektren verunreinigter Substanzen. Die Kopplung dient damit zur Trennung von Substanzgemischen. Anschließend findet die Identifikation der Komponenten durch das Massenspektrum statt. 37
Ein Problem stellt die notwendige starke Reduzierung der flüssigen, mobilen Phase dar, da hohe Lösungsmittelmengen das Hochvakuum im Massenspektrometer zerstören können.38
- Erläutern Sie, was unter einem Plasma verstanden wird und wie es erzeugt wird.
Unter einem Plasma versteht man ein elektrisch leitendes, gasförmiges System aus Atomen, Molekülen, negativ und positiv geladenen Ionen und Elektronen. Plasma wird durch Übertragung elektrischer Energie auf einen Gasstrom erzeugt. Dabei wird in der Regel Argon, Stickstoff oder Helium als Gas verwendet. ICP bedeutet, dass die Ionisierung in einer Induktionsspule eines Hochfrequenz-Generators stattfindet. In dem erzeugten Plasma wird dann das Probenaerosol ionisiert.39
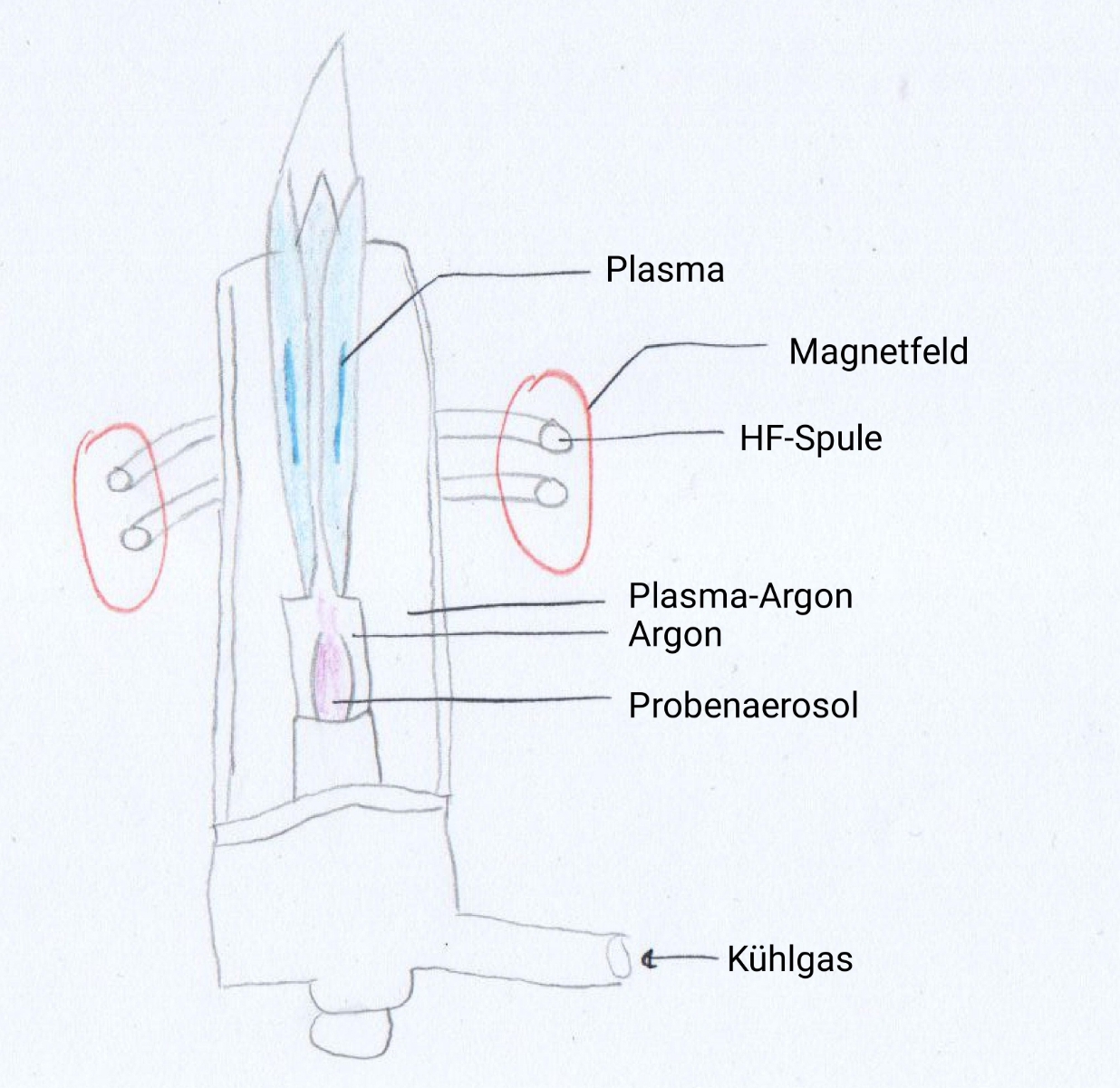
Die Plasmafackel besteht aus 3 konzentrischen Röhren, die aus dem Material Quarz bestehen (Abb. 4). Durch das innerste Rohr wird die vernebelte Probe mit dem Trägergas eingeleitet, durch das mittlere Rohr wird in diesem Beispiel Argon eingeleitet, das die Aufgabe eines Hilfsgases übernimmt. Aufgrund des Hilfsgases wird das heiße Plasma von dem innersten Rohr fern gehalten. Außerdem wird durch das Hilfsgas das Einströmen der Probe erleichtert. Im äußersten Rohr wird Argon, das Plasmagas, eingeleitet, welches zusätzlich als Kühlgas der Kühlung des äußersten Rohres dient.
Durch einen Zündfunken entstehen im eingeleiteten Argongas Argon-Ionen und Elektronen. Das Hochfrequenzfeld beschleunigt die entstandenen Elektronen in kreisförmige Bahnen. Die Elektronen kollidieren mit den Gasmolekülen, sodass weitere Ionen und Elektronen erzeugt werden. Es beginnt eine Kettenreaktion der Ionisation. Im Plasma entstehen Temperaturen von 6000-10000°C. Die Flamme ist dabei farblos. Die Aufrechterhaltung des Plasmas erfolgt durch die Übertragung der Hochfrequenzenergie durch den induktiven Kopplungsprozess. Das Plasma bewegt sich radial. Daher kann das eingeleitete Probenaerosol in das Plasma gelangen. Dabei entsteht ein Kanal mit Temperaturen von 6000-8000°C. Aufgrund der hohen Temperatur und der Verweildauer kommt es zur Atomisierung, Ionisierung und Anregung.40 Über ein spezielles Interface werden die gebildeten Ionen in die Ionenoptik und schließlich in den Massenanalysator geleitet.41
Einzelnachweise
1 https://www.apotheken-umschau.de/medikamente/heilpflanzen/weide-weidenrinde-736507.html Zugriff: 04.01.2023 ⇑
2 Ph.Eur. 10.0/1583 Weidenrinde ⇑
3 Arzneibuchkommentar 9.0/1583 Weidenrinde ⇑
4 Selbsterstellt von Bea Frömke am 04.01.2023 ⇑
5 Arzneibuchkommentar 6.0/2.02.58.00 Massenspektrometrie mit induktiv gekoppeltem Plasma ⇑
6 Rücker, Neugebauer, Willems; Instrumentelle pharmazeutische Analytik; 5. Auflage; S. 323; Wissenschaftliche Verlagsgesellschaft Stuttgart ⇑
7 Skript Massenspektrometrie, Finja Krebs, Wintersemester 22/23, Seite 5 ⇑
8 Dominik, Steinhilber, Wurglics; Instrumentelle Analytik kompakt; 3. Auflage; S. 167 ff.; Wissenschaftliche Verlagsgesellschaft Stuttgart ⇑
9 Rücker, Neugebauer, Willems; Instrumentelle pharmazeutische Analytik; 5. Auflage; S. 323; Wissenschaftliche Verlagsgesellschaft Stuttgart ⇑
10 Rücker, Neugebauer, Willems; Instrumentelle pharmazeutische Analytik; 5. Auflage; S. 332ff. ; Wissenschaftliche Verlagsgesellschaft Stuttgart ⇑
11 Ph.Eur. 10.0/2.04.27.00 Schwermetalle in pflanzlichen Drogen und Zubereitungen aus pflanzlichen Drogen ⇑
12 Rücker, Neugebauer, Willems; Instrumentelle pharmazeutische Analytik; 5. Auflage; S. 323 ; Wissenschaftliche Verlagsgesellschaft Stuttgart ⇑
13 Ph.Eur. 10.0/1583 Weidenrinde ⇑
14 Ph.Eur. 10.0/2.02.58.00 Massenspektrometrie mit induktiv gekoppeltem Plasma ⇑
15 Ph.Eur. 10.0/2.04.27.00 Schwermetalle in pflanzlichen Drogen und Zubereitungen aus pflanzlichen Drogen ⇑
16 Ph.Eur. 10.0/2.04.27.00 Schwermetalle in pflanzlichen Drogen und Zubereitungen aus pflanzlichen Drogen ⇑
17 Ph.Eur. 10.0/2.04.27.00 Schwermetalle in pflanzlichen Drogen und Zubereitungen aus pflanzlichen Drogen ⇑
18 Ph.Eur. 10.0/2.04.27.00 Schwermetalle in pflanzlichen Drogen und Zubereitungen aus pflanzlichen Drogen ⇑
19 Ph.Eur. 10.0/2.04.27.00 Schwermetalle in pflanzlichen Drogen und Zubereitungen aus pflanzlichen Drogen ⇑
20 Ph.Eur. 10.0/2.02.23.00 Atomabsorptionsspektrometrie ⇑
21 Ph.Eur. 10.0/2.04.27.00 Schwermetalle in pflanzlichen Drogen und Zubereitungen aus pflanzlichen Drogen ⇑
22 Ph.Eur. 10.0/2.04.27.00 Schwermetalle in pflanzlichen Drogen und Zubereitungen aus pflanzlichen Drogen ⇑
23 Ph.Eur. 10.0/2.02.23.00 Atomabsorptionsspektrometrie ⇑
24 Ph.Eur. 10.0/2.04.27.00 Schwermetalle in pflanzlichen Drogen und Zubereitungen aus pflanzlichen Drogen ⇑
25 Ph.Eur. 10.0/2.02.23.00 Atomabsorptionsspektrometrie ⇑
26 Ph.Eur. 10.0/1583 Weidenrinde ⇑
27 Ph.Eur. 10.0/2.02.58.00 Massenspektrometrie mit induktiv gekoppeltem Plasma ⇑
28 Arzneibuchkommentar 6.0/2.02.58.00 Massenspektrometrie mit induktiv gekoppeltem Plasma ⇑
29 Rücker, Neugebauer, Willems; Instrumentelle pharmazeutische Analytik; 5. Auflage; S. 389; Wissenschaftliche Verlagsgesellschaft Stuttgart ⇑
30 Arzneibuchkommentar 6.0/2.02.58.00 Massenspektrometrie mit induktiv gekoppeltem Plasma ⇑
31 Skript Massenspektrometrie, Finja Krebs, Wintersemester 22/23, Seite 5 ⇑
32 Selbsterstellt von Bea Frömke am 23.11.2022 ⇑
33 Selbsterstellt von Bea Frömke am 23.11.2022 ⇑
34 Skript Massenspektrometrie, Finja Krebs, Wintersemester 22/23, Seite 7 ⇑
35 Skript Massenspektrometrie, Finja Krebs, Wintersemester 22/23, Seite 9 ff. ⇑
36 Skript Massenspektrometrie, Finja Krebs, Wintersemester 22/23, Seite 5 ⇑
37 Rücker, Neugebauer, Willems; Instrumentelle pharmazeutische Analytik; 5. Auflage; S. 361; Wissenschaftliche Verlagsgesellschaft Stuttgart ⇑
38 Skript Massenspektrometrie, Finja Krebs, Wintersemester 22/23, Seite 38 ⇑
39 Skript Atomspektrometrische Analyseverfahren, Christin Scheller, Wintersemester 22/23, Seite 27 ⇑
40 Rücker, Neugebauer, Willems; Instrumentelle pharmazeutische Analytik; 5. Auflage; S. 84f.;Wissenschaftliche Verlagsgesellschaft Stuttgart ⇑
41 Rücker, Neugebauer, Willems; Instrumentelle pharmazeutische Analytik; 5. Auflage; S. 389.;Wissenschaftliche Verlagsgesellschaft Stuttgart ⇑
42 Selbsterstellt von Marieke Grüger am 04.01.2023 ⇑