Fluorimetrie
Bericht der Expertengruppe 15 für
Fluorimetrie
SoSe 2021
Abgabedatum
20.06.2021
Über-/Expertengruppe 15
Lennart Stein
Leonard Mages
Anton Motorin
Marc Berger
Claire Girod
Benjamin Witsch
Fluorimetrie
Inhaltsverzeichnis
Einleitung
Fluorimetrie, umgangssprachlich oft auch als Fluoreszenzspektroskopie bezeichnet, ist ein Verfahren der analytischen Chemie, das Substanzen mittels Spektroskopie analysiert. Die zu untersuchenden Substanzen sollen durch auftreffende Strahlung zur Fluoreszenz angeregt werden. Diese kann dann für qualitative und quantitative Analysen detektiert und ausgewertet werden.
Grundlagen (physikalische/ chemische)
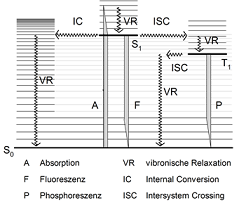 ...
... Abb. 1: Jablonski-Termschema zur Verdeutlichung der möglichen Übergänge von Valenzelektronen. 1
Was versteht man unter Fluoreszenz und wie entsteht sie?
Die Emission von Licht im UV/Vis-Bereich als Reaktion auf eine vorhergehende nicht-thermische Energieaufnahme bezeichnet man als Lumineszenz. Wie im Jablonski-Termschema zu sehen ist geht bei der Phosphoreszens das Valenzelektron zunächst in einen Triplett-Zustand über und dann in den Ursprungszustand, weswegen ein Nachleuchten möglich ist. Erfolgt die Emission ohne Zeitverzögerung, spricht man von Fluoreszenz, wobei diese mit dem Abschalten der Lichtquelle, die als Energielieferant dient, endet. Die Fluoreszenz lässt sich, abhängig von der Wellenlänge der emittierten Strahlung, in Photo-Fluoreszenz und Röntgen-Fluoreszenz unterteilen. Während bei der Photo-Fluoreszenz die emittierte Strahlung im ultravioletten oder sichtbaren Bereich (200-800 nm) liegt, weist die Röntgen-Fluoreszenz Strahlung im Bereich der Röntgenstrahlung (1 nm - 10 pm) auf.
Die Intensität der Fluoreszenz ist proportional zur Intensität des Anregungslichtes ⚠ $ I_0 $ , der Quantenausbeute ⚠ $ \phi_F \ $ , dem molaren Absorptionskoeffizienten ⚠ $ \epsilon \ $ , der Konzentration ⚠ $ c $ und der Schichtdicke der verwendeten Küvette, ⚠ $ b $ und lässt sich nach folgender Formel berechnen: ⚠ $$ I_F = \phi_F \cdot I_0 \cdot \epsilon \cdot c \cdot b ⚠ $$ Die Intensität der Fluoreszenz ist daher gleich dem Produkt aus Quantenausbeute, Intensität des Anregungslichtes, dem molaren Absorptionskoeffizienten, der Konzentration der untersuchten Probe und der Schichtdicke der Probenküvette.2
Wird ein Molekül mit Licht aus dem UV/Vis-Bereich bestrahlt, kann dies zu einer Lichtabsorption führen, welche dem Elektronensystem des Moleküls Energie zuführt. Die Elektronen wechseln aus dem Grundzustand, welcher durch das niedrigst mögliche Energieniveau gekennzeichnet ist, in einen angeregten Zustand, welcher über mehr Energie verfügt. Während der Grundzustand als ⚠ $ S_0 $ bezeichnet wird, stellen ⚠ $ S_1 $ und Folgende die höheren Energieniveaus dar, welche noch einmal in Schwingungszustände zunehmender Energie, ⚠ $ \nu =1 $ , ⚠ $ \nu =2 $ usw. unterteilt werden können. Wie auch dem Jablonski-Termschema (Abb.1) zu entnehmen ist, gelangen Elektronen durch die beschriebene Anregung auf eines der Schwingungsniveaus der höheren Anregungszustände. Wie die meisten selbstüberlassenen physikalischen Systeme, sind auch die hier betrachteten Elektronen bestrebt, in den Grundzustand, als System des niedrigsten Energiegehalts, zurückzukehren. In der Mehrzahl der Fälle geschieht dies strahlungslos, indem die Energie beispielsweise durch die Reibung aufeinander prallender Elektronen abgeführt wird. Eine Ausnahme hiervon zeigt sich bei der Fluoreszenz. Hier fallen die Elektronen in einem ersten Schritt strahlungslos nur bis zum Schwingungszustand ⚠ $ \nu=1 $ innerhalb des Anregungszustandes ⚠ $ S_1 $ zurück. Der weitere Übergang in einen Schwingungszustand des Grundzustandes erfolgt als Emission von Fluoreszenzlicht. Da das angeregte Molekül bestrebt ist, möglichst schnell in den Grundzustand zurückzukehren, wird jener Weg zur Abführung von Energie gewählt, der dieses am schnellsten gewährleistet, wobei insbesondere starre und planare Moleküle zur Fluoreszenz neigen, weil ihnen andere Wege der Energieabgabe erschwert sind. Da nur ein Teil der absorbierten Energie als Fluoreszenz abgestrahlt wird, ist diese immer langwelliger und damit energieärmer, als das Anregungslicht.
Strukturelemente, die Fluoreszenz begünstigen
Damit ein Molekül befähigt ist zu fluoreszieren, muss es bestimmte Grundvoraussetzungen erfüllen. Starre, planare Systeme sind hierbei bevorzugt, da solche die aufgenommene Energie schlecht über Rotationen und Schwingungen (internal conversion) abgeben können. Somit wird bei diesen Molekülstrukturen der Weg gewählt, bei dem die Verweildauer im angeregten Zustand am geringsten ist. Elektronen von Doppelbindungen oder aromatischen Systemen sind besonders gut anregbar, da sie über zwei oder mehrere Atome verteilt sind. Somit gehören aromatische Systeme, konjugierte Doppelbindungen, Carbonylverbindungen oder kondensierte Heterocyclen, wie sie z.B. beim Chinolin anzutreffen sind, zu den Strukturelementen, die Fluoreszenz begünstigen können.3
Fluoreszierende Substanzen
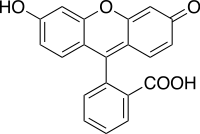
Abb. 2: Fluorescein als Beispiel für Substanzen, die von sich aus zur Fluoreszenz befähigt sind. Quelle: Wikipedia.de . 4
Fluoreszierende Substanzen sind in ihrem Gebrauch sehr vielseitig und dadurch im Alltag weit verbreitet. Man findet sie in Getränken wie Gin & Tonic, in Tracern auf Geldscheinen oder als optische Aufheller in Waschmitteln. Eine der bekanntesten und in der Industrie wohl am häufigsten eingesetzten fluoreszierenden Substanzen ist das Fluorescein, welches seine Fähigkeit bereits im Namen trägt. Fluorescein wird in der organischen Chemie oft als Indikator verwendet, zum Färben von verschiedenen Badeartikeln und um Oberflächenbeschaffenheiten von Immunglobulinen (Antikörper) im Körper nachzuweisen. Fluorescein besitzt eine vergleichsweise hohe Quantenausbeute von 93%. Dieses positive Attribut wird jedoch beschattet von der Störanfälligkeit des Moleküls und ist somit in seiner Wirksamkeit eingeschränkt. Unter pH 7 wird die Intensität stark herabgesetzt und aufgrund von Lichteinstrahlung kann die Fluoreszenz zurück gehen.5 Dieses Phänomen bezeichnet man als „Photobleichung“. Chinin ist ein weiteres bekanntes Beispiel unter den fluoreszierenden Molekülen. Das Alkaloid der Chinarinde (Cinchonae cortex) galt während der englischen Kolonialzeit in subtropischen Gebieten als unentbehrlich, da es prinzipiell zur Prophylaxe und symptomatischen Behandlung der heute noch weit verbreiteten Malaria-Erkrankung, einer Parasitose mit oft schwerem Verlauf, eingesetzt werden kann. 6 Mischt man das bitter schmeckende Alkaloid mit Wasser oder anderen Lösemitteln und bestrahlt diese Lösung mit energiereichem Licht wie UV-Strahlen, leuchtet es bläulich. Dies ist unter anderem ein Nachweis für Chinin in Lösungen. 7
Abhängigkeit der Fluoreszenzfähigkeit vom pH-Wert
Die Fähigkeit zur Fluoreszenz kann von vielfältigen äußeren Einflüssen abhängen. Neben der Wechselwirkung mit anderen Molekülen zählt der pH-Wert zu jenen Faktoren, welche die Fluoreszenzfähigkeit beeinflussen können. Da Verschiebungen des pH-Wertes zu Protonierungen oder Deprotonierungen innerhalb eines Substanzmoleküls führen können, führen diese Veränderungen in bestimmten Fällen auch zum Verlust der Fluoreszenzfähigkeit. So ist beispielsweise Riboflavin nur im neutralen Milieu fluoreszierend. Im sauren Milieu verkleinert eine Protonierung des Stickstoffs das delokalisierte ⚠ $ \pi $ -Elektronensystem und bewirkt damit einen hypsochromen Effekt bei der Absorption. Dagegen kommt es im stark basischen Milieu durch die Deprotonierung des Stickstoffs zu einer Vergrößerung des delokalisierten ⚠ $ \pi $ -Systems und einem bathochromen Effekt auf die Absorption. Im sauren und basischen pH-Bereich erfolgt daher die Energieabgabe nicht in Form von Fluoreszenz, sondern als strahlungslose Deaktivierung. Zwar sind die prinzipellen Ursachen für Fluoreszenzfähigkeit, insbesondere im Bereich des Elektronensystems der Moleküle, bekannt, jedoch reicht dies nicht aus, um feste und eindeutige Zusammenhänge zwischen Umwelteinflüssen wie dem pH-Wert und der Fluoreszenz herzustellen. Deshalb kann die Fluoreszenz ihre Vorteile eher in der quantitativen Analytik ausspielen.
Fluoreszenz in der Natur
In der Natur sind zahlreiche Organismen bekannt, die sich diesen Effekt zu Nutze machen. So verfügen beispielsweise viele Katzenhaiarten über eine Form der Biofluoreszenz, welche von uns aber im Allgemeinen nicht wahrgenommen werden kann, da in den Tiefen der Meere Blaulicht deutlich überwiegt. 8 Die Qualle Aequorea victoria verfügt über ein spezielles Protein (GFP), welches unter Anregung durch blaues oder ultraviolettes Licht grün fluoresziert. Nachdem dieses Protein sequenziert wurde, diente es sehr bald als Marker in der Biotechnologie, da es eine Alternative zu Markern darstellte, welche nur über den Umweg eines belichteten Films einsetzbar waren. 9 Leuchtkäfer und Glühwürmchen hingegen verfügen über einen Mechanismus der Biolumineszenz, bei dem der Naturstoff Luciferin oxidiert wird. Die so freigesetzte Energie wird in Form von Wärme und Licht wieder abgegeben. 10
Instrumenteller Aufbau
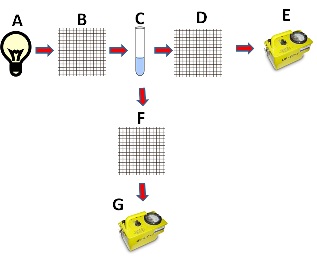
Abb. 3: Schematische Darstellung eines Einstrahlfluorimeters mit A Lichtquelle, B Anregungsmonochromomator, C Probe, D Absorptionsmonochromator, E Absorptionsdetektor, F Emissionsmonochromator, G Emissionsdetektor .
Aufbau eines Fluorimeters
In vielen Fällen erfolgt die Fluorimetrie über Emissionsspektren. Es wird also die Fluoreszenzintensität als Funktion der Emissionswellenlänge dargestellt. Da aber, wie in Kapitel 1.3.1. beschrieben, die Fluoreszenzintensität nicht nur proportional zur Intensität des Anregungslichtes ist, sondern ebenso von der Quantenausbeute abhängt, können auch Aktionsspektren aufgenommen werden. Wobei die Fluoreszenzintensität als Funktion der Anregungswellenlänge bestimmt wird. Hierbei wird die Emissionsintensität bei fester Wellenlänge gemessen, während die Anregungswellenlänge variiert wird. Über die so ermittelten Unterschiede kann zum Beispiel bei Chromophoren die Energieleitung untersucht werden. Wird nur das Emissionsspektrum der Probe detektiert, handelt es sich um ein Einstrahlfluorimeter, wird parallel hierzu eine Vergleichslösung untersucht, handelt es sich um ein Zweistrahlfluorimeter.
Abbildung 3 zeigt exemplarisch den prinzipiellen Aufbau eines Einstrahlfluorimeters. Die Lichtquelle (A) emittiert ein Anregungslicht, welches im Bereich des Absorptionsmaximums der Probe liegen sollte. Der Anregungsmonochromator (B) lässt hiervon nur ausgewählte Wellenlängen passieren, sodass die Probe (C) angeregt wird und Fluoreszenzlicht emittiert, welches den Emissionsmonochromator (F), der senkrecht zur Probe steht, passieren muss, um vom Emissionsdetektor (G) registriert zu werden. Hinter der Probe kann sich noch ein Absorptionsmonochromator (D) befinden, falls ein Absorptionsdetektor (E) ein Absorptionsspektrum aufzeichnen soll.
Lichtquelle
Die Lichtquelle emittiert das Anregungslicht, weshalb ihre Emissionswellenlänge im Bereich des Absorptionsmaximums der zu untersuchenden Substanz liegen sollte, sofern dieses bekannt ist. Da die Stärke der Fluoreszenz proportional zur Strahlungsintensität dieser Lichtquelle ist, sollte sie über eine konstante Strahlungsintensität verfügen, um Fluoreszenzschwankungen zu vermeiden. Quecksilberdampfleuchten besitzen den Vorteil einer hohen Strahlungsintensität, sind aber auf ein geringes Spektrum an Wellenlängen beschränkt. 11 Bei Xenonlampen dagegen handelt es sich zwar oft ebenfalls um Linienstrahler, jedoch verschmelzen ihre Spektrallinien durch Druckverbreiterung und Zusatzstoffe zu einem Kontinuum, welches aber nur eine geringe Intensität aufweist. Ein bekanntes Beispiel sind Kfz-Xenonleuchten. 12 Als Kompromiss werden deshalb oft Quecksilber-Xenonlampen eingesetzt, die die Eigenschaften beider Lampentypen vereinen. Prinzipiell wäre auch die Nutzung von Laserlicht möglich, welches zwar eine hohe Intensität besitzt, aber durch den kleinen Wellenlängenbereich nur bei Spezialfällen in der Analytik eingesetzt wird. 13
Monochromatoren
Monochromatoren werden eingesetzt, wenn isolierte Wellenlängen eines Lichtstrahls genutzt werden sollen. 14 Der Anregungsmonochromator dient der Umformung des polychromatischen Anregungslichtes zu monochromatischem Licht, welches dann auf die zu untersuchende Probe einwirkt. Liegt der so erzeugte Teilbereich des Emissionsspektrums innerhalb des Absorptionsspektrums der Probe, erfolgt eine Anregung der Molekülelektronen, welche zu einer Emission von Fluoreszenzlicht führen kann. Der Emissionsmonochromator eliminiert Streulicht der Anregungswellenlänge und beschränkt den Durchlass zum Emissionsdetektor auf jeweils ausgewählte Wellenlängen, um analysieren zu können, welche Wellenlänge als Fluoreszenzlicht emittiert wurde. Soll auch ein Absorptionsspektrum aufgenommen werden, sorgt ein Absorptionsmonochromator dafür, dass nur die Transmission der Anregungswellenlänge den Absorptionsdetektor erreicht, während die Fluoreszenzstrahlung von ihm blockiert wird.
Detektoren
Als Detektoren werden Photomultiplierröhren eingesetzt. 15 Diese sind im Bereich des UV-Spektrums und im kurzwelligen Bereich des sichtbaren Lichts Photodioden überlegen, da sie durch ihren speziellen elektronischen Aufbau in der Lage sind, sogar den Einfall einzelner Photonen in ein dezidiertes elektronisches Signal umzuwandeln und der Auswertung zuzuführen. Dieser als "photon counting mode" bezeichneter Effekt ist insbesondere bei geringen Lichtintensitäten sinnvoll und nützlich. Hierbei liegt die Zeitauflösung unterhalb von 200 ps. Der Emissionsdetektor ist senkrecht zum Strahlengang angeordnet, damit das detektierte Signal nicht durch Streulicht der Lichtquelle gestört werden kann.
Durchführung von Messungen in der Fluorimetrie
Qualtitative Methoden
Da zwischen den aufgenommenen Spektren und den Strukturen der zu untersuchenden Proben nur selten ein direkter Zusammenhang besteht und die resultierenden Spektren stark von spezifischen Geräteparametern abhängen, findet die Fluorimetrie als qualitative Methode nur selten Verwendung.
Quantitative Methoden
Nur wenige der Substanzen, die in der analytischen Chemie fluorimetrisch untersucht werden, verfügen von sich aus über jene Strukturen, die ihnen den Effekt der Fluoreszenz unter beschriebenen Bedingungen ermöglichen und die als Fluorophore bezeichnet werden. 16 Daher ist es oft nötig, die zu untersuchenden Substanzen z. B. durch die Zugabe von Komplexbildnern zur Fluoreszenz zu befähigen, worunter natürlich die Spezifität der Methode leiden kann, weil die Komplexbildner oft nicht nur exklusiv an eine Substanz binden. Zur Komplexierung von Kationen können Morin, Quercetin, Flavonol oder 8-Hydroxychinolin verwendet werden. So kann Aluminium neben der bekannten Fällungsreaktion 17 auch als fluoreszierender Morin-Komplex nachgewiesen werden. 18 Der gelb-grüne Komplex fluoresziert unter UV-Licht recht stark. Da Morin aber auch mit anderen Substanzen wie Blei oder Zinn Komplexe bildet, die zur Fluoreszenz befähigt sind, sind manchmal weitere Nachweise zur Eingrenzung der Substanz nötig. Die Fluoreszenz des Aluminiumkomplexes wäre beispielsweise in Eisessig beständig, bei starkem Ansäuern mit halbkonzentrierter Salzsäure dagegen nicht. 19 Andererseits ist der Nachweis von Aluminiumkationen mittels Komplexierung mit 8-Hydroxychinolin so sensitiv, dass die Bestimmungsgrenze bei 20 ppb liegt.
Die vergleichsweise hohe Sensitivität bezüglich vieler Substanzen ist einer der großen Vorzüge der quantitativen Fluorimetrie. Trotzdem sollten mögliche Fehlerquellen der Methode immer berücksichtigt werden. Hierzu gehört insbesondere das Auftreten nicht genau einzugrenzender Effekte auf die Quantenausbeute. Zu dieser verhält sich das Fluoreszenzsignal, wie bereits oben geschildert, ebenfalls proportional, weshalb Störeinflüsse hier das Ergebnis verfälschen können. Der Einsatz von Vergleichslösungen steigert zwar den Aufwand, ermöglicht dafür aber in vielen Anwendungsbereichen einen sinnvollen quantitativen Einsatz der Methode.
Probenvorbereitung
Bei Messungen und der Probenvorbereitung in der Fluorimetrie ist darauf zu achten, dass ein sehr reines Lösungsmittel verwendet wird und keine fluoreszierenden Verunreinigungen vorliegen. Ebenso sollte das Lösungsmittel photostabil sein und keine Eigenabsorption oder Eigenfluoreszenz aufweisen. Parallel zu den Messungen sollte immer ein Blindwert mit dem verwendeten Lösungsmittel aufgenommen werden, um Hintergrundrauschen durch das Lösungsmittel zu vermeiden. Moderne Zweistrahlgeräte können, durch abwechselnde Messung, das Signal des Blindwertes automatisch verrechnen, man bezeichnet dies umgangssprachlich als "Blanken". Bei jeder Durchführung muss geprüft werden, ob sich gelöster Sauerstoff in der Küvette befindet, da dieser eine Fluoreszenzauslöschung verursachen könnte. Falls in der Lösung also Luftblasen vorliegen sollten, sollte man diese entweder mit der Pipettenspitze oder durch vorsichtiges Klopfen versuchen zu beseitigen. Alternativ kann mit einem geringen Volumen der Probenlösung kurz durchgespült werden. Auch eine gezielte Entgasung der verwendeten Flüssigkeiten kann sinnvoll sein. Da die Fähigkeit zur Fluoreszenz vom pH-Wert abhängen kann, dürfen Lösungsmittel nicht den pH-Wert verschieben. Wenn diese Anforderungen erfüllt sind, wird die Küvette zu etwa ¾ mit Probenlösung befüllt und in den Probenraum des Messgerätes gestellt. Bei den Messungen ist darauf zu achten, dass die Küvette jedes Mal gleich ausgerichtet ist, da es sonst zu Messfehlern kommen könnte.
Mögliche Fehlerquellen
Wie in Kapitel 1.3.4. beschrieben, kann die Fluoreszenzfähigkeit eines Moleküls vom pH-Wert abhängen. Auch andere Umwelteinflüsse beeinflussen die Fluoreszenz. Daher sind die Versuchsbedingungen während der Probenbestimmung möglichst konstant zu halten.
Eine Fehlerquelle sind zum Beispiel die Quencheffekte, auch Quenching genannt, welche zu einer Verringerung der Quantenausbeute führen. Diese treten auf, wenn die angeregte, fluoreszierende Verbindung mit nicht angeregten Molekülen derselben Lösung oder einem Fremdstoff wechselwirken bzw. reagieren. Dadurch kommt es zu einer sogenannten Fluoreszenzlöschung, also einer Abnahme der Fluoreszenzintensität. Auslösende Substanzen wären zum Beispiel: gelöster Sauerstoff (oxidierende Wirkung und somit Zerstörung des Fluorophors), polare Lösungsmittel und Matrixbestandteile. Eine weitere Fehlerquelle wäre zum Beispiel eine zu hohe Analysenkonzentration, da diese zu einer Eigenabsorption führen könnte. Dies liegt daran, dass dann keine Linearität von Fluoreszenz und Konzentration vorliegen würde. Eigenabsorptionen können auch auftreten, wenn die Lösungsmittel die Reinheitsanforderungen nicht erfüllen. Viele Fehlerquellen sind auch auf spektrale Verschiebungen und Änderungen in der Fluoreszenzausbeute zurückzuführen. Diese werden meist ausgelöst durch eine pH-Wert Änderung, treten aber auch vermehrt in polaren Lösungsmitteln auf. Aufgrund des veränderten Protonierungszustandes führt dies dann zu einem unterschiedlichen Fluoreszenzverhalten. Die Messung wird auch oftmals durch den Raman-Effekt gestört. Bei diesem kommt es nach der Absorption des Photons nicht zu einer Emission eines kleineren oder gleichen Photon (Resonanzphänomen). Es handelt sich hierbei nicht um ein sogenanntes Resonanzphänomen, da es zu einer Streuung über virtuelle Niveaus kommt, die auch bei Photonen, welche nicht resonant sind, auftritt. Virtuelle Niveaus, sind Energieniveaus eines Moleküls, welche nicht real vorliegen.20 Man sollte während der Messung auch keine großen Pausen einlegen, sondern versuchen eine laufende Kalibrierung durchzuführen und währenddessen den Strahlenfluss, sowie den Detektor überprüfen.
Beispiele für die Auswertung von fluorimetrischen Substanzanalysen
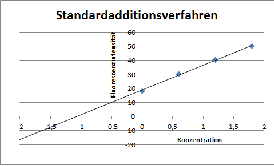
Abb. 4: Beispiel für die graphische Auswertung beim Standardadditionsverfahren. Der Schnittpunkt der Geraden mit der X-Achse gibt den Betrag der Konzentration der unbekannten Probe an.
Moderne Fluorimeter können heute über einen angeschlossenen Computer die ermittelten Messwerte direkt auswerten und statistisch verarbeiten. Nutzt man klassische Fluorimeter um eine quantitative Bestimmung einer Substanz durchzuführen, erfolgt dies oft über den direkten Vergleich mit Messwerten von Verdünnungen bekannter Konzentrationen der Reinsubstanz, weil tabellarische Wertetabellen oft nicht vorliegen, da Fluorimeter untereinander nur bedingt vergleichbar sind. Da die Intensität der Fluoreszenz (Kapitel 1.3.1.) u.a. von der Konzentration der untersuchten Substanz abhängt, kann die relative Fluoreszenzintensität gegen die Konzentration der Proben aufgetragen werden. Hierbei wird vorausgesetzt, dass die Untersuchung sich innerhalb jenes Bereiches bewegt, in dem ein linearer Zusammenhang zwischen Fluoreszenz und Konzentration besteht. Die Auswertung kann dann rechnerisch oder graphisch erfolgen. Neben der bekannten klassischen Kalibrierung, bei der Proben mit bekannter Konzentration die Erstellung einer Eichgerade ermöglichen, kann die Bestimmung auch über das Standardadditionsverfahren erfolgen. 21 Hierbei werden einem gleichbleibendem Volumen der gelösten Substanz, deren Konzentration bestimmt werden soll, steigende Konzentrationen bekannten Ausmaßes der Reinsubstanz beigemengt und dann im Fluorimeter vermessen. Es müssen anschließend noch die, für die Blindprobe ermittelten Fluoreszenzintensitäten verrechnet werden. Hierzu kann beispielsweise das Fluorophor der Substanz zerstört werden, um nur noch die Hintergrundfluoreszenz zu messen. Für die zu untersuchende unbekannte Probe wird der Konzentrationswert auf null gesetzt, sodass der zugehörige Messpunkt auf der y-Achse liegt. Der Schnittpunkt der Geraden durch die so erhaltenen Messpunkte bei der Auftragung der Fluoreszenzintensität gegen die Konzentration mit der X-Achse ergibt den Betrag der Konzentration der unbekannten Probe. Nachteil der Standardadditionsmethode ist, dass die Zugabe steigender Konzentrationen an Reinsubstanz dazu führen kann, dass der lineare Messbereich verlassen wird.
Einzelnachweise
1 https://de.wikipedia.org/w/index.php?title=Jab%C5%82o%C5%84ski-Schema&oldid=211059271 abgerufen aus der deutschen Wikipedia am 03.05.2021 ⇑
2 https://de.wikipedia.org/wiki/Fluoreszenzspektroskopie abgerufen am 03.06.2021 ⇑
3 https://www.univie.ac.at/mikroskopie/3_fluoreszenz/definition/1_einleitung.htm abgerufen aus dem Österreichischen univie.at am 03.06.2021 ⇑
4 https://de.wikipedia.org/w/index.php?title=Fluorescein&oldid=209910172 abgerufen aus der deutschen Wikipedia am 13.05.2021 ⇑
5 https://www.chemie.de/lexikon/Fluorescein.html abgerufen am 03.06.2021 ⇑
6 https://www.pharmazeutische-zeitung.de/ausgabe-122010/lebensrettende-prophylaxe-und-therapie/ abgerufen am 05.06.2021 ⇑
7 https://de.wikipedia.org/w/index.php?title=Chinin&oldid=212182199 abgerufen aus der deutschen Wikipedia am 05.06.2021 ⇑
8 https://de.wikipedia.org/w/index.php?title=Katzenhaie&oldid=193754787 abgerufen aus der deutschen Wikipedia am 08.05.2021 ⇑
9 https://de.wikipedia.org/w/index.php?title=Gr%C3%BCn_fluoreszierendes_Protein&oldid=210342827 abgerufen aus der deutschen Wikipedia am 08.05.2021 ⇑
10 https://de.wikipedia.org/w/index.php?title=Leuchtk%C3%A4fer&oldid=209519486 abgerufen aus der deutschen Wikipedia am 08.05.2021 ⇑
11 https://de.wikipedia.org/w/index.php?title=Quecksilber&oldid=211474095 abgerufen aus der deutschen Wikipedia am 06.06.2021 ⇑
12 https://de.wikipedia.org/w/index.php?title=Xenonlicht&oldid=207115235 abgerufen aus der deutschen Wikipedia am 08.05.2021 ⇑
13 https://de.wikipedia.org/w/index.php?title=Laser&oldid=210587600 abgerufen aus der deutschen Wikipedia am 08.05.2021 ⇑
14 https://de.wikipedia.org/w/index.php?title=Monochromator&oldid=197137440 abgerufen aus der deutschen Wikipedia am 06.06.2021 ⇑
15 https://de.wikipedia.org/w/index.php?title=Photomultiplier&oldid=207984454 abgerufen aus der deutschen Wikipedia am 08.05.21 ⇑
16 https://de.wikipedia.org/w/index.php?title=Fluoreszenz&oldid=206285800 abgerufen aus der deutschen Wikipedia am 09.05.2021 ⇑
17 https://de.wikipedia.org/w/index.php?title=Aluminiumhydroxid&oldid=210001897 abgerufen aus der deutschen Wikipedia am 09.05.2021 ⇑
18 https://de.wikipedia.org/w/index.php?title=Morin_(Farbstoff)&oldid=199960732 abgerufen aus der deutschen Wikipedia am 09.05.21 ⇑
19 https://de.wikipedia.org/w/index.php?title=Liste_von_Nachweisreaktionen&oldid=190432297 abgerufen aus der deutschen Wikipedia am 09.05.2021 1 ⇑
20 https://de.wikipedia.org/wiki/Raman-Streuung#Unterschiede_zur_Fluoreszenz abgerufen aus der deutschen Wikipedia am 06.06.2021 ⇑
21 http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/3/anc/croma/kalibrierung.vlu/Page/vsc/de/ch/3/anc/croma/datenauswertung/quantitativ/standardaddition/standardadditionm80ht0801.vscml.html Abgerufen bei Chemgapedia am 09.05.2021 ⇑
Weiterführende Literatur: Rücker, Neugebauer, Willems, Instrumentelle pharmazeutische Analytik, 5. Auflage
Monographie-Follitropin (Prüfung auf Identität E, Methode A, Detektion)
Stoffcharakterisierung (Wirkung und Anwendung)
Bei Follitropin handelt es sich um das bekannte FSH (Follikelstimulierendes Hormon). Es ist ein heterodimeres Protein und besteht aus einer alpha- und einer beta-Untereinheit. Die 92 Aminosäuren lange alpha-Untereinheit ist dabei jedoch unspezifisch, da sie auch in den anderen Hormonen (LH, TSH und GC) vorkommt. Die Beta-Einheit ist spezifisch für das FSH und besteht aus 111 Aminosäuren. Beide Untereinheiten haben jeweils zwei N-Glycane und diverse Disulfidbrückenbindungen. Durch die N-Glycane, lange Zuckerketten, handelt es sich um ein sogenanntes Glykoprotein. 1 Schüttet der Hypothalamus GnRH (Gonadotropin-Releasing-Hormon) aus, so produziert der Hypophysenvorderlappen, die Adenohypophyse, die glandotropen Hormone LH (luteinisierendes Hormon) und eben FSH. Diese sind beteiligt an der Spermatogenese bzw. der Reifung der Eizelle. 2
FSH kann auf zweierlei Weisen gewonnen werden: Entweder aus menschlichem Urin (Urofollitropin)3 oder durch genetisch veränderte CHO-Zellen (immortalisierte Zelllinien aus den Eierstöcken des chinesischen Zwerghamsters), das sogenannte Follitropin alfa bzw. beta. Hierauf bezieht sich auch der Arzneibucheintrag.4 Follitropin alfa wird vor allem bei in-vitro-Fertilisationen angewandt. Dabei wird zunächst die Bildung von Eizellen durch GnRH-Antagonisten gehemmt, um dann durch die Gabe von Follitropin mehrere Eizellen zu gewinnen. Diese können dann entnommen werden und nach künstlicher Befruchtung wieder injiziert werden. 5 Außerdem findet Follitropin alfa Anwendung bei Menstruationsstörungen, Unfruchtbarkeit und Fehlfunktion der Keimdrüsen.6 Die Applikation erfolgt subkutan mittels Injektionspen, weil die Menge Follitropin pro Anwendung im µg-Bereich liegt. Da FSH in einem untergeordnetem Ausmaß die Gallenblase, das Herz und die Speiseröhre beeinflusst, zählen zu den häufigen Nebenwirkungen Kopfschmerzen, Gefäßerkrankungen und gastrointestinale Störungen. Bei Frauen sind Zysten im Eierstock möglich oder es kann ein sogenanntes ovarielles Überstimulationssyndrom auftreten, welches von Spannungsgefühlen, Unwohlsein und in selteneren Fällen Erbrechen, Atemnot und Flüssigkeitsaustritt in den Bauchraum geprägt ist. Akne, Gewichtszunahme und die Vergrößerung der Brustdrüsen (Gynäkomastie) sind Nebenwirkungen die beim Mann auftreten können.7
Durchführung der Monographie
Wie bereits erwähnt, handelt es sich bei Follitropin um ein Glykoprotein mit mehreren Glycanresten und Disulfidbrücken. 500µg einer Zubereitung und einer Referenzlösung werden zunächst in Phosphat-Pufferlösung pH7,5 gelöst. Folgend wird der Analyse Natriumdodecylsulfat hinzugegeben, welches zunächst die Tertiärstruktur des Proteins zerstört.8 Danach wird die Lösung mit 2-Mercaptoethanol versetzt, wodurch die Disulfidbrücken durch Reduzierung der Schwefelatome zerstört werden.9 Anschließend wird Octylphenylpolyethylenglycol zur Reinigung des Proteins hinzugefügt. 10 Daraufhin wird die Probe auf einem Reagenzglasschüttler homogenisiert. Die Probe wird mit Peptid-N-Glycosidase F versetzt, auf dem Reagenzglasschüttler durchmischt, zentrifugiert und bei 37°C inkubiert. Dies bewirkt die Abspaltung der N-Glykane mit Ausnahme der mit einer α-1,3-verknüpften Fucose von dem denaturierten Protein durch Hydrolyse der N-glycosidischen Bindung zwischen Asparaginsäure und N-Acetylglucosamin 11. Zum Entfernen der Proteinfraktion wird die Mischung mit 600 μl, auf -20°C gekühlten, wasserfreien Ethanol R versetzt, im Vortex Mixer gemischt und zentrifugiert. Nach 15 Minuten wird die Mischung erneut 5 Minuten lang bei 4 °C und 10 600 g zentrifugiert. Danach wird das Zentrifugat in ein separates Gefäß befördert, wobei das Ethanol 15 Minuten eingedampft wird. Nach Zugabe von 1mL partikelfreiem Wasser wird die Probe weiterhin auf ein Volumen von 500 bis 800 μl eingedampft und anschließend gefriergetrocknet.12 Die Markierung der Glycane erfolgt über 2-Aminobenzamid, indem die Aminogruppe an den Carbonylkohlenstoff des Glycans bindet (reduktive Aminierung). Dieser Schritt ist notwendig, da Glykane keine eigenen Fluorophore besitzen, die für eine Detektion und Quantifizierung mittels Fluorimetrie nötig sind. 13 Die markierten Glycane werden über einen schwachen Anionenaustauscher als stationäre Phase mit einem Acetonitril-Acetat-Puffer als mobile Phase unter steigender Ionenstärke eluiert. Die Sialylreste (ein bestimmter Zucker am Ende der Ketten) sind maßgeblich für die Elutionsreihenfolge, da durch die daraus resultierenden negativen Ladungen die Affinität zur stationären Phase steigt. So passieren die neutralen Glycane am schnellsten die Säule, darauf folgen die negativ geladenen Mono-, Di-, Tri- und Tetrasialoglycane in Gruppen. 14
Auswertung/ Interpretation/ Bedeutung und Eignung der analytischen Methode
Die Detektion erfolgt fluorimetrisch mit einem Anregungslicht von λ=330nm. Emittiert wird die energieärmere Strahlung mit einer Wellenlänge von λ=420nm, da ein Teil der Energie durch Rotation und Schwingung in Form von Wärme abgegeben wird. Die einzelnen Peaks bilden die Glycangruppen mit aufsteigender Zahl der Sialylreste ab.
Daraufhin wird mit der Formel Z=(A0*0)+(A1*1)+(A2*2)+(A3*3)+(A4*4) die Z-Zahl ermittelt, wobei A den prozentualen Anteil der Peakfläche der Glycangruppen mit 0-4 Siaylresten beträgt. Diese soll einen Wert von 177 bis 233 aufweisen und gibt Aufschluss über die charakteristische Zusammensetzung des Proteins. Diese Methode ist hochspezifisch, da mit ihr nicht nur Follitropin von anderen Hormonen und Proteinen unterschieden werden kann, sondern auch identifiziert werden kann wie das Follitropin gewonnen wurde. So hat Follitropin alfa eine mittlere Z-Zahl von 195, Follitropin beta von 206 und aus Urin gewonnenes natürliches Follitropin, das Urofollitropin, eine mittlere Z-Zahl von 257. 15 Da die Floureszensintensität von der Bestrahlungsintensität abhängt, ist die Nachweisgrenze sehr niedrig, weswegen die Arzneibuchmethode gut geeignet ist Follitropin, welches in µg Mengen in Arzneimitteln vorliegt, nach zu weisen.
Einzelnachweise
1 https://www.uniprot.org/uniprot/P01225 und https://www.uniprot.org/uniprot/P01215 abgerufen am 27.05.2021 1 ⇑
2 https://de.wikipedia.org/wiki/Hypothalamus#Hormone_des_Hypothalamus und https://de.wikipedia.org/wiki/Follikelstimulierendes_Hormon abgerufen am 27.05.2021 2 ⇑
3 https://pubchem.ncbi.nlm.nih.gov/compound/62819 abgerufen am 30.05.2021 3 ⇑
4 https://compendium.ch/product/1179382-gonal-f-pen-inj-los-300-e-0-5ml abgerufen am 30.05.2021 und Arzneibuchmonographie Follitropin 10.0/2285 4 ⇑
5 https://www.primomedico.com/de/behandlung/in-vitro-fertilisation/ abgerufen am 30.05.2021 5 ⇑
6 https://www.gelbe-liste.de/wirkstoffe/Follitropin-alfa_22300 und https://flexikon.doccheck.com/de/Follitropin_alfa abgerufen am 30.05.2021 6 ⇑
7 https://www.ncbi.nlm.nih.gov/gene?linkname=pcsubstance_gene&from_uid=17398105 , https://de.wikipedia.org/wiki/Ovarielles_%C3%9Cberstimulationssyndrom abgerufen am 31.05.2021 und Kommentar zur Ph. Eur. 9.6/2285 7 ⇑
8 https://de.wikipedia.org/wiki/Natriumlaurylsulfat abgerufen am 30.05.2021 7 ⇑
9 https://de.wikipedia.org/wiki/Mercaptoethanol abgerufen am 30.05.2021 8 ⇑
10 https://de.wikipedia.org/wiki/Octoxinol_9 abgerufen am 30.05.2021 9 ⇑
11 https://en.wikipedia.org/wiki/PNGase_F abgerufen am 31.05.2021 10 ⇑
12 Kommentar zur Ph. Eur. 9.6/2285 11 ⇑
13 https://analyticalscience.wiley.com/do/10.1002/gitfach.19122/full/ abgerufen am 05.06.2021 12 ⇑
14 http://apps.thermoscientific.com/media/cmd/GrundlagenIonenchromatographie.pdf?src=bTxt&elqtrack=true abgerufen am 04.06.2021 12 ⇑
15 Kommentar zur Ph. Eur. 9.6/2285 15 ⇑
TU-Braunschweig Institut für Medizinische und Pharmazeutische Chemie Seminar: Instrumentelle Analytik Kontakt: tubs@t-kellner.de

