HPTLC
Expertenbericht zum Praktikumsversuch
HPTLC
WiSe 2021/2022
Abgabedatum
15.12.2021
Expertengruppe 05
Mia Piccinno
Bianca Moritz
Timo Schaffeld
Trennung von Sulfonamiden (HPTLC)
Inhaltsverzeichnis
Einleitung
Die HPTLC (High-performance thinlayer chromatography) ist eine weiterentwickelte Methode der Dünnschichtchromatographie (DC) 1. Mit ihr können einzelne Komponenten aus einem Substanzgemisch getrennt und so identifiziert werden. Im europäischen Arzneibuch wird sie als Methode "für die qualitative Analyse von pflanzlichen Drogen und Zubereitungen aus pflanzlichen Drogen" 2 beschrieben. Die Trennung und Identifizierung des Substanzgemisches erfolgt, wie bei der Dünnschichtchromatographie, auf Grundlage von Wechselwirkungen der Probensubstanz mit einer stationären und einer mobilen Phase.
Versuchsbeschreibung
Bei diesem Praktikumsversuch sollen mittels der HPTLC-Methode drei Sulfonamide aus einem Substanzgemisch identifiziert werden. Dazu wird die Probe mit sechs Vergleichssubstanzen verglichen. Diese Sulfonamide sind in vier Gruppen eingeteilt (siehe Tabelle 1), wovon jeweils eine als Referenz hinzugezogen wird. Bei der HPTLC wird, verglichen mit der DC, ein stärkeres Trennmaterial (stationäre Phase) mit einer wesentlich kleineren Korngröße von ca. 6 µm angewendet 3 (vgl. DC: ca. 15 µm 4). Dies führt zu einer Oberflächenvergrößerung der stationären Phase und somit zu einer besseren Trennleistung 5. Durch die horizontale Lage der HPTLC-Platte und den Einfluss der Schwerkraft "beträgt die Entwicklungszeit oft nur die Hälfte oder gar nur ein Drittel der Zeit, die man für die Entwicklung der DC benötigen würde" 6. Außerdem hat diese Methode einen geringeren Fließmittel- und Analysensubstanzverbrauch, wodurch sie, besonders im großen Maßstab, kostengünstiger ist 7.
Sulfonamide
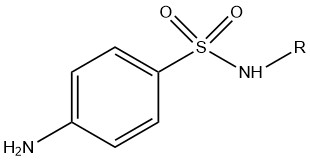
Sulfonamide (Abb. 1) haben eine antimikrobielle Wirkung und finden daher teils Gebrauch als Antibiotika. In Bakterien hemmen sie die Tetrahydrofolsäuresynthese und damit die Synthese der bakteriellen DNA. 8 Sie gehören demnach zu den Bakteriostatika.
Tabelle 1: Gruppen der Vergleichssubstanzen
Gruppe I Gruppe II Gruppe III Gruppe IV
Sulfisomidin Sulfisomidin Sulfaguanidin Sulfaguanidin Sulfathiazol Sulfathiazol Sulfisomidin Sulfisomidin Sulfacetamid Sulfacetamid Sulfacarbamid Sulfacarbamid Sulfadimidin Sulfanilamid Sulfadimidin Sulfanilamid Sulfadimethoxin Sulfisoxazol Sulfadimethoxin Sulfadimethoxin Sulfamethoxazol Sulfamethoxazol Sulfamethoxazol Sulfamethoxazol
Instrumenteller Aufbau

Abb. 3: Entwicklungskammer: 1) Hier wird die HPTLC-Platte angelegt 2) Frittenstäbchen 3) Fließmittelkammer 11.
Verwendet werden eine HPTLC-Platte (5x5 cm, hier Kieselgel (stationäre Phase) 60 GF254 (Merck)), eine Schablone zum Einzeichnen der Auftragspunkte der Substanzen (Abb. 4), Kapillarröhrchen und Uhrgläser zum Auftragen, eine Entwicklungskammer mit Frittenstäbchen (Abb. 3) und eine Deckscheibe sowie Pipetten zum Einfügen des Fließmittels. Als Fließmittel (mobile Phase) werden Ethylacetat und ein Gemisch aus 7,5 Teilen Ethylacetat und 2,5 Teilen n-Hexan eingesetzt. Der gesamte Versuch wird unter dem Abzug durchgeführt.
Die Entwicklungskammer (Abb. 3) liegt horizontal und besteht aus einer Fließmittelkammer, dem Frittenstäbchen und einem Fach für die HPTLC-Platte. Die Platte selbst besteht aus Kieselgel als stationäre Phase und einer Glasscheibe als Untergrund, durch die während der Entwicklung die Fließmittelfront beobachtet werden kann. Das Frittenstäbchen wird in die dafür vorgesehende Aussparung (Abb. 3) platziert. Es saugt hier das Fließmittel auf, welches dann mithilfe der Kapillarkräfte gleichmäßig über die HPTLC-Platte fließt 12.
Mit der Deckscheibe wird während der Entwicklung die Kammer verschlossen (Abb. 7), um die Verdunstung des Fließmittels während der Entwicklung zu vermeiden und dessen Sättigung möglichst hoch zu halten 13.
Alternativ zu dem hier verwendeten Kieselgel als polare stationäre Phase kann auch eine Umkehrphase (Reversed-Phase) verwendet werden. Diese besteht aus einem modifizierten Kieselgel, das "durch die Umsetzung [...] mit bestimmten Silanen (Organohalogensilane)" 14 hydrophobe, unpolare Eigenschaften bekommt. Im Arzneibuch kommen besonders RP-18 Platten, die mit Octadecylsilanen modifiziert sind, zum Einsatz. Diese spielen auch außerhalb des Arzneibuchs die wichtigste Rolle unter den Reversed-Phase Platten. 15
Durchführung
Als erstes müssen die Referenzlösungen (VS) hergestellt werden. Dafür wird eine Spatelspitze der verschiedenen Substanzen in die Braunglasflaschen (Abb. 2) gegeben, mit Aceton bis zum Flaschenhals aufgefüllt und gelöst. Dabei ist zu beachten, dass die Lösung mit Sulfacarbamid wöchentlich neu hergestellt werden muss, da es instabil ist.
Die HPTLC-Platte wird in die Schablone (Abb. 4) eingesetzt und die Startpunkte der aufzutragenden Substanzen mit einem Bleistift markiert. Beim Auftragen der Substanzen ist es wichtig, sich an die vorgegebene Reihenfolge (siehe Tabelle 2) zu halten, damit es später bei der Auswertung nicht zu Verwechslungen kommt.
Tabelle 2: Auftragschema
VS-1 Probe VS-2 VS-3 Probe VS-4 VS-5 Probe VS-6
Zum Auftragen der Vergleichssubstanzen (VS) werden die beiliegenden Kapillarröhrchen eingesetzt. Dazu wird je ein Teil der entsprechenden Vergleichslösung auf ein Uhrglas gegeben und mit einer Kapillare aufgenommen. Dafür wird die Kapillare in die Flüssigkeit getaucht und daraufhin das obere Ende zugehalten. Dadurch entsteht ein Unterdruck, der die Flüssigkeit auch nach Verlassen des Uhrglases im Röhrchen hält. Jetzt kann die Kapillare auf den jeweiligen markierten Startpunkt der Substanz gedrückt und der Finger gelöst werden, sodass die Flüssigkeit auf die Platte übertragen wird. Da die Kapillaren und auch die HPTLC-Platten sehr empfindlich sind, ist hierbei darauf zu achten, dass die Kapillaren nicht zu stark auf die Platte gedrückt werden. Dennoch muss der Druck so stark sein, dass sich die Kapillare entleert. Es ist notwendig, auf jeden Punkt ungefähr gleich viel Substanz zu geben, damit die Substanzflecken bei der Auswertung besser vergleichbar sind.
Um die Probensubstanz auf die HPTLC-Platte aufzutragen, wird die Ecke einer Spatelspitze auf ein Uhrglas gegeben und mit einigen Tropfen Aceton gelöst. Sollte sich die Substanz nicht vollständig lösen, kann mit einem Kapillarröhrchen vorsichtig auf dem Uhrglas im Aceton gerührt werden. Da Aceton stark flüchtig ist, sollte zügig gearbeitet und die Flüssigkeit auf die Startposition der Probesubstanz aufgetragen werden. Für den Fall, dass das Auftragen der Probensubstanz wiederholt werden muss, reicht es aus, wenn wieder etwas Aceton auf das Uhrglas gegeben wird und der Rest der darauf zurückgebliebenen Substanz gelöst wird.
Nachdem alle Substanzen auf die HPTLC-Platte aufgetragen wurden, wird die Platte vor der Entwicklung unter UV-Licht bei 254 nm kontrolliert (Abb. 5). Sollten einige Flecken nur schwach oder gar nicht zu sehen sein, muss noch etwas Substanz nachgetragen werden.
Die erste Entwicklung wird mit einem Gemisch aus 7,5 Teilen Ethylacetat und 2,5 Teilen n-Hexan als Fließmittel durchgeführt. Dafür wird das Fließmittel in die Fließmittelkammer (Abb. 3) am unteren Ende der Entwicklungskammer gegeben (Abb. 6). Hier muss darauf geachtet werden, dass die Kammer nur bis kurz unter den Rand gefüllt wird, damit die Flüssigkeit nicht direkt mit der Platte in Kontakt kommt. Nachdem das Fließmittel eingefüllt wurde, wird die HPTLC-Platte mit der Glasseite nach oben langsam und gleichmäßig in die Kammer eingelegt. Dabei ist es von Vorteil, wenn die Platte am oberen Ende angelegt und mit zwei Fingern an der Seite langsam auf das Frittenstäbchen abgesenkt wird. So können eine schiefe Fließmittelfront und somit ungenaue Rf-Werte vermieden werden. Besonders wichtig ist, dass die Platte am oberen Rand der Kammer komplett abschließt (Abb. 3), damit die Substanzen mit dem Fließmittel mitlaufen können.
Sobald die Platte in der Kammer liegt, wird diese zügig mit der Deckscheibe verschlossen (Abb. 7) und solange gewartet, bis sich die Platte entwickelt hat.
Die Platte ist fertig entwickelt, wenn die Fließmittelfront ca. 5 mm vor dem Ende der Platte angekommen ist. Dann wird die Deckscheibe entfernt und die Platte vorsichtig herausgenommen. Um später den Rf-Wert bestimmen zu können, wird die Fließmittelfront mit einem Bleistift eingezeichnet, solange sie noch sichtbar ist. Es ist notwendig, die Platte kurz unter dem Abzug trocknen zu lassen, damit das überschüssige Lösemittel verdampfen kann.
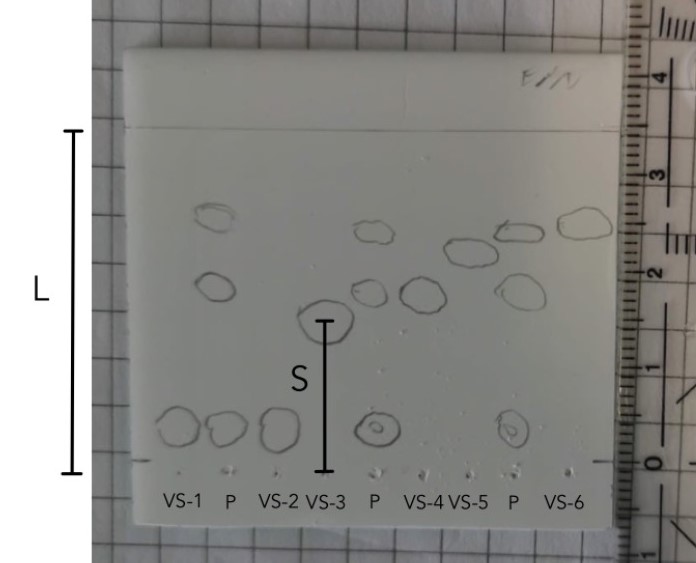
Zur Auswertung wird die Platte wieder unter das UV-Licht bei 254 nm gelegt und die Substanzflecken mit einem Bleistift umrandet (Abb. 8). Sofern bei der ersten Entwicklung nicht bei jedem Probensubstanzfleck eine eindeutige Zuordnung zu einer Vergleichssubstanz stattfinden kann, wird dieselbe Platte ein zweites Mal entwickelt. Dieses Mal allerdings mit reinem Ethylacetat als polareres Fließmittel. Der Vorgang bleibt wie oben beschrieben bestehen. Dabei ist es zu empfehlen, sich die Ergebnisse der ersten Entwicklung abzufotografieren und bestenfalls direkt die Rf-Werte aufzuschreiben, um bei der Auswertung darauf zurückgreifen zu können. Eventuell können hier schon einzelne Substanzen zugeordnet werden. Die Substanzflecken der weiteren Entwicklungen können zur besseren Unterscheidung von den Vorherigen schraffiert werden.
Fehlerquellen
- Tritt eine Schwanzbildung auf, kann dies seine Ursache darin haben, dass zu viel Substanz aufgetragen wurde 20.
- Wenn die Platte mit der Glasseite nach unten eingelegt wurde, kann das Fließmittel die Platte nicht erreichen.
- Wurde die HPTLC-Platte schräg in die Kammer eingelegt, zieht sich das Fließmittel nicht gleichmäßig über die Platte und die Substanzflecken lassen sich nicht richtig zuordnen.
- Sollten die Substanzflecken zu wenig laufen oder gar am Startpunkt verbleiben:
- Sollten die Substanzflecken zu weit laufen, kann die Polarität des Fließmittels erniedrigt werden, indem der Anteil von n-Hexan (unpolarer) erhöht wird 22.
Zumischmethode
Für den Fall, dass sich ein Substanzfleck nicht eindeutig zuordnen lässt, kann die Zumischmethode verwendet werden. Dabei wird etwas von der Probe und ein Teil der vermuteten Vergleichssubstanz zusammen auf einem Uhrglas gemischt und anschließend wie oben beschrieben auf eine neue HPTLC-Platte gegeben und entwickelt. In dem Fall, dass die Probe die Vergleichssubstanz beinhaltet, erscheinen drei, ansonsten vier Substanzflecken. 23
Entsorgung
Die Kapillaren der Sulfonamide werden in die dafür vorgesehenen Halterungen gestellt und wiederverwendet. Die Kapillaren, die für die Probe verwendet wurden, werden im Feststoffabfall entsorgt. Die Lösungen mit den Sulfonamiden werden in das Behältnis für die wässrigen Waschflüssigkeiten und das übriggebliebene Fließmittel in den Lösemittelabfall entsorgt. Die HPTLC-Platte kann für die spätere Auswertung mitgenommen oder ebenfalls im Feststoffabfall entsorgt werden.
Auswertung
Die HPTLC-Platte ist mit einem Fluoreszenzindikator beschichtet 24. Unter 254nm UV-Licht fluoresziert diese Beschichtung mit Ausnahme der Punkte, an denen sich die Sulfonamide befinden. Deren Elektronen absorbieren das einfallende Licht, sodass weniger Anregungsenergie den darunterliegenden Fluoreszenzindikator erreicht. Aus diesem Grund erscheinen die Flecken auf der HPTLC-Platte rosafarben. Die Energie des absorbierten UV-Lichts wird dann in Bewegungsenergie in Form von Schwingungen und Rotationen umgewandelt. Diese Bewegungsenergie wird anschließend wieder in Form von Wärme von den Molekülen abgegeben 25. Der Prozess der Energieabgabe ohne Emission wird als strahlungslose Inaktivierung bezeichnet. 26
Am Ende der Entwicklung werden die Rf-Werte aller Substanzflecken berechnet. Durch Vergleichen der verschiedenen Rf-Werte kann darauf geschlossen werden, welche Sulfonamide sich in der Probensubstanz befinden. Gleiche Substanzen haben die gleiche Laufstrecke und somit den gleichen Rf-Wert. Es ist wichtig, dass nur die Rf-Werte derselben Entwicklung miteinander verglichen werden. Auch die Größe und Form der Substanzflecken kann Hinweise darauf geben, um welches Sulfonamid es sich handelt. Hier kann nun das vorher aufgenommene Foto zur Hilfe hinzugezogen werden.
Zur Bestimmung der Rf-Werte werden die Laufstrecken der Substanzflecken ausgehend vom Zentrum des jeweiligen Fleckes bis zum Startpunkt der Substanzen gemessen. Außerdem wird die markierte Laufstrecke des Fließmittels vom Startpunkt bis zur Fließmittelfront vermessen (Abb. 8).
Der Rf-Wert gibt das Verhältnis zwischen der Laufstrecke der Substanzflecken und der Laufstrecke der Fließmittelfront an. Somit kann dieser zwischen mindestens 0 und maximal 1 liegen (siehe Auswertung Dünnschichtchromatographie). Je stärker die Wechselwirkung der Substanzen mit der stationären Phase und je schwächer mit der mobilen Phase, desto kürzer ist die Laufstrecke und desto kleiner ist der dazugehörige Rf-Wert.
Zur qualitativen Bestimmung wird der Rf-Wert der einzelnen Substanzflecken wie folgt berechnet:⚠ $$ R_f = \left(\frac{S}{L}\right) ⚠ $$
L: Laufstrecke der Fließmittelfront in cm
S: Laufstrecke der Substanzflecken in cm
Eignung
Die qualitative Bestimmung von Sulfonamiden mittels der HPTLC-Technik eignet sich, um mehrere Substanzen in einem Gemisch zu identifizieren. Allerdings sind die Rf-Werte schlecht reproduzierbar, da eine HPTLC-Entwicklung von vielen Einflussfaktoren wie der Temperatur oder der Fließmittelsättigung abhängt 28. Außerdem lassen sich nur Substanzen gut voneinander trennen, welche auch einen messbaren Unterschied in ihrem Rf-Wert aufweisen. Aus diesem Grund bietet es sich an, zur Kontrolle noch andere Methoden wie z.B. die HPLC hinzuzuziehen, damit eine klare Qualifizierung stattfinden kann.
Einzelnachweise
1 vgl. https://de.wikipedia.org/wiki/Hochleistungsdünnschichtchromatographie (zul. gesehen am: 04.12.2021) ⇑
2 Europäisches Arzneibuch 10.0/2.08.25.00 Seite 446 ⇑
3 vgl. Rücker, Gerhard/Neugebauer, Michael/Willems, Günther: Instrumentelle pharmazeutische Analytik, 5. Auflage, Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, Stuttgart 2013, S. 502f. ⇑
4 vgl. Salzer, Reiner: Kenngrößen der stationären Phase, http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/3/anc/croma/duennschichtchromatographie.vlu/Page/vsc/de/ch/3/anc/croma/dc/stat_phase/anschaul/kenngroe1m70te0101.vscml.html (zul. gesehen am: 20.11.2021) ⇑
5 vgl. Dieckenhorst, Burkhard: Hochleistungs-Dünnschichtchromatographie (HPTLC), http://www.bdsoft.de/demo/index.htm?/demo/chemie/analytik/chromatographisch/hptlc.htm (zul. gesehen am: 07.12.2021) ⇑
6 Goppel, Martin et al.: Arzneibuchnachweise optimieren, https://www.pharmazeutische-zeitung.de/inhalt-30-2004/pharm8-30-2004/ (zul. gesehen am 07.12.2021) ⇑
7 vgl. Dieckenhorst, Burkhard: Hochleistungs-Dünnschichtchromatographie (HPTLC), http://www.bdsoft.de/demo/index.htm?/demo/chemie/analytik/chromatographisch/hptlc.htm (zul. gesehen am: 07.12.2021) ⇑
8 vgl. Corvini, Philippe: Superresistenz von Bakterien entschlüsselt, https://www.fhnw.ch/de/forschung-und-dienstleistungen/lifesciences/highlights/umwelt-und-ressourcen/superresistenz-von-bakterien-entschluesselt (zul. gesehen am: 04.12.2021) ⇑
9 fotografiert von Bianca Moritz am 25.11.21 ⇑
10 mit ChemDraw von Timo Schaffeld gezeichnet ⇑
11 fotografiert von Bianca Moritz am 25.11.21 ⇑
12 vgl. Expertenbericht Dünnschichtchromatographie ⇑
13 vgl. Dieckenhorst, Burkhard: Hochleistungs-Dünnschichtchromatographie (HPTLC), http://www.bdsoft.de/demo/index.htm?/demo/chemie/analytik/chromatographisch/hptlc.htm (zul. gesehen am: 06.12.2021) ⇑
14 Salzer, Reiner et al.: RP-Phasen (modifizierte Kieselgele), http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/3/anc/croma/duennschichtchromatographie.vlu/Page/vsc/de/ch/3/anc/croma/dc/stat_phase/rp_phasen/rp_phasen1m70te0101.vscml.html (zul. gesehen am: 07.12.2021) ⇑
15 vgl. Rücker, Gerhard/Neugebauer, Michael/Willems, Günther: Instrumentelle pharmazeutische Analytik, 5. Auflage, Wissenschaftliche Verlagsgesellschaft mbH Stuttgart, Stuttgart 2013, S. 481 ⇑
16 fotografiert von Bianca Moritz am 25.11.21 ⇑
17 fotografiert von Mia Piccinno am 08.11.21 ⇑
18 fotografiert von Bianca Moritz am 25.11.21 ⇑
19 fotografiert von Bianca Moritz am 25.11.21 ⇑
20 Vgl. Ledermann, Alfons: Chromatographie, https://www.uni-wuerzburg.de/fileadmin/08020000/praktika/bio1/A-9.pdf S. 69 (zul. gesehen am: 04.12.2021) ⇑
21 vgl. Wyszogrodzka, Monika (Hrsg.): Dünnschichtchromatographie-Trennprinzip, https://www.bcp.fu-berlin.de/chemie/chemie/studium/ocpraktikum/ressourcen/laborpraxis/laborpraxis_webinfos/stofftrennungen/duennschichtchromatographie/trennprinzip.html (zul. gesehen am: 07.12.2021) ⇑
22 vgl. Wyszogrodzka, Monika (Hrsg.): Dünnschichtchromatographie-Trennprinzip, https://www.bcp.fu-berlin.de/chemie/chemie/studium/ocpraktikum/ressourcen/laborpraxis/laborpraxis_webinfos/stofftrennungen/duennschichtchromatographie/trennprinzip.html (zul. gesehen am: 07.12.2021) ⇑
23 vgl. Kellner, Thomas, Praktikumsskript Instrumentelle Analytik 4. Semester Pharmazie, Version:09 (Corona),Braunschweig 2021, S.67ff. ⇑
24 In Anlehnung am Kommentar zu Ph.Eur. 10.0/2.08.25.00 Hochleistungsdünnschichtchromatographie von pflanzlichen Drogen und Zubereitungen aus pflanzlichen Drogen, S. 446 ⇑
25 vgl. Hodam, Henryk (Hrsg.): Reflexion und Absorption, https://www.fis.uni-bonn.de/recherchetools/infobox/profis/was-ist-fernerkundung/reflexion-und-absorption (zul. gesehen am: 06.12.2021) ⇑
26 vgl. Kellner, Thomas, Folien Optische Methoden: Fluoreszenzspektroskopie, WiSe 21/22 S.6 ⇑
27 fotografiert von Timo Schaffeld am 08.11.21 ⇑
28 vgl. Ledermann, Alfons: Chromatographie, https://www.uni-wuerzburg.de/fileadmin/08020000/praktika/bio1/A-9.pdf S. 69 (zul. gesehen am: 04.12.2021) ⇑