IR 1
Titelblatt
Expertenbericht zum Praktikumsversuch
IR1
WiSe 2021/2022
Abgabedatum
16.12.2021
Expertengruppe 11
Anna Frese
Leonie Lückemeyer
Wiebke Schlüter
Identifizierung von Arzneistoffen (IR1)
Inhaltsverzeichnis
Einleitung und Grundlagen
Die IR-Spektroskopie gehört zu den optischen Methoden. Ganz allgemein werden dabei Moleküle (oder Atome) mit elektromagnetischer Strahlung angeregt und können dann anhand ihres Absorptionsverhaltens auf Identität, Reinheit und Gehalt bestimmt werden.
Die genutzte Strahlung in der IR-Spektroskopie ist die Infrarot-Strahlung. Diese ist mit einer Wellenlänge von 0,8 µm bis 500 µm langwelliger und damit energieärmer als UV- Strahlung oder das sichtbare Licht, weshalb in Molekülen nur Schwingungen und keine Elektronenübergänge angeregt werden.1 Diese Schwingungen sind im Wesentlichen asymmetrische Valenz- oder Deformationschwingungen. Entscheidend für die IR-Aktivität eines Stoffes ist die Änderung des Dipolmoments des Moleküls durch Schwingungen.2
Ausschlaggebend in der Anwendung der IR-Spektroskopie sind zum einen charakteristische Wellenbanden von Atomgruppen, die das Vorkommen der jeweiligen funktionellen Gruppen in einem Molekül nachweisen und damit die Strukturaufklärung ermöglichen.3 Zum anderen weist jedes Molekül, meist im „Fingerprint-Bereich“, ein einzigartiges Spektrum auf, weshalb die IR-Spektroskopie dadurch auch zur Identitätsbestimmung geeignet ist.
Die Identitätsbestimmung bzw. das Feststellen der Übereinstimmung der Spektren ist auch das Ziel des Praktikumsversuches. Genutzt wird dafür IR-Strahlung im mittleren Bereich (2,5 µm bis 50 µm).
Die IR-Spektroskopie zeichnet sich als bewährte Methode mit einfacher Probenvorbereitung und geringem Substanzverbrauch aus. Mit ihr können organische und anorganische Substanzen in allen Aggregatzuständen bestimmt werden.4
Nachteile stellen aber u. a. die Möglichkeit der in der Probenvorbereitung bedingten Störeffekte dar. Diese können beispielsweise das Ausbilden von Wasserbanden im Spektrum sein, wenn das meist hygroskopische Fließmittel nicht trocken gelagert wurde, oder das Auftreten von Polymorphie durch die hohen Drücke während des Pressvorganges.5
Die Bedeutung der IR-Spektroskopie verdeutlicht ein Blick ins Arzneibuch: Zur Bestimmung der Identität gibt es 1213 Nennungen, des Weiteren ist sie auch als Methode zur Reinheits- und Stabilitätsprüfung aufgeführt.6
Versuchsbeschreibung
Aufgabe a
Die Identität des ausgegebenen Probenpulvers soll mit Hilfe der vorliegenden Referenz-IR-Spektren bestimmt werden.
Aufgabe b
Für die Probensubstanzen a und b werden IR-Spektren angefertigt. Durch Vergleich dieser soll die Aussage getroffen werden, ob beide Substanzen in ihrer Identität übereinstimmen.
Aufgabe c
Ziel ist es, den Wirkstoff eines Fertigarzneimittels durch Vergleich mit IR-Spektren aus dem Referenzkatalog zu bestimmen. Zur Aufreinigung, um Hilfsstoffe mit eigenem Absorptionsverhalten zu entfernen, ist hier mit Filtration und Eindampfen eine etwas umfangreichere Probenvorbereitung nötig.
Instrumenteller Aufbau
Der Versuch wird mit einem FT-IR-Spektrometer Spectrum 100 durchgeführt.8 Dabei handelt es sich um ein Fourier-Transform-Spektrometer, einem Einstrahl-Spektrometer mit einem Michelson-Interferometer zwischen der Lichtquelle und der Probe.
Angeschlossen ist das IR-Spektrometer an einen Computer mit der Software "Spectrum Express", über welche es gesteuert und die Spektren angezeigt, optimiert und ausgedruckt werden können.
Nach Aufklappen der Schutzabdeckung findet man eine Vorrichtung vor, in welche die Presslings-Halterung mit dem im Versuch hergestellten Pressling eingesetzt werden kann.
Durchführung
Während die Auswertung von Aufgabe b abhängig von der Aufgabe a ist, kann die Aufgabe c unabhängig von den beiden anderen Aufgaben durchgeführt werden. Da Letztere allerdings einen Arbeitsschritt mit viel Wartezeit beinhaltet, ist es ratsam, mit dieser Aufgabe zu beginnen und die Wartezeit mit der Durchführung von Aufgabe a und b zu füllen.
Vor Beginn des Versuchs sollte sich mit den Sicherheitshinweisen für die verwendeten Reagenzien, Aceton und Kaliumbromid, vertraut gemacht werden.
Aufgabe a und b
Aus den pulverförmigen Proben a und b wird je ein Pressling, also eine transparente Scheibe, hergestellt, die im Anschluss in eine Halterung zur Messung in das IR-Spektrometer eingesetzt werden.
Die Herstellung erfolgt durch die Verreibung und Pressung mit trockenem Kaliumbromid, welches aufgrund seiner IR-Strahlungsdurchlässigkeit im Gegensatz zu Glas gut als Trägermaterial geeignet ist. Dazu werden ca. 1 mg einer Probe (entspricht einer Spatelspitze) aus dem Probengefäß entnommen und in einem Achat-Mörser mit einem Achat-Pistill mit ca. 200 mg Kaliumbromid zu einem feinen, homogenen Pulver verrieben. Da das Kaliumbromid hygroskopisch ist, ist es erst direkt vor seiner Nutzung aus dem Trockenschrank zu nehmen und direkt danach wieder dort hineinzustellen, damit es ein trockenes Pulver bleibt und kein Wasser aufnimmt, welches das Spektrum durch Wasserbanden verfälschen würde.
Die Mengen müssen hierbei nicht genau abgewogen werden, es genügt, sie abzuschätzen. Dennoch sollte nicht übermäßig viel oder wenig Substanz verwendet werden, da ein zu dünner Pressling brüchiger ist und sich ein zu dicker Pressling nicht so gut in der Presslings-Halterung für das Spektrometer fixieren lässt.
Das Behältnis, in dem die Verreibung im Presswerkzeug zu einem Pressling verarbeitet wird, wird zusammengebaut. Dazu wird das in Abbildung 2 mit der Nummer 3 beschriebene Metallstück, der sogenannte Unterstempel, in die Öffnung des Bestandteils 2 gelegt und dieses mit der schmaleren Seite nach unten auf Bestandteil 1 platziert. Die Verreibung aus dem Achat-Mörser wird mithilfe eines Pinsels in die nun obenliegende andere Öffnung von Bestandteil 2 hineingegeben. Hier ist wichtig, dass der Pinsel trocken und sauber ist und sich daran keine Substanz-Rückstände von der vorigen Praktikumsgruppe befinden. Das zum Pressbehältnis gehörende Stäbchen (Nr. 4 in Abbildung 2), der Oberstempel, wird mit seiner glatten Seite voran dort eingeführt. Auf den ersten Blick wirken hierbei beide Seiten sehr glatt, gemeint ist diejenige ohne abgeschrägte Ränder.

Abb.3: Presswerkzeug: Pressen des Presslings (links) sowie Lösen des Presslings aus dem Behältnis (rechts)10
Die gesamte Apparatur wird nun in das Presswerkzeug gestellt und dort befestigt, wie es links in Abbildung 3 dargestellt ist.
Das Ventil rechts an der Seite wird verschlossen und bei geschlossener Schutzscheibe wird durch Bewegung des Hebels ein Druck auf das sich im Pressbehältnis befindende Pulver aufgebaut. Dadurch zerfließen die Kaliumbromid-Körner und werden zu einer plastischen Scheibe, in der die Probe aufgrund des vorhergegangenen sorgfältigen Verreibens gleichmäßig verteilt sein wird.
Mit dem im Labor vorhandenen Presswerkzeug darf ein Druck von maximal 7 kbar aufgebaut werden. Unter diesem Druck wird das Pulver etwa 5-10 Minuten verweilen gelassen.
Anschließend wird das Ventil wieder geöffnet und das Pressbehältnis wird aus dem Presswerkzeug gelöst und entnommen. Bestandteil 1 des Pressbehältnisses (siehe Abb. 2) wird entfernt und das Konstrukt wird mit dem Stäbchen (siehe Abb.2, Nr. 4) nach unten wieder in das Presswerkzeug gestellt. Ein oben und unten offener Glaszylinder (siehe Abb.2, Nr. 5 bzw. rechts in Abb.3) wird darauf gestellt und die Bestandteile des Pressbehältnisses werden mit wenig Druck durch Drehen des Rads vom Presswerkzeug voneinander gelöst. Der Glaszylinder sorgt dafür, dass der fertige Pressling dabei nicht beiseite fällt. Dieser wird dann entnommen, wobei er nur an den Rändern oder mit einer sauberen Pinzette angefasst werden darf, um Verunreinigungen durch sich an den Händen befindenden Substanzen mit Auswirkungen auf das Spektrum zu vermeiden.
Der Pressling sollte eine runde, möglichst gleichmäßig durchscheinende Scheibe sein, wie rechts in Abbildung 4 zu sehen ist. Sollten wie links in Abbildung 4 Trübungen oder Brüche vorhanden sein, verreibt man den Pressling im Achat-Mörser wieder zu einem homogenen Pulver und fertigt ihn erneut an. Eine leichte Trübung lässt sich allerdings nicht vermeiden, jedoch sollte der Pressling noch lichtdurchlässig sein. Dieses kann überprüft werden, indem man den Pressling gegen das Licht hält. Auch leichte Unregelmäßigkeiten und Brüche am Rand des Presslings sind akzeptabel, solange sie vollständig von der Presslings-Halterung bedeckt werden und die Messung daher nicht stören können.
Der fertige Pressling kann nun in eine Presslings-Halterung gelegt und fixiert werden, welche zur Messung in das IR-Spektrometer eingesetzt wird. Falls bei der Presslings-Herstellung zu viel Kaliumbromid verwendet wurde und der Pressling nun zu dick ist, um sich richtig in der Presslings-Halterung fixieren zu lassen, kann er erneut im Achat-Mörser verrieben, ein Teil des Pulvers entfernt und der Pressling mit nun etwas weniger Substanz erneut hergestellt werden.
Vor dem Einsetzen und Aufnehmen der Probe wird am Computer bei freiem Strahlengang und geschlossenem Spektrometer-Deckel der Untergrund aufgenommen. Erst im Anschluss wird die Proben-Halterung mit dem Pressling in das Spektrometer eingesetzt und die Messung, sowie die Spektrumsoptimierung gemäß der vorliegenden Bedienungsanleitung durchgeführt. Vor dem Ausdrucken empfiehlt es sich, die Farbe des Spektrums in schwarz zu ändern, um es auf dem Ausdruck möglichst vollständig erkennen zu können. Der Ausdruck kann dann zur Auswertung des Spektrums verwendet werden.
Die Entsorgung der Presslinge nach der Messung erfolgt über den Feststoffabfall.
Aufgabe c
Probe c liegt in Form von Tabletten oder Kapseln vor, welche zunächst so verarbeitet werden müssen, dass sie zur Presslingsherstellung geeignet sind.
Die erhaltene(n) Tablette(n) bzw. der Inhalt der Kapsel(n) wird in einem Porzellan-Mörser mit einem Porzellan-Pistill gründlich verrieben. Wenn mehr als eine Tablette oder Kapsel ausgegeben wurde, sollten direkt alle verwendet werden. Es sollten keine Tabletten oder Kapseln zurückgelegt werden, um eine eventuell nötige Wiederholung durchzuführen. Ansonsten kann es passieren, dass man nicht genug Substanz für die Presslingherstellung erhält.
Das durch das Verreiben erhaltene Pulver wird in etwa 5 ml Aceton suspendiert und mithilfe eines Trichters und Filterpapier in eine Abdampfschale filtriert (siehe Abb.5, links), sodass der im Aceton gelöste Arzneistoff in die Schale gelangt, während die Hilfsstoffe als Rückstand im Filterpapier verbleiben. Der Rückstand im Filter wird mit weiteren 5 ml Aceton nachgewaschen und das Filtrat in ein warmes Sandbad gestellt, wo es bis zur Trocknung verbleibt (siehe Abb.5, rechts). Um die Trockung zu beschleunigen, kann etwas von dem warmen Sand um das Gefäß zusammengeschoben werden. Dies nimmt einige Zeit in Anspruch, welche genutzt werden kann, um die Aufgaben a und b durchzuführen.
Falls nach dem Trocknen ein Öl zurückbleibt, kann daraus durch das Anreiben mit einem Glasstab die Kristallisation herbeigeführt werden.
Mit dem Produkt aus diesem Verfahren erfolgt dann die Herstellung eines Presslings und die Messung des IR-Spektrums wie bei Aufgabe a und b.
Auswertung
Allgemeines
Bei einem IR-Spektrum wird die Transmission gegen die Wellenzahl aufgezeichnet. Die Transmission stellt den Lichtanteil dar, der durch die Probe gelangt und wird wie folgt beschrieben:13
T = Transmission [%]
I = Lichtintensität nach verlassen der Probe
I0 = ursprüngliche Lichtintensität
Das Spektrum wird grundsätzlich in zwei Bereiche eingeteilt. Der Fingerprint-Bereich geht von 1500 cm-1 bis 500 cm-1 und umfasst Banden durch Gerüstschwingungen.14 Dieser Bereich ist für jedes Molekül einzigartig und eignet sich besonders gut zur Identifikation durch Vergleichsspektren. Der Bereich von 4000 cm-1 bis 1500 cm-1 ist durch relativ scharfe Banden der Valenzschwingungen gekennzeichnet, welche sich gut bestimmten Wellenzahlen und damit bestimmten Atomgruppen zuordnen lassen (vgl. Infrarot-Spektroskopie, Auswertung).15
Neben der Möglichkeit die Spektren mit hochleistungsfähigen Computern auszuwerten,16 gibt es noch die visuelle Auswertung, bei der mit Hilfe von Referenzspektren zwei grundlegende Kriterien überprüft werden. Zum einen müssen alle Bandenpositionen übereinstimmen, das heißt, dass sowohl die Minima, als auch die Maxima des Spektrums eine identische Wellenzahl besitzen. Zum anderen sollten sich die Banden auch in ihrer relativen Größe gleichen, sodass die Transmissionswerte im selben Verhältnis zueinander stehen. Diese Art der Auswertung ist möglich, da jedes organische Molekül ein einzigartiges IR-Spektrum besitzt, wodurch die IR-Spektroskopie vor allem bei der Substanzidentifizierung eingesetzt wird.17
Die im Praktikum erzeugten IR-Spektren werden mit der Software "Spektrum Express" und durch einen optischen Vergleich mit Referenzspektren ausgewertet.
Aufgabe a
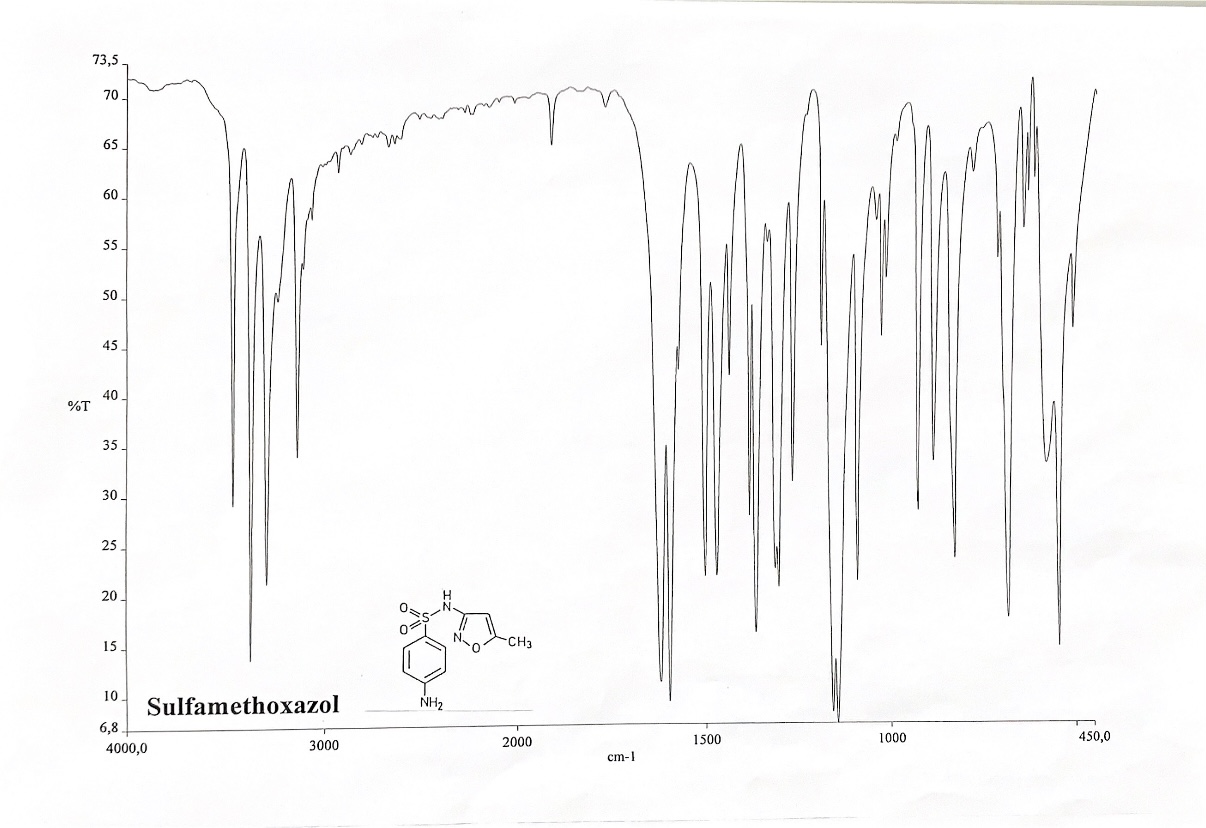
Bei Aufgabe a soll durch den Vergleich des IR-Spektrums der Probe (Abb. 6) mit den IR-Spektren der möglichen Substanzen entschieden werden, um welchen Arzneistoff es sich handelt.20
Die möglichen Substanzen sind Acetylsalicylsäure, Aminophenazon, Ascorbinsäure, Benzocain, Butoxycainhydrochlorid, Chininhydrochlorid, Coffein-Na-Benzoat, Desoxycortonacetat, Dexamethason, Diphenhydramin-HCl, Estradiolbenzoat, Ethinylestradiol, Methyltestosteron, Paracetamol, Phenacetin, Pilocarpin-HCl, Prednisolonacetat, Procain-HCl, Progesteron, Propyphenazon, Spironolacton, Sulfamethoxazol, Tetracain-HCl, Theophyllin, Thiaminchlorid-HCl und Triamcinolonacetonid. Im Praktikum liegt hierfür ein extra zusammengestellter Katalog mit den IR-Spektren aller infrage kommenden Substanzen aus.
Bei der Auswertung spielt vor allem die Lage der Banden eine entscheidende Rolle. Sobald zusätzliche Banden in dem IR-Spektrum auftauchen oder charakteristische Banden fehlen sind die Substanzen nicht identisch. Die auf der y-Achse dargestellten Intensitätswerte, sowie die Ausprägung der Banden müssen nicht übereinstimmen, da es durch kleinste Konzentrationsänderungen oder einer abweichenden Presslingsdicke zu unterschiedlich ausgeprägten Signalen kommen kann, weshalb hier eher die relative Höhe der Banden von Bedeutung ist. In dem Beispiel ist das IR-Spektrum der Substanz Sulfamethoxazol dargestellt (Abb. 7).
Aufgabe b
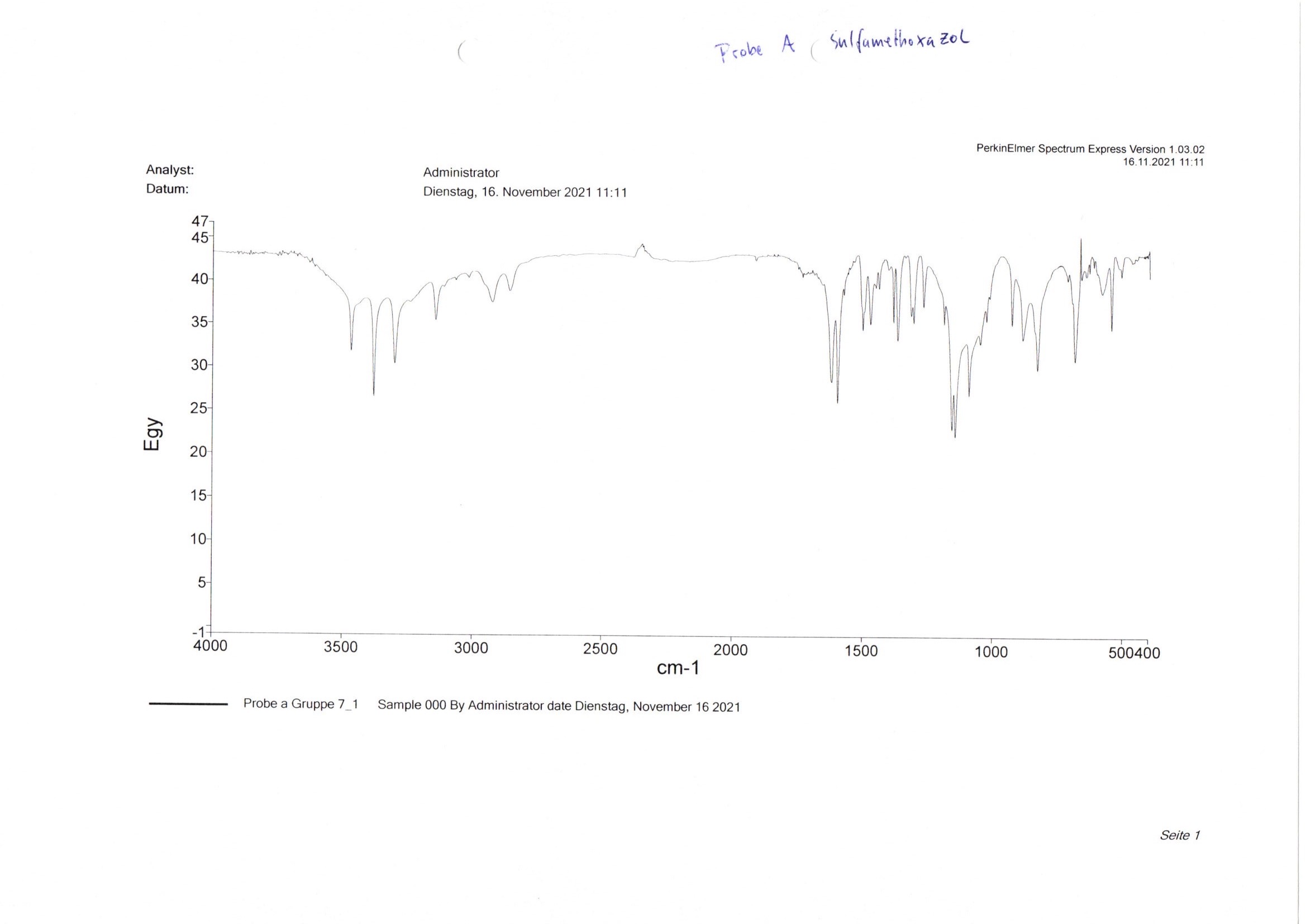
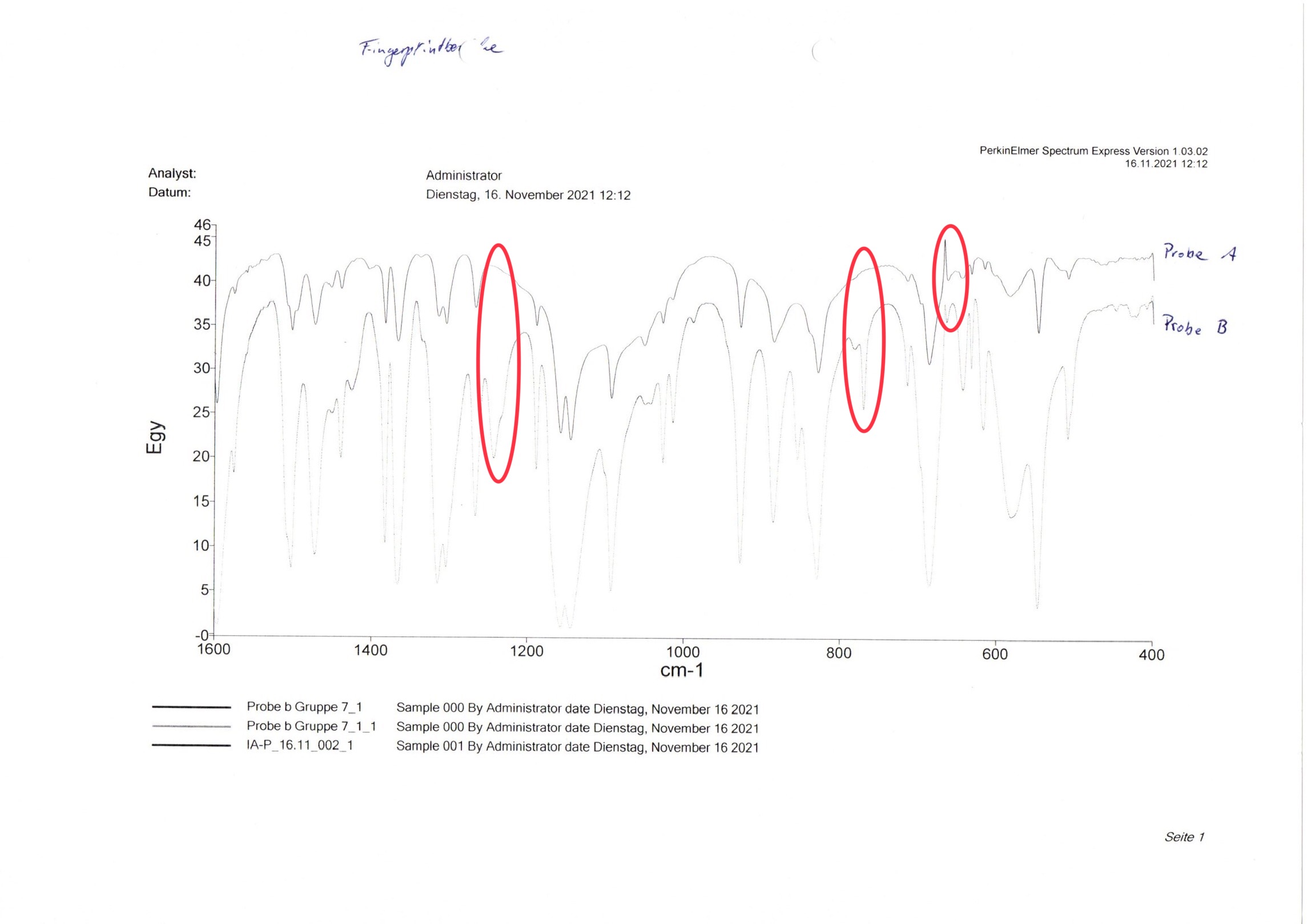
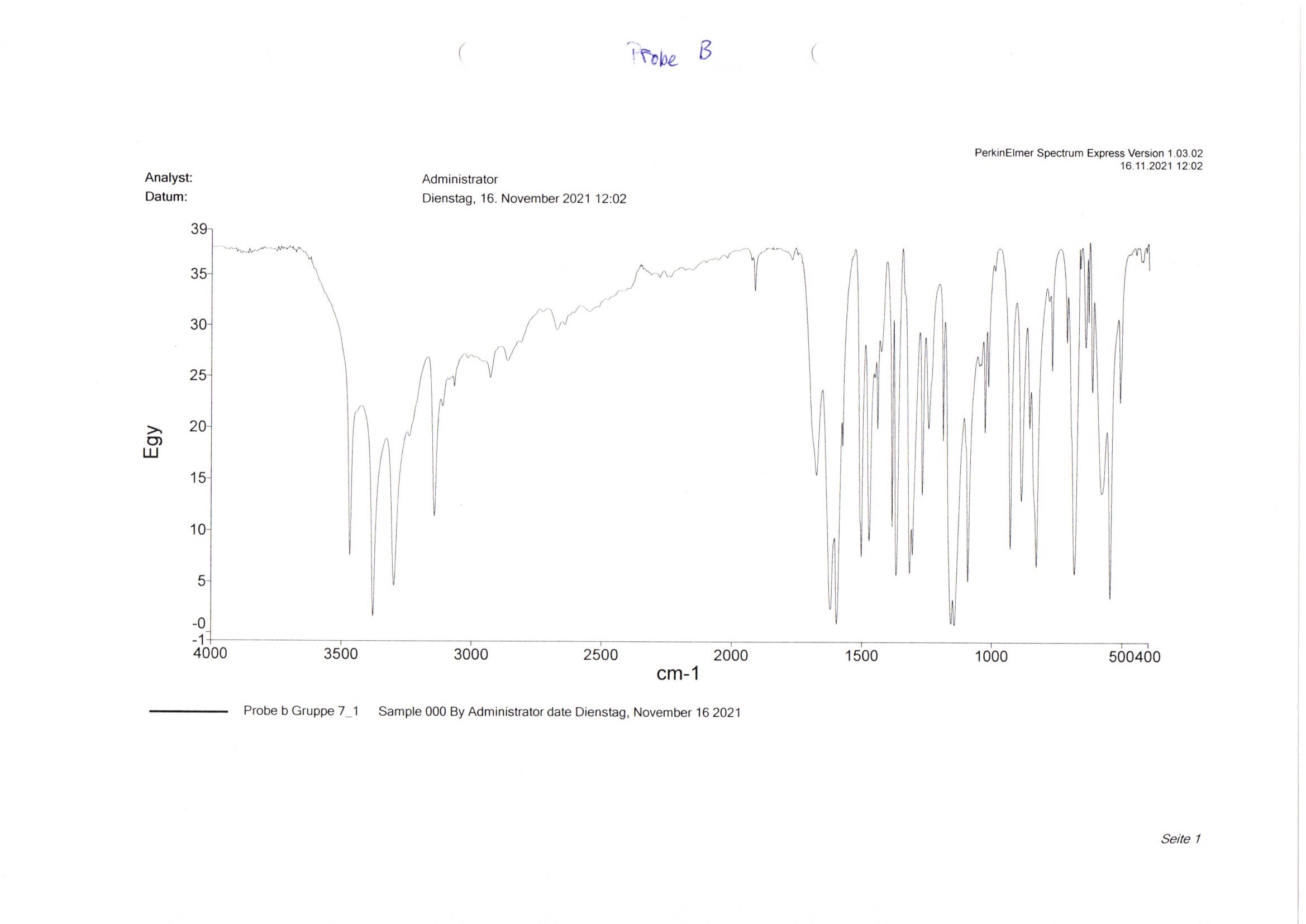
Bei Aufgabe b wird überprüft, ob es sich bei der Probe b (Abb. 8) um die unter Aufgabe a identifizierte Substanz handelt.23 Hierfür wird das IR-Spektrum der Arzneistoffe auf einen Bereich von 2000 bis 400 cm-1 vergrößert und auf fehlende oder zusätzlich vorhandene Signale untersucht. Um die Auswertung zu erleichtern, werden die Spektren der Proben a und b gemeinsam in ein Spektrum gedruckt, indem beide Presslinge direkt nacheinander in derselben Datei vermessen werden. Dadurch werden auch sehr geringe Unterschiede auf Anhieb deutlich (Abb. 9). In dem Beispiel ist zu erkennen, dass Probe b bei ca. 1230 cm-1 und 780 cm-1 zusätzliche Absorptionsminima aufweist. Im Gegensatz dazu ist bei Probe a bei ca. 650 cm-1 ein Absorptionsmaximum zu erkennen, welches bei Probe b nicht vorkommt. Die Substanzen sind also nicht identisch.
Aufgabe c
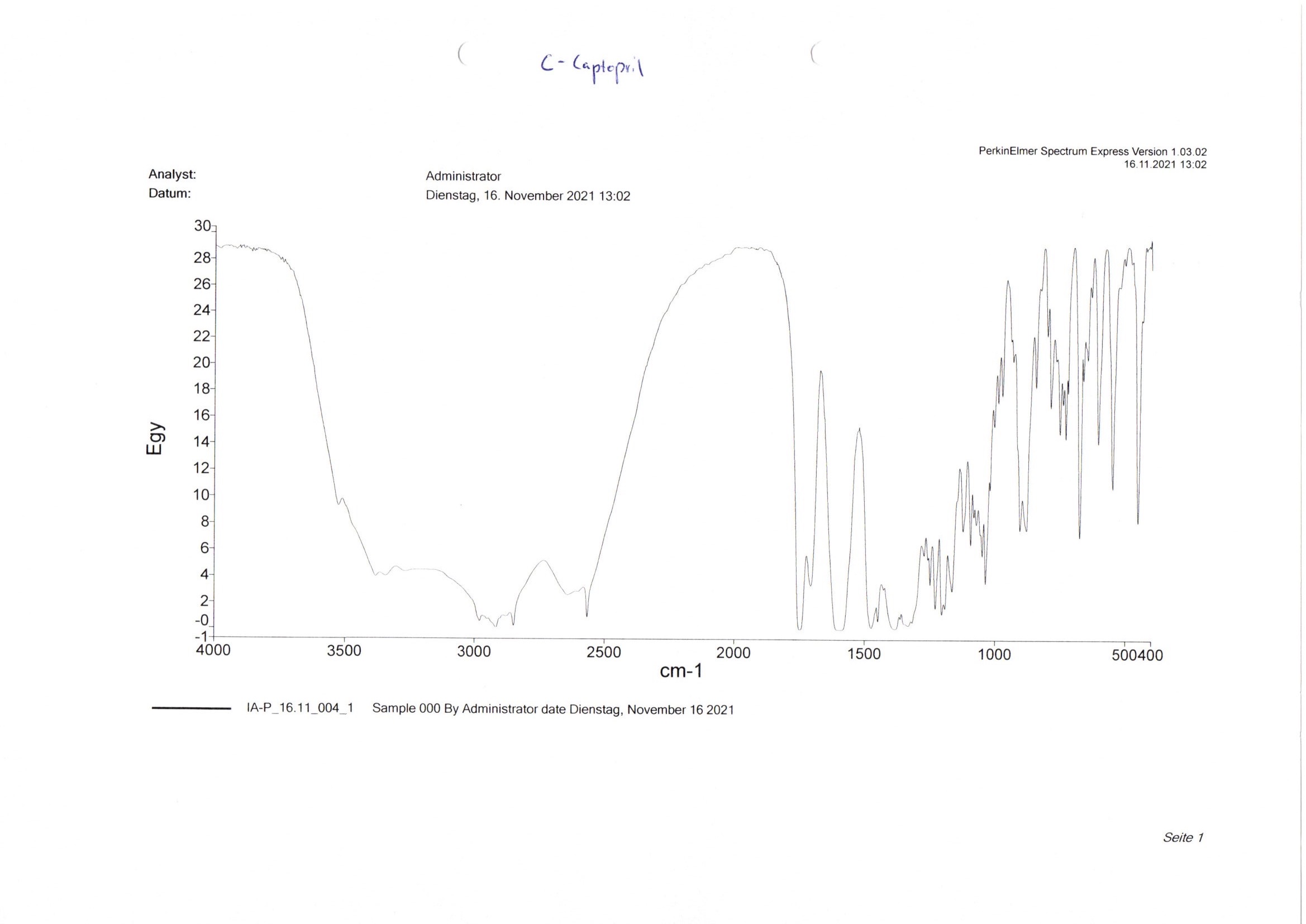
Bei dem IR-Spektrum der Probe c (Abb. 10) handelt es sich um ein Fertigarzneimittel. Für die Identifizierung wird das IR-Spektrum der Probe ebenfalls mit verschiedenen Referenzspektren verglichen und auf Gemeinsamkeiten überprüft.24
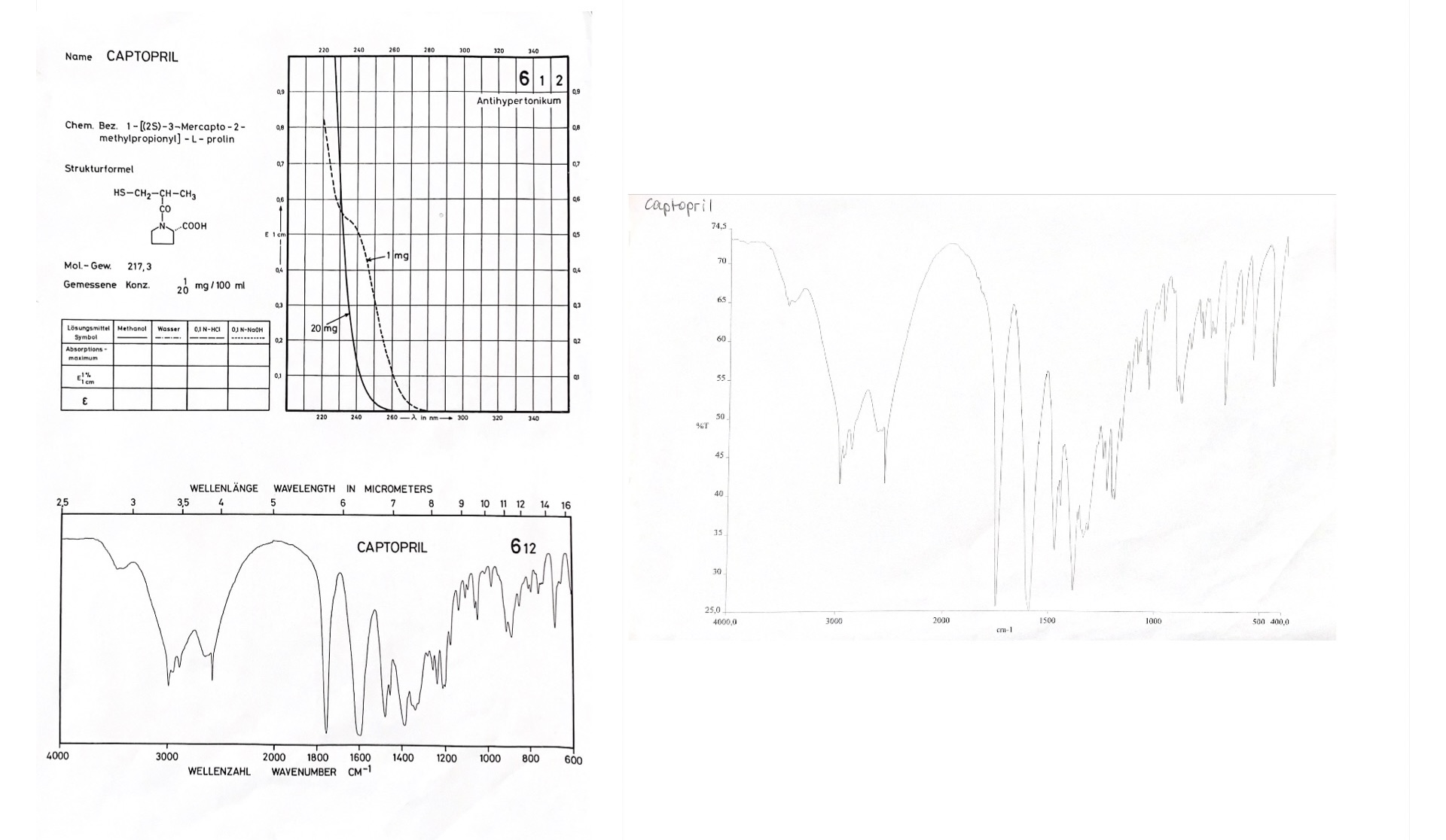
Zur Auswahl stehen die Arzneistoffe Acetylsalicylsäure, Captopril, Carbamazepin, Diclofenac-Natrium, Fenofibrat, Furosemid, Hydrochlorothiazid, Ibuprofen, Metronidazol, Nifedipin, Nitrendipin, Paracetamol, Piroxicam, Prednisolon, Spironolacton und Theophyllin. Für diese Aufgabe liegt ein weiterer Katalog mit den zugehörigen Referenz-IR-Spektren aus. Bei dem Beispielspektrum der Probe c handelt es sich um Captopril (Abb. 11).
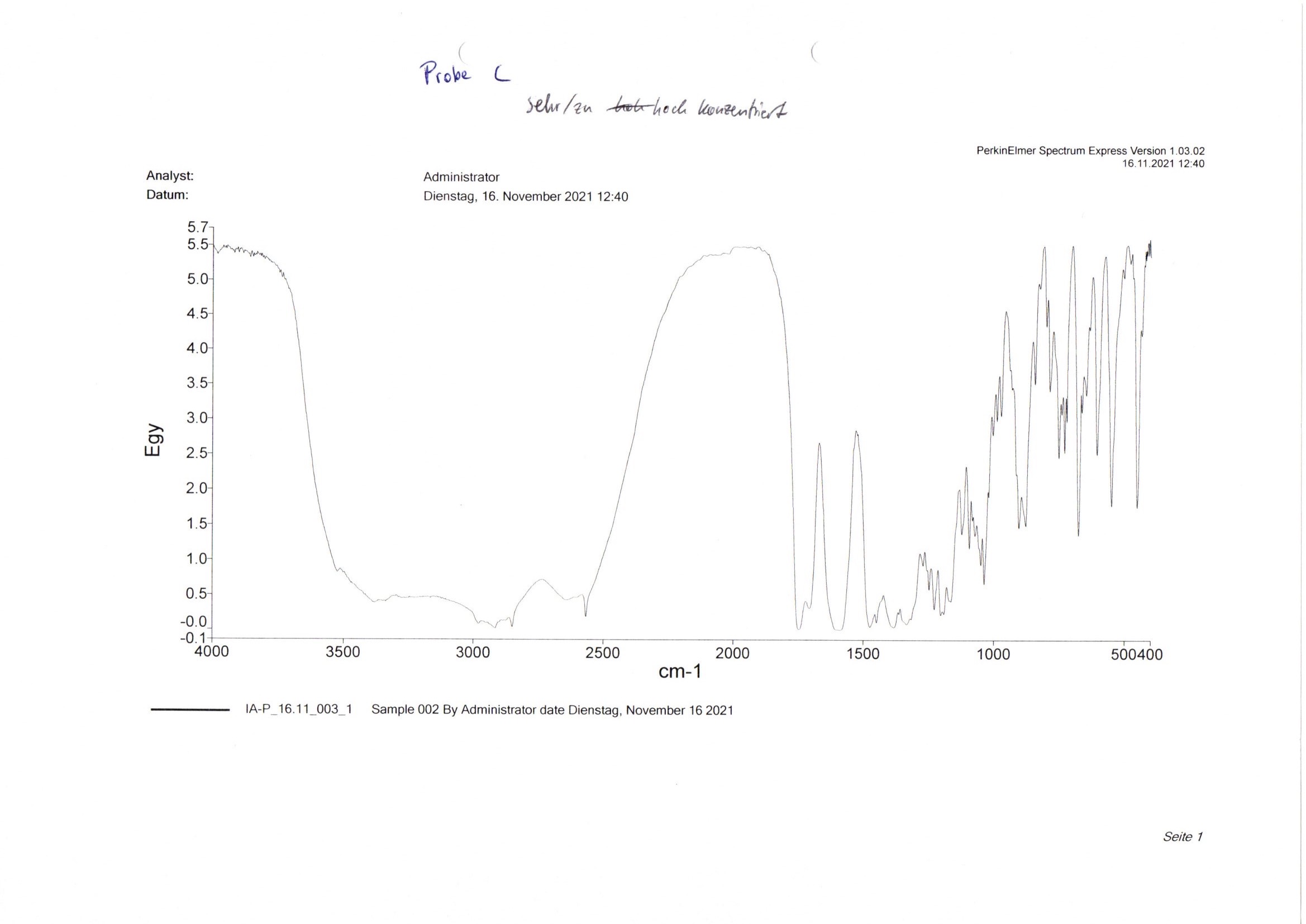
Um einen optimalen Vergleich zu erzielen, ist es zudem wichtig, dass der Pressling nicht zu hoch konzentriert ist. Ein zu stark dosierter Pressling würde zu flacheren Spektrumsverläufen mit schlecht erkennbaren Peaks führen (Abb. 12). Um das zu verhindern, kann der Pressling ein weiteres Mal gemörsert, ein Teil davon mit etwas Kaliumbromid verdünnt und wieder zu einem neuen Pressling verarbeitet werden.
Ansage
Für Aufgabe a und c sind die identifizierten Substanzen anzugeben. Für Aufgabe b ist anzugeben, ob die Substanzen a und b identisch sind oder nicht.28
Einzelnachweise
1 vgl. Kellner, Dr. Thomas, Folien Optische Methoden: Infrarot-Spektroskopie, WiSe 21/22, S.5-6 ⇑
2 vgl. Kellner, Dr. Thomas, Folien Optische Methoden: Infrarot-Spektroskopie, WiSe 21/22, S.14 ⇑
3 vgl. Kellner, Dr. Thomas, Folien Optische Methoden: Infrarot-Spektroskopie, WiSe 21/22, S.56-65 ⇑
4 vgl. Kellner, Dr. Thomas, Folien Optische Methoden: Infrarot-Spektroskopie, WiSe 21/22, S.21-27 ⇑
5 vgl. Kellner, Dr. Thomas, Folien Optische Methoden: Infrarot-Spektroskopie, WiSe 21/22, S.54 ⇑
6 vgl. Kellner, Dr. Thomas, Folien Optische Methoden: Infrarot-Spektroskopie, WiSe 21/22, S.66 ⇑
7 fotografiert von Anna Frese, 25.11.2021 ⇑
8 Kellner, Dr. Thomas, Praktikumsskript Instrumentelle Analytik 4. Semester Pharmazie, Version:09 (Corona), Braunschweig 2021, S.56 ⇑
9 fotografiert von Anna Frese, 16.11.2021 ⇑
10 fotografiert von Anna Frese, 16.11.2021 ⇑
11 fotografiert von Anna Frese, 16.11.2021 ⇑
12 fotografiert von Anna Frese, 16.11.2021 ⇑
13 vgl. Kellner, Dr. Thomas, Folien Optische Methoden: Infrarot-Spektroskopie, WiSe 21/22, S.17 ⇑
14 vgl. Kellner, Dr. Thomas, Folien Optische Methoden: Infrarot-Spektroskopie, WiSe 21/22, S. 43 ⇑
15 vgl. https://pharmchem.de.cool/wiki/Instru/Infrarot-Spektroskopie (zuletzt gesehen am: 06.12.2021) ⇑
16 vgl. Kellner, Dr. Thomas, Folien Optische Methoden: Infrarot-Spektroskopie, WiSe 21/22, S.46-47 ⇑
17 vgl. Kellner, Dr. Thomas, Folien Optische Methoden: Infrarot-Spektroskopie, WiSe 21/22, S.48 ⇑
18 fotografiert von Leonie Lückemeyer, 07.12.2021 ⇑
19 fotografiert von Wiebke Schlüter, 16.11.2021 ⇑
20 Kellner, Dr. Thomas, Praktikumsskript Instrumentelle Analytik 4. Semester Pharmazie, Version:09 (Corona), Braunschweig 2021, S.56-58 ⇑
21 gescannt von Wiebke Schlüter, 16.11.2021 ⇑
22 gescannt von Wiebke Schlüter, 16.11.2021 ⇑
23 Kellner, Dr. Thomas, Praktikumsskript Instrumentelle Analytik 4. Semester Pharmazie, Version:09 (Corona), Braunschweig 2021, S.56-58 ⇑
24 Kellner, Dr. Thomas, Praktikumsskript Instrumentelle Analytik 4. Semester Pharmazie, Version:09 (Corona), Braunschweig 2021, S.56-58 ⇑
25 gescannt von Wiebke Schlüter, 16.11.2021 ⇑
26 fotografiert von Leonie Lückemeyer, 07.12.2021 ⇑
27 gescannt von Wiebke Schlüter, 16.11.2021 ⇑
28 Kellner, Dr. Thomas, Praktikumsskript Instrumentelle Analytik 4. Semester Pharmazie, Version:09 (Corona), Braunschweig 2021, S.57-58 ⇑