Infrarot-Spektroskopie
Titelblatt
Bericht der Expertengruppe für
IR-Spektroskopie
SoSe 2021
Abgabedatum
21.06.2021
Über-/Expertengruppe 14
Selver Palali
Aylin Deniz Tas
Anis Naghavialhosseini
Meryem Al-Kathemi
IR-Spektroskopie
Inhaltsverzeichnis
Einleitung
Die IR-Spektroskopie basiert auf der Anregung von Schwingungen innerhalb eines Moleküls. Anders als UV/VIS-Strahlung ist IR-Strahlung energiearm, weshalb die Energie nicht ausreichend ist, um die Elektronen auf ein höheres Energieniveau anzuheben. Die Elektronen werden nur in Schwingung gebracht. Die Schwingungsenergie ist abhängig von der Bindungsstärke zwischen den Atomen in einem Molekül, was letztendlich die Grundlage für die Identifikation von Substanzen liefert. Daher findet die IR-Spektroskopie insbesondere in der qualitativen Analytik Anwendung. Bei der IR-Spektroskopie erfolgt eine Messung über die Darstellung des Lichtanteils, der durch die Probe gelangt, was als Transmission bezeichnet wird. Das IR-Spektrum umfasst die Teilbereiche des NIR, MIR und FIR.
Physikalische und chemische Grundlagen
Die IR-Spektroskopie basiert auf der Wechselwirkung zwischen Infrarotstrahlung und meist an-/organischen Molekülen,wobei es bei anorganischen Molekülen eine untergeordnete Rolle spielt. Die Atome der Moleküle werden durch IR-Strahlung nur in Schwingung versetzt, weil die Energie nicht ausreichend ist, um die Elektronen auf ein erhöhtes Energieniveau zu bringen. Daher wird die IR-Spektroskopie auch Schwingungs-Spektroskopie genannt. Je nach vorliegender Probe kann eine Messung entweder über Transmission oder eine abgeschwächte Totalreflexion erfolgen. Die IR-Spektroskopie findet insbesondere Anwendung zur Identifizierung von Substanzen, da alle organischen Moleküle ein einzigartiges IR-Spektrum aufweisen. Daneben kann die IR-Spektroskopie auch für quantitative Bestimmungen verwendet werden. Der Bereich der Infrarot-Strahlung umfasst die Wellenlängen von 800 nm – 500 μm. Dabei wird dieser in die Teilbereiche: nahes Infrarot (NIR: 0,8 μm – 2,5 μm), mittleres Infrarot (MIR: 2,5 μm - 50 μm) und fernes Infrarot (FIR: 50 μm-500 μm) unterteilt. Die Teilbereiche des IR-Bereiches werden historisch bedingt in Wellenzahlen ausgedrückt: NIR: 12550 cm−1-4000 cm−1, MIR: 4000 cm−1 -200 cm−1, FIR: 200 cm−1-20 cm−1. Die Wellenzahl ist dabei der Kehrwert der Wellenlänge. Im Gegensatz zur Wellenlänge verhält sich die Wellenzahl proportional zur Energie.1
⚠ $$ 𝜈̃ = \frac {v} {c} = \frac {1} {λ} ⚠ $$
Gesetzmäßigkeit zur Wellenzahl : v: Frequenz, c: Lichtgeschwindigkeit, λ= Wellenlänge
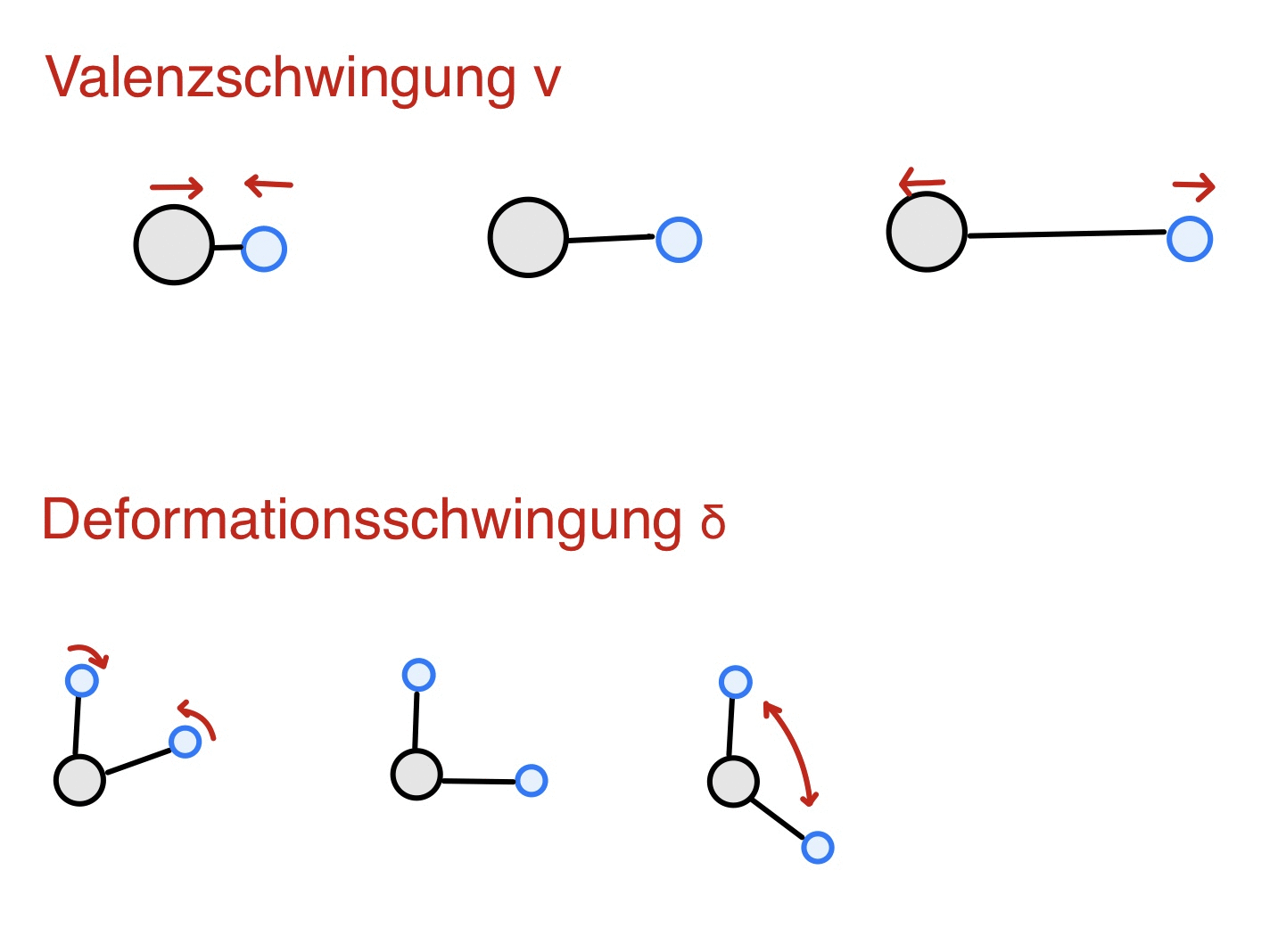
Molekülschwingungen
Licht im Infrarot-Bereich ist nicht in der Lage Elektronen eines Moleküls in ein höheres Energieniveau zu befördern, diese werden lediglich in Schwingung gebracht. Anhand dessen kann in Abhängigkeit von der Masse und Bindungsstärke der Atome ein Rückschluss auf die molekularen Absorptionseigenschaften gezogen werden, dies ist die Grundlage für die Entstehung von charakteristischen IR-Spektren. Es werden zwischen zwei Schwingungsarten unterschieden: Handelt es sich bei der Schwingung um eine Dehnung/Stauchung einer Bindung, so spricht man von einer Valenzschwingung v (siehe Abb.).Ist die Schwingung eine pendelartige Bewegung mit Änderung des Bindungswinkels, wird dies als Deformationsschwingung δ(siehe Abb.) bezeichnet. Eine Schwingung ist erst IR-aktiv, wenn aus der Änderung der Schwingungsenergie auch eine Änderung des Dipolmoments resultiert. Damit dies gewährleistet ist, muss das Molekül asymmetrisch schwingen. Eine IR-Inaktivität liegt bei einer symmetrischen Schwingung in Bezug auf das Symmetriezentrum vor. In diesem Fall kommt es zu keiner Änderung des Dipols und IR-Strahlung kann nicht absorbiert werden. 3
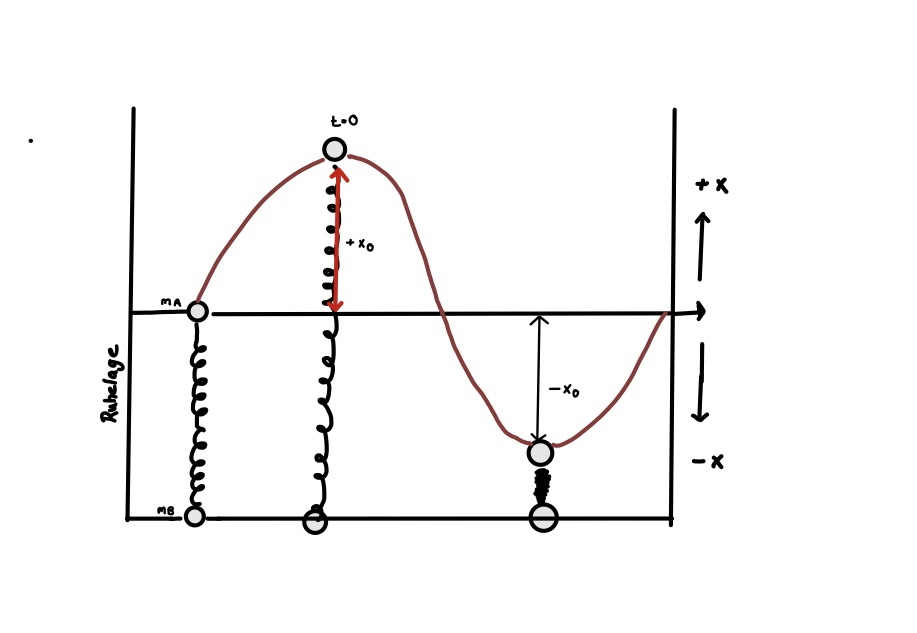
Der Harmonische Oszillator (Modellvorstellung)
Zur Erzielung eines besseren Verständnisses über die physikalischen Vorgänge der Molekülschwingungen werden diese zunächst über ein vereinfachtes Modell erklärt. Die Darstellung der Atome einer entsprechenden Masse erfolgt über Kugeln und die der chemischen Bindungen über verschieden starke Federn. (siehe Abb.). 4
Das Modell basiert auf zwei Gesetzmäßigkeiten. Zum einen auf dem Hook’schen Gesetz, welches die elastische Verformung von Festkörpern und damit ihre Bindungseigenschaften beschreibt, zum anderen auf dem der harmonischen Schwingung, welches die Position der schwingenden Kugel, in Annäherung an einen harmonischen Oszillator darstellt.
⚠ $$ K = -k⋅x ⚠ $$
Das Hook’sche Gesetz : K: Federspannung bzw. rücktreibende Kraft, x: Auslenkung zur Zeit t, k: Kraftkonstante = Maß für die Stärke der chemischen Bindung
⚠ $$ x = x_{ 0 }⋅cos(2π⋅v⋅t) ⚠ $$
Gesetz der harmonischen Schwingung: x: Auslenkung der Feder zur Zeit t, x0: größte Auslenkung der Feder t: Zeit, v: Schwingungsfrequenz
Um die molekularen Absorptionseigenschaften von zweiatomigen Molekülen zu beschreiben, werden die beiden Formeln gleichgesetzt und nach der Schwingungsfrequenz ν umgeformt. Es wird ersichtlich, dass die Frequenz der Schwingung von der Bindungsstärke und Masse der Atome abhängig ist:
⚠ $$ ν = \frac { 1 } {2π }⋅√ \frac{ k } { M } ⚠ $$ '6
ν = Schwingungsfrequenz; k = Kraftkonstante bzw. Bindungsstärke ; M = reduzierte Masse
Welche Wellenzahl die absorbierte Strahlung besitzt, ist von der Energie abhängig, die die betrachtete chemische Struktur für eine Schwingung benötigt. Das führt dazu, dass im IR-Spektrum die Lage der Banden für chemische Strukturen charakteristisch ist:
⚠ $$ 𝑊𝑒𝑙𝑙𝑒𝑛𝑧𝑎h𝑙 𝜈̃ 𝑑𝑒𝑟 𝐼𝑅 − 𝐵𝑎𝑛𝑑𝑒 ∼ √ \frac{ Bindungsstärke der schwingenden Massen } { reduzierte Masse der schwingenden Atome } ⚠ $$ 7
Anharmonischer Oszillator (Gekoppelte Oszillatoren)
In der oben beschriebenen Modellvorstellung wurden lediglich zwei Atome mit einer Bindung betrachtet. In einem Molekül gibt es aber viele schwingungsfähige Bindungen, die sich gegenseitig beeinflussen, daher spricht man auch von einer gekoppelten Oszillation. Diese gegenseitige Beeinflussung ermöglicht Rückschlüsse auf benachbarte Gruppen. Wellenzahlen sind umso charakteristischer für Atomgruppen je weniger Interaktionen stattfinden. Außerdem gelangt die Modellvorstellung an ihre Grenzen, da chemische Bindungen nur begrenzt gedehnt und gestaucht werden können. Darüber hinaus können Atomgruppen nur diskrete Schwingungsfrequenzen aufweisen. Die Schwingung ist deshalb nicht streng cosinusförmig und es gilt: 8
⚠ $$ E_{ s }= h⋅\frac{ 1 }{ 2π }√ \frac{ k }{ M }⋅( n + \frac { 1 }{ 2 } ) ⚠ $$
E_{s}: Schwingungsenergie ; h:Planksches Wirkungsquantum ; n:Schwingungsquantenzahl
Durch den Einfluss benachbarter schwingender Bindungen sind tabellierte Wellenzahlen also vorwiegend charakteristisch für Atomgruppen, an denen wenig Interaktion stattfindet. Jedoch kann man durch die Gegenseitige Beeinflussung und die damit einhergehende Verschiebung der Absorptionsbanden zu anderen Wellenzahlen auf benachbarte Gruppen schließen.
Instrumenteller Aufbau
Allgemeiner Aufbau
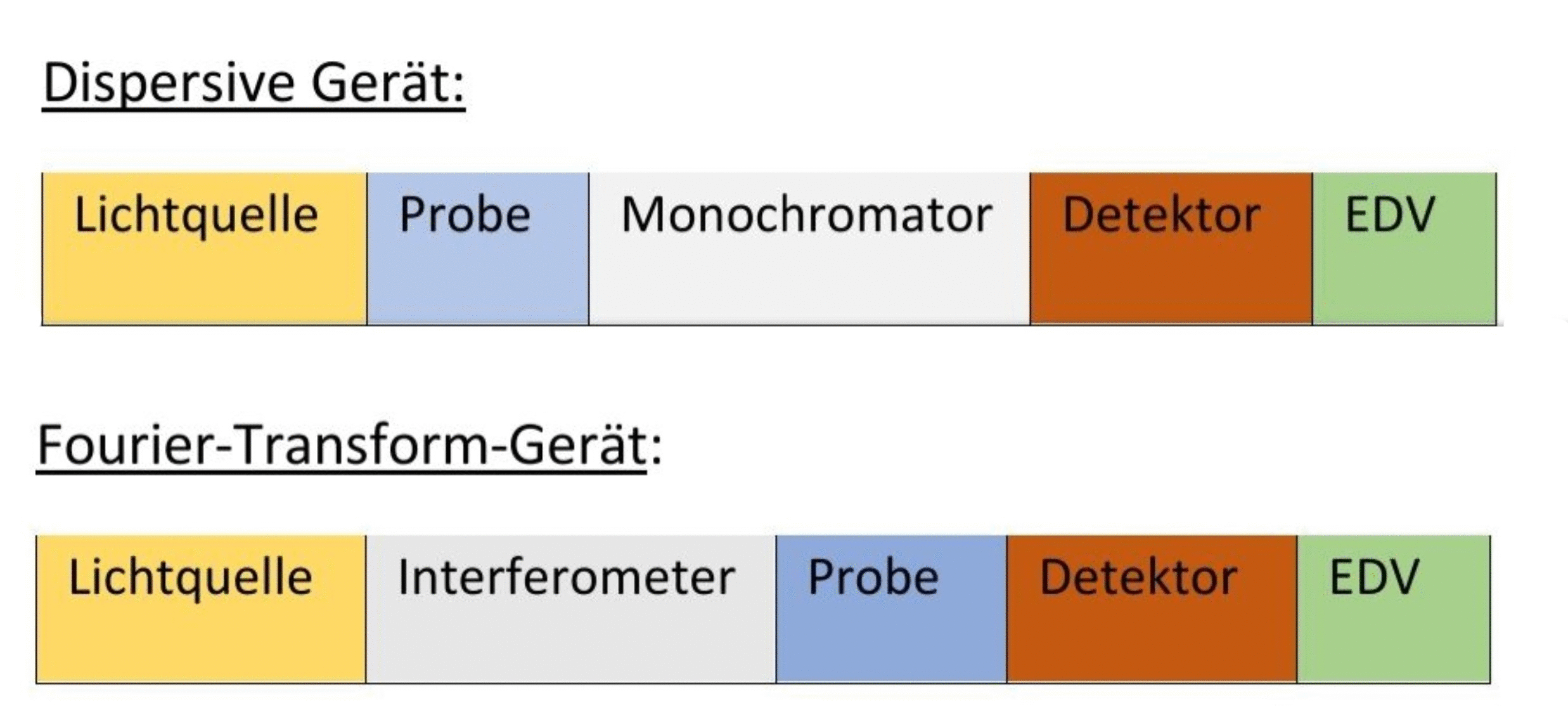
Allgemein unterscheidet man zwischen zwei Geräten:
Dispersives Gerät: Das dispersive Gerät ist im Allgemeinen ein Zweistrahlgerät. Hier erfolgt die spektrale Zerlegung der Strahlung des Lichtes über Gitter bzw. Prismen (Monochromator). Es besitzt eine Kammer für die Probe sowie eine für die Referenz. Dies ermöglicht eine gleichzeitige Spektralaufnahme.
Fourier Transform Gerät: Das Fourier-Transform-Gerät ist eine moderne Variante. Es handelt sich hierbei um ein Einstrahlgerät. Anstelle eines Gittermonochromators bzw. eines Prismen-Monochromators besitzt dieses Gerät ein Interferometer, welches sich zwischen Lichtquelle und Probe befindet(siehe Abb.). 10
Lichtquelle
Zur Anwendung kommt hier der Nernststift, die Quecksilber-Hochdrucklampe im FIR-Bereich oder die Wolfram-Lampe im NIR-Bereich. Der Glühkörper des Nernststift besteht aus einem Gemisch von Zirkoniumoxid und Yttriumoxid.11
Probenvorbereitung
Bei der IR-Spektroskopie werden keine Bauteile aus Glas verwendet, da diese für die IR-Strahlung undurchlässig sind. Die Bauteile bestehen deshalb aus Alkalihalogeniden wie z.B. Natriumchlorid oder Kaliumbromid. Da es sich hier um Salze handelt, sollte auf die Säuberung mit Wasser verzichtet werden, sonst kommt es zu Wasserbanden im Spektrum oder Auflösung des Salzes. Die IR-Spektroskopie ermöglicht es Substanzen unabhängig von ihrem Aggregatzustand zu untersuchen. Hierfür ist lediglich eine unterschiedliche Probenvorbereitung wichtig. Eine charakteristische Probenvorbereitung bringen feste Proben mit, denn diese werden zu einem Kaliumbromid-Pressling verarbeitet. Dafür wird 1 mg Substanz mit 300mg Kaliumbromid im Mörser fein vermahlen und in einer Presse für circa 2 min verpresst. Hierbei entsteht ein Druck von 10.000 bar, welcher ein Zerfließen der einzelnen Kaliumbromid-Körner mit der Probe ermöglicht. Diese Eigenschaft des kaltfließenden Einbettungsmittels Kaliumbromid ist der Grund warum es unter hohem Druck plastisch wird. Ein klarer, fester Pressling entsteht. 12 13
Detektoren
Die Detektoren in der IR-Spektroskopie wandeln optische Signale bzw. die Infrarot-Strahlung in elektrische Signale um. Sie werden in zwei Gruppen unterteilt:
- Thermische Detektoren 14
- Thermische Detektoren wandeln Wärmeenergie in elektrische oder mechanische Signale um. Der Effekt der Thermospannung wird hier ausgenutzt. Hierfür werden die Änderung der Leitfähigkeit von Metalldrähten durch Einwirken unterschiedlicher IR-Strahlung und der resultierenden Spannung erfasst.
- Pyroelektrische Detektoren 15
- Pyroelektrische Detektoren basieren auf dem pyroelektrischen Effekt. Ferroelektrische Kristalle besitzen ein Dipolmoment, welches bei Erwärmung durch IR-Strahlung eine Veränderung der Polarisation der Kristalle erzeugt. Diese Ladung wird als elektrisches Signal gemessen.
Michelson Interferometer: Das Fourier-Transform-Gerät besitzt ein Interferometer. Das polychromatische Licht der Strahlungsquelle trifft auf einen halbdurchlässigen Spiegel und wird in zwei gleich intensive Strahlen aufgespalten. Ein Teil der Strahlung trifft auf einen festen Spiegel, der andere auf einen beweglichen Spiegel. Beide Strahlen werden im Strahlungsteiler gebündelt und erreichen den Detektor. Besitzen beide Strahlen den gleichen Abstand gegenüber dem Strahlungsteiler, so kommt es zur konstruktiven Interferenz. Die Wellen addieren sich und verstärken sich maximal. Wird der bewegliche Spiegel jedoch verschoben, entsteht ein Gangunterscheid, wodurch eine destruktive Interferenz auftritt. Entspricht nun die Spiegelverschiebung eine Weglängendifferenz von λ/2, kommt es zur maximalen Auslöschung der Lichtintensität. Der Detektor erfasst die in Abhängigkeit einer Weglängendifferenz unterschiedliche Strahlungsintensität. Die gleichförmige Bewegung des Spiegels erzeugt eine zeitabhängige Schwankung der Intensität. Eine Wellenlänge kann somit im Interferogramm einer Zeit geordnet werden.Trägt man die Intensität gegen die Zeit auf, erhält man ein Summen-Interferogramm. Dieses wird durch die Fourier-Transformation in das normale IR-Spektrum überführt.16
Auswertung
Betrachtet man die Auswertung ist im Vorfeld nicht zu missachten, dass im IR-Spektrum nicht die Absorption, sondern die Transmission gegen die Wellenzahl aufgetragen ist. Jede funktionelle Gruppe bzw. chemische Verbindung weist nun ein spezifisches Absorptionsverhalten auf. Dies ist in dem IR-Spektrum klar zu identifizieren, da hier die Absorptionsmaxima als Transmissionminima des Spektrums dargestellt werden. Allgemein lässt sich die Transmission als Quotient aus Lichtintensität nach Verlassen der Probe und der ursprünglichen Lichtintensität beschreiben: T=I/Io.18 Jede Substanz liefert damit ein einzigartiges und charakteristisches IR-Spektrum, was die IR-Spektroskopie im Allgemeinen zu einem der zuverlässigsten Methode zur Identifizierung von Substanzen macht. Die Lage und Intensität jeder Absorptionsbande ist hochspezifisch. Ein klassisches IR-Spektrum reicht von einer Wellenzahl von 4000cm−1 bis 400cm−1. Ab dem Bereich von 1500 cm−1 bis 500−1 erreicht man den Fingerprint-Bereich, in welchem Substanzen hochcharakteristische Muster zeigen. Dort treten Deformationsschwingungen, Valenzschwingung und Gerüstschwingungen von Gruppen mit schweren Atomen auf. Im Übrigen gibt es zahlreiche Vergleichsspektren, die die Identifikation ermöglichen. 19
Für die Charakterisierung der Banden gilt:
Banden bei 4000cm−1 bis 1500cm−1: OH-/NH-Gruppen
Intensive Banden bei 1700 cm−1: Carbonylfunktionen
Banden bei etwas> 3000 cm−1: Ungesättigte Alkene oder Aromaten
Banden bei etwas < 3000 cm−1: Gesättigte Alkane
Schwache, spitze Banden zwischen 2000cm−1 und 2500cm−1: Dreifach oder kumulierte Doppelbindungen
Sägezahnschwingung zwischen 1700cm−1 bis 2500cm−1: Aromaten
Scharfe, starke und schwache Banden zwischen 1450cm−1 - 1650cm−1: Doppelbindungen, Aromaten
Scharfe Banden < 1000 cm−1: Planare Strukturen
Einzelnachweise
1 Instrumentelle Analyt5k (Skript): Optische Methoden-Infrarot-Spektroskopie, Kellner T., 2021, Folie: 5 ⇑
2 eigene Zeichnung ⇑
3 Instrumentelle Analytik (Skript): Optische Methoden-Infrarot-Spektroskopie, Kellner T., 2021, Folie: 7 und 14 ⇑
4 Rücker, G. Neugebauer, M. & Willems, G. G. (2013): Instrumentelle Pharmazeutische Analytik Stuttgart, Germany: Wissenschaftliche Verlagsgesellschaft Stuttgart. Seite: 182 ⇑
5 eigene Zeichnung ⇑
6 Instrumentelle Analytik (Skript): Optische Methoden-Infrarot-Spektroskopie, Kellner T., 2021, Folie: 8 -10 ⇑
7 Rücker, G. Neugebauer, M. & Willems, G. G. (2013): Instrumentelle Pharmazeutische Analytik Stuttgart, Germany: Wissenschaftliche Verlagsgesellschaft Stuttgart. Seite: 184 ⇑
8 Rücker, G. Neugebauer, M. & Willems, G. G. (2013): Instrumentelle Pharmazeutische Analytik Stuttgart, Germany: Wissenschaftliche Verlagsgesellschaft Stuttgart. Seite: 185 ⇑
9 eigene Zeichnung [01.06.2021] ⇑
10 Kellner, Thomas: Skript zum Seminar Instrumentelle Analytik. IR-Spektroskopie. Braunschweig: TUBraunschweig, 2021 S.18 2 ⇑
11 Kellner, Thomas: Skript zum Seminar Instrumentelle Analytik. IR Spektroskopie. Braunschweig: TU Braunschweig, 2021. S.19 ⇑
12 Kellner, Thomas: Skript zum Seminar Instrumentelle Analytik.IR Spektroskopie. Braunschweig: TU Braunschweig, 2021 S.25 ⇑
13 Dominik, Steinhilber, Wurglics et al: Instrumentelle Analytik kompakt. 3. Auflage, Wissenschaftliche Verlagsgesellschaft Stuttgart. 2013 S.100 ⇑
14 http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/3/anc/ir_spek/ir_geraete.vlu/Page/vsc/de/ch/3/anc/ir_spek/ir_spektroskopie/ir_geraetetechnik/ir_8_2_1/thermoir_m35ht0101.vscml.html ⇑
15 http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/3/anc/ir_spek/ir_geraete.vlu/Page/vsc/de/ch/3/anc/ir_ spek/ir_spektroskopie/ir_geraetetechnik/ir_8_2_4/pyro_m35ht0101.vscml.html [01.06.2021] ⇑
16 http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/3/anc/ir_spek/ir_geraete.vlu/Page/vsc/de/ch/3/anc/ir_ spek/ir_spektroskopie/ir_geraetetechnik/ir_8_2_4/pyro_m35ht0101.vscml.html ⇑
18 vgl. Kellner, Thomas: Skript zum Seminar: Instrumentelle Analytik. IR Spektroskopie. Braunschweig. TU Braunschweig, 2021. S.17 ⇑
19 vgl. Kellner, Thomas: Skript zum Seminar Instrumentelle Analytik IR-Spektroskopie. Braunschweig. TU Braunschweig,2021 S.64 ⇑
Monographiebeispiel: Hydrocortisonhydrogensuccinat, Prüfung auf Identität A
Stoffcharakterisierung (Wirkung und Anwendung)
Hydrocortisonhydrogensuccinat (11β,17-Dihydroxy-3,20-dioxopregn-4-en-21-ylhydrogenbutandioat) mit der Strukturformel C25H34O8 ist ein weißes bis fast weißes, hygroskopisches Pulver. Es ist unlöslich in Wasser, leicht löslich in wasserfreiem Ethanol und Aceton, löslich in verdünnten Alkalicarbonat- und Alkalihydroxid-Lösungen. Die Substanz hat eine Molekülmasse von 462,5 und der Gehalt der getrockneten Form liegt zwischen 97,0 bis 103,0 %. Als Schmelztemperatur wird 169 °C bis 173 °C angegeben und der pKa-Wert ist 5,11. Nach intravenöser Injektion der Substanz wird Hydrocortison im Körper gebildet. 2 Wirkung: Hydrocortison ist ein Glucocorticoid, das den Stoffwechsel im Körper beeinflusst. Wenn über längere Zeit eine hohe Menge Glucose zur Verfügung gestellt wird, kommt es zu einem erhöhten Glucocorticoid-Plasmaspiegel, welcher sich einem Diabetes Zustand ähnelt. Ein erhöhter Glucocorticoid-Plasmaspiegel verursacht bei Erwachsenen Osteoporose und bei Kindern verringertes Knochenwachstum. Hydrocortison verhindert den Einbau von Aminosäuren in den Muskel was zur Muskelschwächung führt. Außerdem ist es wichtig für die Wirkung anderer Hormone wie z.B. dem Wachstumshormon und Glukagon. Glucocorticoide unterdrücken in hoher Dosierung die Immunabwehr, indem sie Entzündungsreaktionen lindern. Sie beeinflussen das zentrale Nervensystem welches als Folge psychischer Veränderungen zu beobachten ist. Zusätzlich haben sie auf die Gefäße eine vasokonstriktorische Wirkung. Die Freisetzung von Adrenocorticotropen Hormon (ACTH), Gonadotropin und dem Wachstumshormon können auch dadurch gehemmt werden.
Anwendung: Zur Behandlung einer Vielzahl von Krankheiten wie z.B. Blutkrankheiten, Herzkrankheiten usw. werden Glucocorticoide als Entzündungshemmer eingesetzt. 3
Durchführung der Monographie
Die Prüfung auf Identität der Methode A erfolgt durch die IR-Spektroskopie. Die Probe und Referenzsubstanz werden zuvor 3 h lang bei 100 bis 105 °C trocken gestellt. Die Spektren werden mit Hydrocortisonhydrogensuccinat CRS verglichen. 4

IR-Spektrum von Hydrocortisonhydrogensuccinat in KBr (1,8 mg in 100 mg) 5. -- Die Urheberschaft an dieser Abbildung ist ungeklärt --
Auswertung/ Interpretation/ Bedeutung und Eignung der analytischen Methode
Die IR-Spektroskopie wird zur Identifizierung aller organischen Moleküle verwendet, weil sie ein einzigartiges und charakteristisches IR-Spektrum besitzen. 6 Wenn die Bandenpositionen, deren relativen Größen und der Fingerprintbereich in der Probe mit der von der Referenzlösung übereinstimmen, handelt es sich um die gleiche Substanz. 7
Einzelnachweise
1 Ph. Eur. 10.0/0768 Hydrocortisonhydrogensuccinat ⇑
2 Kommentar zu Ph. Eur. 10.0/0768 Hydrocortisonhydrogensuccinat ⇑
3 Kommentar zu Ph. Eur. 7.0/0335 Hydrocortison ⇑
4 Ph. Eur. 10./0768 Hydrocortisonhydrogensuccinat ⇑
5 Kommentar zu Ph. Eur. 10.0/0768 Hydrocortisonhydrogensuccinat ⇑
6 Instrumentelle Analytik (Skript): Optische Methoden-Infrarot-Spektroskopie, Kellner T., 2021, Folie: 45 ⇑
7 Instrumentelle Analytik (Skript): Optische Methoden-Infrarot-Spektroskopie, Kellner T., 2021, Folie: 48 ⇑
TU-Braunschweig Institut für Medizinische und Pharmazeutische Chemie Seminar: Instrumentelle Analytik Kontakt: tubs@t-kellner.de