Flu
Titelblatt
Expertenbericht zum Praktikumsversuch
Fluorimetrie
WiSe 2021/2022
Abgabedatum
16.12.2021
Expertengruppe 10
Malin Janja Kehl
Imke Lüdemann
Johanna Ohlms
Bestimmung von Riboflavin
Bestimmung der Massenkonzentration an Riboflavin in µg je 100,0 ml.
Inhaltsverzeichnis
Einleitung
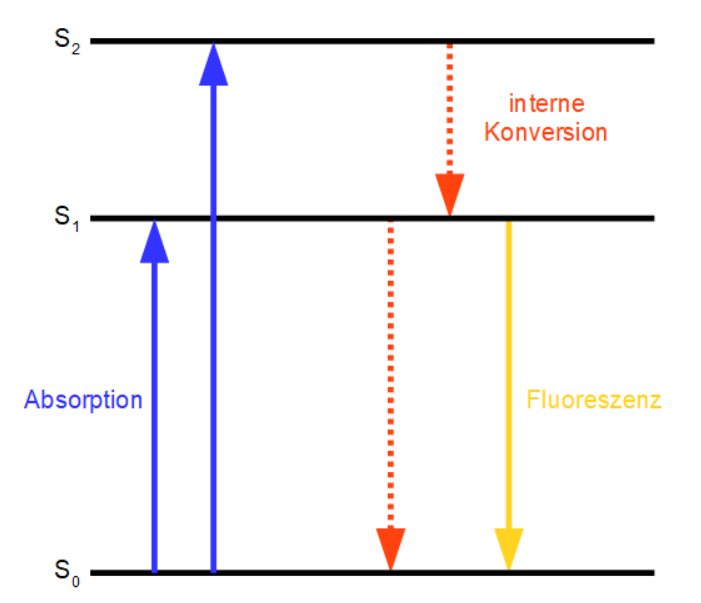
Moleküle und Ionen können elektromagnetische Strahlung absorbieren, wodurch π- und n-Elektronen energetisch angeregt werden (Prinzip der UV/VIS-Spektroskopie). Die aufgenommene Energie wird meistens durch strahlungslose Deaktivierung (interne Konversion) wieder abgegeben, dies erfolgt in Form von Wärme durch Rotationen oder Schwingungen innerhalb des Moleküls. Bei starren, planaren Molekülen wie Aromaten ist dieser Vorgang jedoch erschwert, so dass nach einer teilweisen Energieabgabe in Form von strahlungsloser Deaktivierung die übrige Energie wieder in Form von Photonen als Lichtquanten abgestrahlt werden kann (Fluoreszenz; siehe Jablonski-Termschema (Abb. 1)). Solche Moleküle nennt man Fluorophore. Das emittierte Licht ist energieärmer und besitzt somit eine größere Wellenlänge als das zuvor absorbierte Licht (Stokes-Verschiebung). Die Lichtemission erfolgt ungerichtet in alle Raumrichtungen, so dass die Detektion bei der Fluorimetrie theoretisch in jedem beliebigen Winkel zum eingestrahlten Licht möglich ist. 3
Versuchsbeschreibung
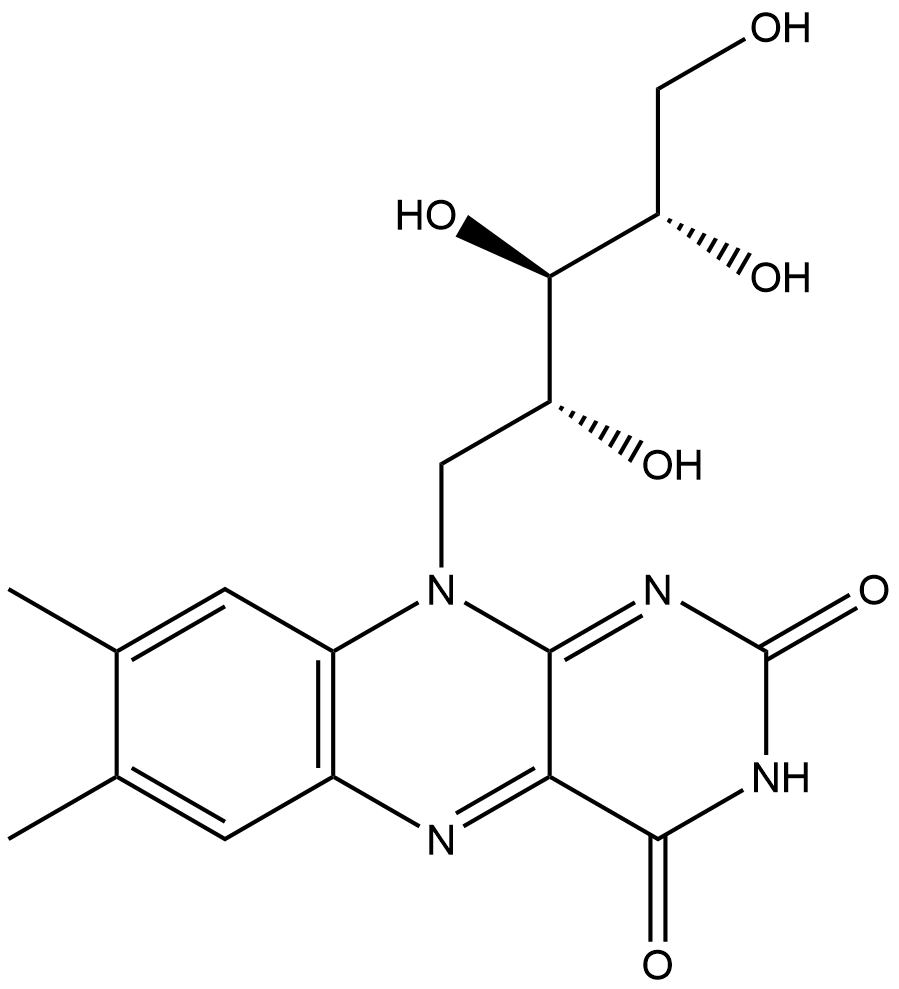
Ziel des Praktikumsversuchs ist es, den Gehalt an Riboflavin (siehe Abb. 2) in der Probe zu bestimmen. Dies ist möglich, da Riboflavin ein großes, konjugiertes Doppelbindungssystem aufweist. Durch seine planare Struktur kann es nur einen Teil der zugeführten Energie über Schwingungen der Atome abgeben. Die Messdaten werden rechnerisch und graphisch mithilfe der Standardadditionsmethode ausgewertet und im Anschluss die Übereinstimmung der Ergebnisse überprüft. Die Standardadditionsmethode dient der Erstellung einer Kalibriergeraden (siehe Abb. 7), mithilfe derer man die Konzentration der Probe graphisch ermitteln kann. Dafür werden drei Lösungen ein Standard bekannter Konzentration (Standard-Stammlösung (6,00 µg/ml)) zugesetzt.4 Dort, wo die entstandene Kalibriergerade die x-Achse schneidet, lässt sich die Konzentration der Probe ablesen (Genaueres dazu in der Auswertung). Die Probenkonzentration soll zwischen 10 und 25 µg/100ml liegen.5
Instrumenteller Aufbau

Abb. 3: schematischer Aufbau eines Einstrahlfluorimeters 6 -- Die Urheberschaft an dieser Abbildung ist ungeklärt --
Zur Messung der Fluoreszenz wird mithilfe eines Fluorimeters das ausgestrahlte Fluoreszenzlicht der Probe in Abhängigkeit der Wellenlänge gemessen. Der Aufbau der optischen Bestandteile eines Fluorimeters ist im Grunde mit dem eines UV/VIS-Spektrometers zu vergleichen.
Für die Lichtquelle werden meist Hochdruck-Gasentladungslampen wie Quecksilberdampf-, Xenon- oder Quecksilber-Xenonlampen verwendet. Quecksilberdampflampen sind Linienstrahler mit einer hohen Intensität, Xenonlampen hingegen sind Kontinuumsstrahler, die aufgrund ihres breiteren Wellenlängenbereichs weniger intensiv strahlen. Die Quecksilber-Xenonlampe ist eine Mischung aus beiden. Bei der Wahl der ausgestrahlten Wellenlänge sollte diese im Bereich des Absorptionsmaximums der zu bestimmenden Substanz liegen. Eine konstante Strahlungsintensität ist erforderlich, da die Fluoreszenzintensität in Abhängigkeit zur Intensität des Anregungslichtes steht. Kommt es zu Schwankungen der Einstrahlungsintensität, so schwankt auch die Fluoreszenz. Dementsprechend lässt sich auch durch Erhöhung der Anregungsintensität die Empfindlichkeit der Messung steigern. Des Weiteren ist ebenfalls die Verwendung von Laserstrahlung möglich, jedoch beschränkt sich diese Strahlung auf einen kleineren Wellenlängenbereich. 7
Die verwendete Küvette hat üblicherweise eine Grundfläche von 1cmx1cm und sollte in zwei Richtungen geeicht sein, da das emittierte Licht im 90° Winkel zur Absorption gemessen wird. 8
Wie es der Abb. 4 zu entnehmen ist, gibt es in einem Fluorimeter neben dem Strahlengang des Spektrometers noch den für das Fluoreszenzlicht. Dieser wird im rechten Winkel zur Einstrahlungsrichtung gemessen, wodurch es zu einer guten Auftrennung der beiden Strahlengänge kommt.
Es werden drei Monochromatoren bei dieser Methode der Emissionsspektroskopie verwendet. Anhand der Abb. 3 lässt sich der folgende beschriebene Aufbau eines Fluorimeters gut nachvollziehen. Der Anregungsmonochromator, der direkt hinter der Lichtquelle ist, wandelt das polychromatische Licht in monochromatisches um, welches dann waagerecht auf die Probe trifft. Im 90° Winkel zur Küvette befindet sich der Emissionsmonochromator. Er dient zur Vorbereitung der Analyse des Fluoreszenzlichtes und Eliminierung von Resten des Anregungslichtes. Diesem folgend ist ein Emissionsdeketor platziert, der das Emissionsspektrum aufzeichnet. Horizontal hinter der Probe befindet sich der Absorptionsmonochromator, der verhindert, dass durch Fluoreszenz ausgestrahlte Wellenlängen zum Absorptionsdetektor durchkommen. Mit dem dahinter in Reihe geschalteten Absorptionsempfänger wird das Absorptionsspektrum detektiert.
Als Detektoren werden Photomultiplier und Photodiodenarray-Detektoren verwendet. Bei einem Photomultiplier schlagen die Photonen durch Auftreffen auf einer Dynode, eine zusätzlich eingebaute Elektrode aus einer Serie von Einzelelektroden, 11 weitere Elektronen heraus und regen diese an. Dadurch steigt die Elektronenzahl von Dynode zu Dynode und das Signal des ersten Photons wird verstärkt. Bei Verwendung eines Photodiorenarray-Detektors wird das eingestrahlte polychromatische Licht durch Auftreffen auf ein Reflexionsgitter in seine Teilstrahlen zerlegt und so detektiert. 12 Dabei können mehrere Wellenlängen gleichzeitig erfasst und ein 3D-Spektrum aufgezeichnet werden. 13 In diesem Praktikum wird die Vermessung der Fluoreszenz mithilfe des Varian Cary Eclipse Einstrahlfluorimeters durchgeführt. 14 In dem Gerät ist als Lichtquelle eine Xenonlampe mit einer Wellenlänge von 365 nm eingebaut und zur Detektion wird ein rot-sensiblerer Photomultiplier mit einer Sensibilität bis zu 900 nm verwendet. 15
Durchführung
Es werden ausschließlich Glasgeräte verwendet, um Quenching (= Fluoreszenzlöschung = Abnahme der Intensität der Fluoreszenz) zu vermeiden.16 Die Probenlösung wird mit demineralisiertem Wasser auf 100,0 ml aufgefüllt.
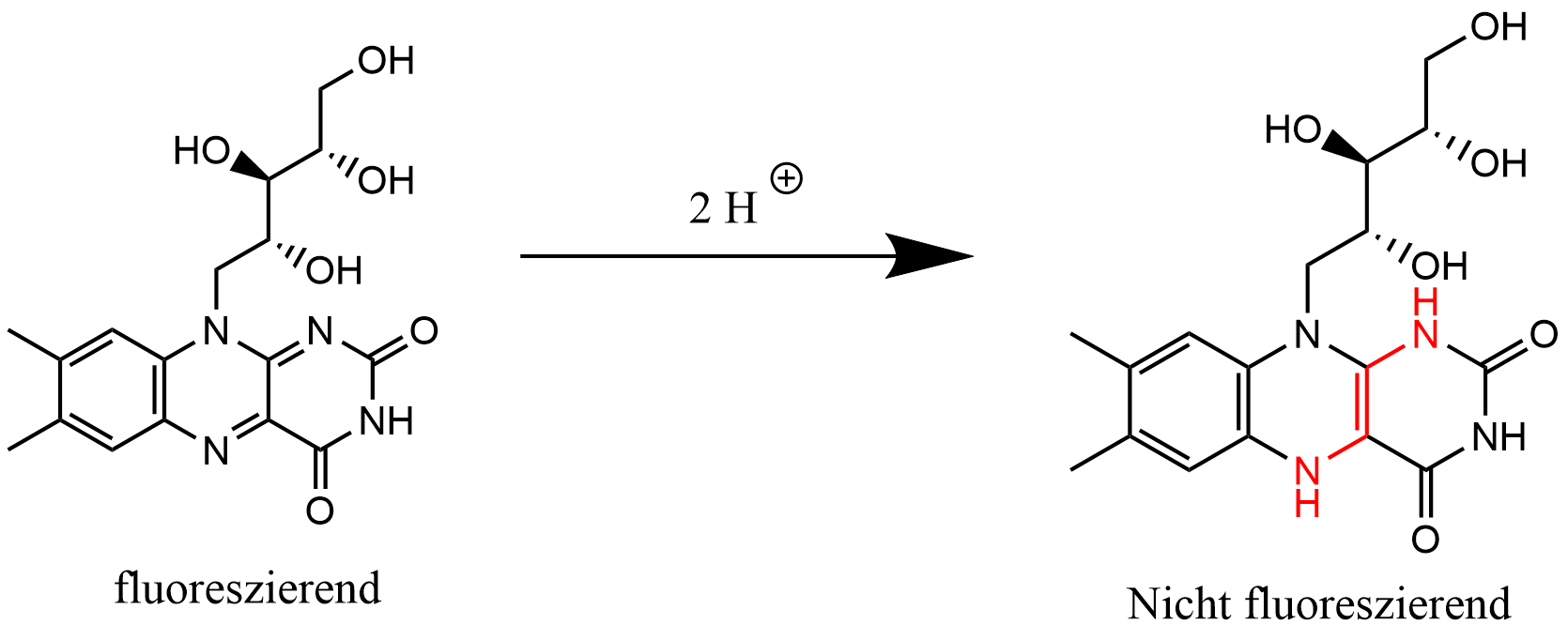
10,0 ml Riboflavin Standard-Stammlösung (6,00 µg/ml) werden mit 50 ml Pufferlösung (pH = 4,6) in einen 100 ml Messkolben aus Braunglas gegeben und mit Wasser auf 100,0 ml aufgefüllt. Es wird ein Braunglaskolben verwendet, da Riboflavin sehr empfindlich ist und unter Lichteinfluss in inaktive Substanzen umgewandelt werden kann. 17 Zudem wird die Pufferlösung eingesetzt, damit das Riboflavin in ungeladenem Zustand vorliegt. Ist es geladen, fluoresziert es nicht und eine hypsochrome (saures Milieu), bzw. bathochrome (alkalisches Milieu) Verschiebung des Fluoreszenzmaximums tritt auf. 18 Anschließend werden vier verschiedene Lösungen für die Standardadditionsmethode wie folgt hergestellt: Für jede Lösung werden 10,0 ml Probelösung entnommen (10 ml Vollpipette) und in ein Reagenzglas pipettiert. Es bietet sich an, die Reagenzgläser spätestens jetzt zu beschriften.
Zu Lösung P werden 3,0 ml Wasser hinzugegeben.
Zu Lösung Add-1 werden 1,0 ml Standardlösung und 2,0 ml Wasser hinzugefügt.
Lösung Add-2 wird mit 2,0 ml Standardlösung und 1,0 ml Wasser hergestellt.
Zu Lösung Add-3 werden 3,0 ml Standardlösung gegeben.
Nochmal übersichtlich:
| Lösung | Probelösung | Standardlösung | Wasser |
|---|---|---|---|
| Lösung P | 10,0 ml | 0,0 ml | 3,0 ml |
| Lösung Add-1 | 10,0 ml | 1,0 ml | 2,0 ml |
| Lösung Add-2 | 10,0 ml | 2,0 ml | 1,0 ml |
| Lösung Add-3 | 10,0 ml | 3,0 ml | 0,0 ml |
Zum Hinzufügen der geringen Volumenmengen (1-3 ml) wird eine Kolbenhubpipette verwendet, da mit dieser, bei richtiger Anwendung, am genauesten gearbeitet werden kann. Jede der vier Lösungen muss zweimal hergestellt werden, sodass am Ende insgesamt mit acht Lösungen gearbeitet wurde. Jedes Reagenzglas sollte nach dem Fertigstellen der Lösungen auf das Mischgerät (Vortex) gedrückt werden. Dieser vermengt durch vibrationsartige Bewegungen die Lösung, ohne viel Luft unterzumischen, da Sauerstoff zu einer Fluoreszenzauslöschung führen kann.
Um die Proben in den Reagenzgläsern vor der Lichteinstrahlung zu schützen, werden sie (immer wenn dies möglich ist) in den Schrank gestellt. Danach wird das Fluorimeter mit Wasser nach der ausliegenden SOP kalibriert. Jede der Lösungen wird (ebenfalls nach SOP) bei 365 nm vermessen. Hierbei handelt es sich um das Licht, das von der Lampe auf die Küvette gestrahlt wird. Die Messwellenlänge im Detektor beträgt 532 nm. Die Messung führt man nur durch einen einzelnen Klick auf "Read" oben in der Mitte des Bildschrims durch. Beim Vermessen der einzelnen Lösungen sollte die Küvette jedes Mal mit der Lösung vorgespült werden, um Verdünnungsfehler zu vermeiden. Wurden alle Lösungen vermessen, wird zu jeder Lösung eine Spatelspitze Natriumdithionit (ca. 20 mg) gegeben. Das Dithionit reduziert das Riboflavin, woraufhin es nicht mehr fluoresziert, da das konjugierte Doppelbindungssystem unterbrochen wird (siehe Abb. 6). Dann kann der Blindwert durch erneutes Vermessen ermittelt werden. Dieser sollte kleiner als 0,2 sein. Insgesamt werden 16 Messungen durchgeführt. 20
Hinweise zur Durchführung
- Allgemein sollte zügig gearbeitet werden, um die Reagenzgläser möglichst wenig Lichteinstrahlung auszusetzen.
- Der korrekte Umgang mit der Kolbenhubpipette sollte vor dem Befüllen der Reagenzgläser bekannt sein. Dafür gibt es auch eine Erklärung im Einführungsvideo und Plakate, die im Labor aushängen.
- Die vier Lösungen (P, Add-1, Add-2 und Add-3) müssen jeweils zweimal hergestellt werden, um eine möglichst hohe Genauigkeit gewährleisten zu können (Doppelbestimmung).
- Die Küvette sollte unbedingt vor jeder Messung gespült werden. Dabei die verwendete Lösung nicht zurück in das Reagenzglas geben.
- Die Küvette muss vor jeder Messung von außen mit einem trockenen Tuch abgewischt werden, sodass sie streifenrei vermessen werden kann. Zudem dürfen keine Luftblasen in der zu vermessenden Lösung sein.
- Da der Detektor im 90°-Winkel zur Probe angeordnet ist, hat die Küvette keine matte Seite zum Anfassen. Sie sollte nur mit Handschuhen und/oder nur am oberen und unteren Ende berührt werden.
- Anfangs muss das Fluorimeter mit Wasser kalibriert werden und dabei der Messwert 0,000 betragen (oben links auf dem Bildschirm). Ab dieser ersten Messung sollte die Küvette immer in gleicher Ausrichtung in die Halterung gesteckt werden (bspw. Aufschrift immer nach links)
- Die Lösungen aus der Küvette müssen zurück in die Reagenzgläser gegeben werden, sonst ist am Ende für die Messung des Blindwertes nicht genügend Lösung übrig.
- Es ist möglich, dass am Ende der Blindwert zu hoch ist. Wenn das der Fall ist, muss weiteres Natriumdithionit hinzugefügt werden, bis der Blindwert weniger als 0,2 beträgt.
Auswertung
Um die Fluoreszenzintensität (⚠ $I_{F}$), die ausschließlich durch Riboflavin verursacht wird, zu ermitteln, wird zunächst bei jeder Probelösung der jeweilige Blindwert (⚠ $I_{F,Bl}$) von der zuvor gemessenen Fluoreszenz der Probe (⚠ $I_{Fg}$) subtrahiert:
⚠ $$ I_{F} = I_{Fg} - I_{F,Bl} ⚠ $$
Anschließend werden die Mittelwerte der Doppelbestimmungen der einzelnen Konzentrationen berechnet.
Die Ermittlung des Riboflavingehaltes in der Probe erfolgt sowohl graphisch als auch rechnerisch.
Graphische Auswertung
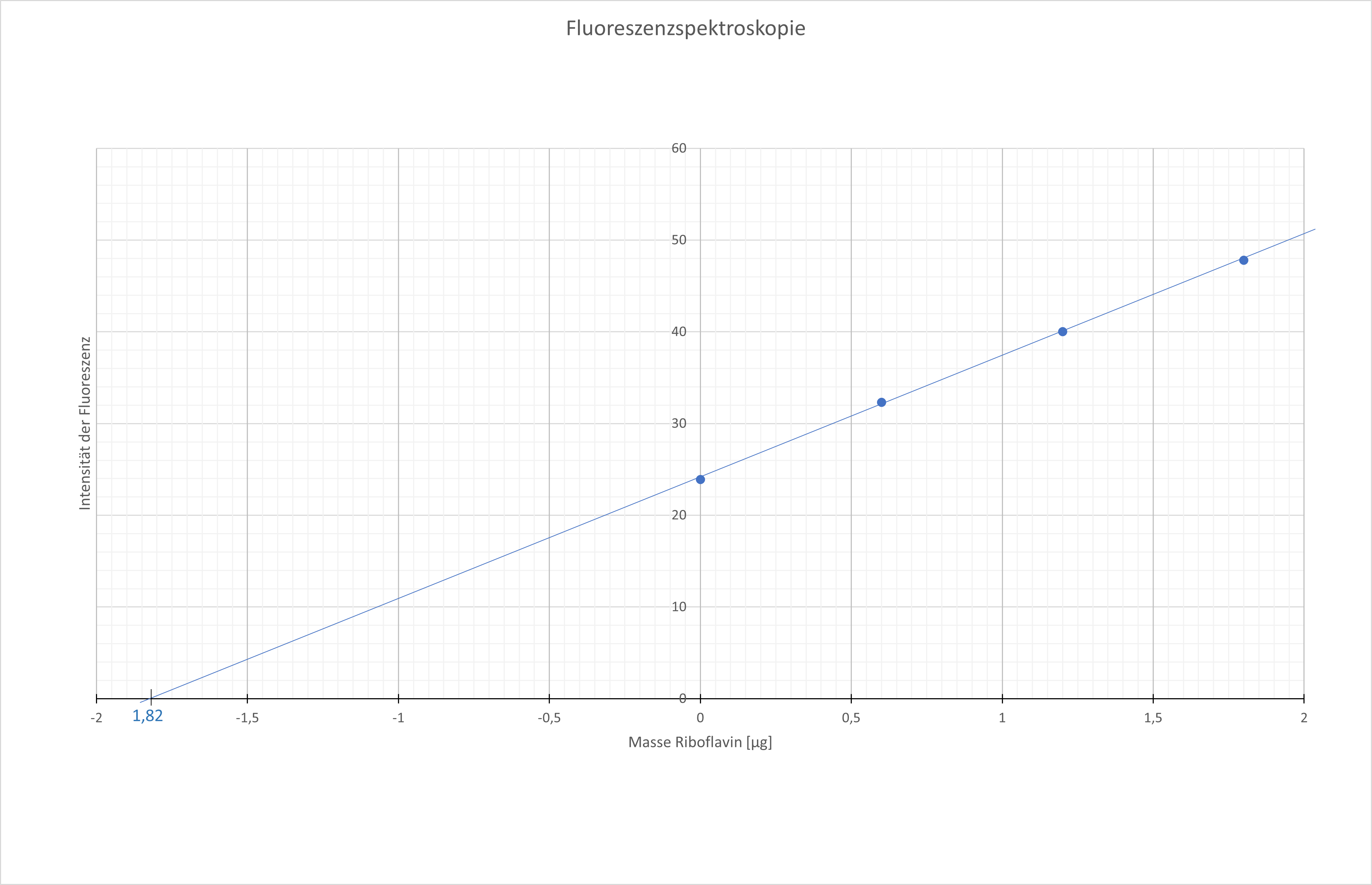
Die Messwerte der Intensität der Fluoreszenz werden in Abhängigkeit von der durch den Standard zugesetzten Masse an Riboflavin in ein Diagramm eingezeichnet, so dass die Fluoreszenz der Probe ohne zugesetzten Standard (x = 0 µg Riboflavin) genau auf der y-Achse liegt.
Durch das Diagramm wird anschließend eine Ausgleichsgerade gelegt, die allen eingezeichneten Punkten möglichst nahe kommen sollte. Im Idealfall würden sämtliche Punkte exakt auf der Gerade liegen, was jedoch in der Praxis aufgrund von (zufälligen und systematischen) Fehlern der verwendeten Geräte und der durchführenden Personen nicht erreicht wird.
Am Schnittpunkt der Gerade mit der x-Achse (y = 0) lässt sich der Gehalt an Riboflavin, der in den einzelnen Lösungen enthalten war, ablesen. Pro Messlösung waren 10 ml Probelösung enthalten, das entspricht 10% der gesamten Probelösung (Gesamtvolumen der Probenlösung: 100 ml). Durch Multiplikation des aus dem Diagramm abgelesenen Wertes mit dem Faktor 10 wird daher die Masse an Riboflavin pro 100 ml erhalten.
Rechnerische Auswertung
Nur für Lösung P, die Messlösung ohne zugesetzten Standard, wird der Mittelwert verwendet; bei allen übrigen Messlösungen erfolgen die Berechnungen jeweils einzeln, so dass erst am Ende daraus der Mittelwert berechnet wird.
⚠ $$ c_{P} = \left(\frac{c_{S}}{\frac{I_{F,Add}}{I_{F,P}} - 1}\right) ⚠ $$
⚠ $c_{P}$ = Konzentration der Probe in µg/10 ml⚠ $c_{S}$ = Konzentration an Riboflavin durch die Standardlösung; diese wird auf das Volumen der in der Messlösung vorhandenen Probelösung bezogen, da hierdurch der Rechenschritt von der Konzentration der Messlösung zur Konzentration der Probelösung eingespart wird
Beispielrechnung:
⚠ $$ c_{P} = \left(\frac{1,2 \mu g/10 ml}{\frac{40,260}{23,904} – 1}\right) = 1,7538 \mu g/10 ml ⚠ $$
Von allen sechs so erhaltenen Werten wird nun der Mittelwert gebildet. Der erhaltene Zahlenwert wird mit 10 multipliziert, um auf die Massenkonzentration in µg/100 ml zu kommen. 22
Vergleich der graphischen und der rechnerischen Auswertung
⚠ $$ \text{%error} = \left(\frac{c_{graph}-c_{rechn}}{c_{graph}}\right) \cdot 100 \text{%} ⚠ $$
Die Ergebnisse der beiden Auswertungsmethoden können mitunter erheblich voneinander abweichen. Dies liegt an einer unterschiedlichen Gewichtung des Wertes der Messlösung P: Bei der rechnerischen Auswertung wird der Messwert von P in jeder einzelnen Berechnung verwendet, da jede Einzelberechnung einer Zweipunktkalibrierung entspricht. Die Ausgleichsgerade bei der graphischen Auswertung wird hingegen möglichst mittig durch sämtliche Werte gelegt, so dass P dort keinen stärkeren Einfluss auf das Ergebnis hat als Add-1 bis 3. Bei einer händischen Erstellung der Ausgleichsgerade ist die graphische Auswertung ungenauer als die rechnerische, da die Zeichnung in diesem Fall weniger genau ist als bei der Verwendung eines Tabellenkalkulationsprogrammes.
Ansage
In die Ansage wird die mathematisch ermittelte Massenkonzentration in µg/10 ml geschrieben, da diese genauer ist als das graphisch ermittelte Ergebnis. Außerdem wird die Abweichung in Prozent angegeben. Beide Angaben werden auf drei signifikante Stellen gerundet. 23
Einzelnachweise
1 eigene Grafik, erstellt mit ChemDraw; Urheber: Johanna Ohlms, 02.12.2021 ⇑
2 eigene Grafik, erstellt mit OpenOffice Writer; Urheber: Johanna Ohlms, 07.12.2021 ⇑
3 Dr. Thomas Kellner: Seminar Instrumentelle Analytik: Fluoreszenzspektroskopie ⇑
5 Dr. Thomas Kellner: Skript Instrumentelle Analytik WiSe- 2021/22 Version 09: (Corona), 22. Oktober 2021, S.48 ff. ⇑
6 Rücker, Neugebauer, Willems: Instrumentelle pharmazeutische Analytik. 4. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft mbH, 2008. S.171 ⇑
7 Dr. Thomas Kellner: Seminar Instrumentelle Analytik: Fluorimetrie, S.14 ⇑
8 Dominik, Steinhilber, Wurglics: Instrumentelle Analytik kompakt. 3. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft mbH, 2013. S.88 ⇑
9 eigene Aufnahme; Urheber: Imke Lüdemann, 08.12.2021 ⇑
10 eigene Aufnahme; Urheber: Imke Lüdemann, 11.11.2021 ⇑
11 https://de.wikipedia.org/wiki/Dynode 16.12.2021 ⇑
12 Rücker, Neugebauer, Willems: Instrumentelle pharmazeutische Analytik. 4. Auflage. Stuttgart: Wissenschaftliche Verlagsgesellschaft mbH, 2008. S.170 ff. ⇑
13 Dr. Thomas Kellner: Seminar Instrumentelle Analytik: UV/VIS-Spektroskopie, S.13 ⇑
14 Dr. Thomas Kellner: Skript Instrumentelle Analytik WiSe- 2021/22 Version 09: (Corona), 22. Oktober 2021, S.49 ⇑
15 https://www.jyu.fi/science/en/chemistry/research/infrastructure/kem/spectrometers/varianeclipse 16.12.2021 ⇑
19 eigene Grafik, erstellt mit ChemDraw; Urheber: Imke Lüdemann ⇑
20 Dr. Thomas Kellner: Skript Instrumentelle Analytik WiSe- 2021/22 Version 09: (Corona), 22. Oktober 2021, S.49 ff. ⇑
21 eigene Grafik; Urheber: Imke Lüdemann, Johanna Ohlms, 11.11.2021, Abb. ⇑
22 Dr. Thomas Kellner: Skript Instrumentelle Analytik WiSe-2021/22, Version 09 (Corona), 22. Oktober 2021, S. 50 f. ⇑
23 Dr. Thomas Kellner: Skript Instrumentelle Analytik WiSe-2021/22, Version 09 (Corona), 22. Oktober 2021, S. 52 ⇑