BABV
Biamperometrie/ Bivoltametrie
Expertenbericht zum Praktikumsversuch
BA/BV
WiSe 2021/2022
Abgabedatum
16.12.2021
Expertengruppe 04
Paulina Bornemann
Femke Nuttelmann
Elisa Engelbert
Bestimmung von Kaliumiodid mit Kaliumiodatlösung
Gehaltsbestimmung durch biamperometrische und bivoltametrische Endpunktbestimmung.
Inhaltsverzeichnis
Einleitung
Die Biamperometrie und die Bivoltametrie gehören zu der Amperometrie und der Voltametrie. Es sind Methoden der Elektrochemie, um chemische Stoffe zu quantifizieren. Die Bivoltametrie ist eine Möglichkeit, anders als bei der Polarographie, eine direkte Titrationskurve während der Titration zu bekommen. Vorausgesetzt wird elektrochemische Aktivität.
Voltametrie
Die Voltametrie ist eine Messung mit konstantem Strom, welcher an einer voltametrischen Zelle angelegt ist ( = galvanostatische Arbeitsweise). Dies hat zur Folge, dass der Anode (Oxidation) und Kathode (Reduktion) Reaktionen aufgezwungen werden. Es bilden sich zwei reversible Redoxsysteme. Während der Titration wird die sich einstellende Zellspannung im Verlauf der Titration gemessen. Diese lässt sich durch eine Titrationskurve darstellen. Die Strom-Spannungskurve erhöht sich während der Titration konzentrationsabhängig. Zu Beginn der Titration ist die Spannung gering, solange Analytionen enthalten sind. Sobald keine freien Ionen des Analyten vorhanden sind, steigt die Titrationskurve sprunghaft an, da der Stromfluss von einem neuen Redoxpaar übernommen wird. Als Messkette werden eine Bezugselektrode und eine Indikatorelektrode verwendet. Hierbei kann als Bezugselektrode die SSE (Silber-Silberchlorid-Elektrode), MSE (Mercurosulfat-Elektrode) oder GKE (Gesättigte Kalomel-Elektrode) verwendet werden. Eine Erklärung zu den Elektroden findet sich im Kapitel Potentiometrie. Als Indikatorelektrode dient eine Platinelektrode. Diese wird je nach angelegtem Strom entweder zur Anode oder Kathode.1 2
Amperometrie
Die Amperometrie beruht auf der Strommessung bei gleichbleibendem Potential und auftretender Polarisation ( = potentiostatische Arbeitsweise). Die konstante Spannung ist abhängig vom elektrochemischen Verhalten der beteiligten Stoffe. Sie muss größer sein als das Halbstufenpotential (welches die halbe Höhe der Depolarisationpotentialstufe ist) der zu bestimmenden Reaktion und im Grenzstrombereich dieser Reaktion liegen. Dabei wird der Diffusionsgrenzstrom gegen das Volumen der zugegebenen Maßlösung gemessen, welcher proportional zur Konzentration des Analyten ist. Der Äquivalenzpunkt wird demnach aus der Änderung der Stromstärke bei gleichbleibender Spannung bestimmt. Auch hier werden als Messkette eine Bezugselektrode (z.B. SSE, MSE oder GKE) und eine Indikatorelektrode (z.B. Platinelektrode) benutzt. Die Reduktion findet an der der Kathode statt und die Oxidation an der Anode, sodass zwei reversible Redoxsysteme gebildet werden. Wenn die Konzentration des Analyten kleiner wird, dann wird auch der Diffusionsgrenzstrom kleiner und der Endpunkt der Titration ist gut ablesbar. 3 4
Sowohl bei der Amperometrie als auch bei der Voltametrie arbeitet man mit zwei verschiedenen Elektroden, einer Bezugselektrode und einer Indikatorelektrode. Bei der Biamperometrie und der Bivoltametrie arbeitet man mit zwei Indikatorelektroden. 5
Bivoltametrie
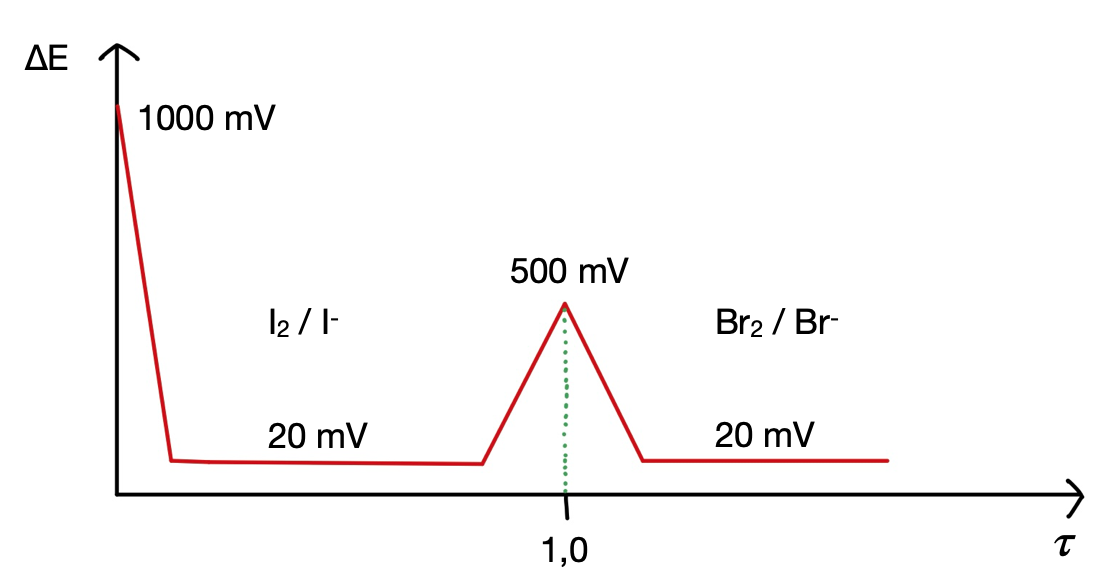
Bei dieser Methode wird eine externe, konstante Stromquelle angelegt und die Spannung während des Versuches gemessen. Als Messkette dient hier eine Doppelplatinelektrode. Zu Beginn ist die Spannung sehr hoch, da die Maßlösung noch nicht hinzugegeben wurde. Nach Zugabe der Maßlösung (Kaliumiodat-Lösung) bildet sich ein reversibles Redoxsystem (I2 / I-), wodurch die Spannung stark sinkt und bis kurz vor dem Äquivalenzpunkt niedrig bleibt. Beim Erreichen des Äquivalenzpunktes steigt die Spannung stark an, da das reversible Redoxsystem nicht mehr vorhanden ist. Durch weitere Zugabe der Maßlösung bildet sich ein zweites reversibles Redoxsystem (Br2/Br-) und die Spannung sinkt wieder stark ab, wodurch der Äquivalenzpunkt gut zu erkennen ist. Dies ist auch in der Bivoltametrischen Kurve gut veranschaulicht.
Biamperometrie
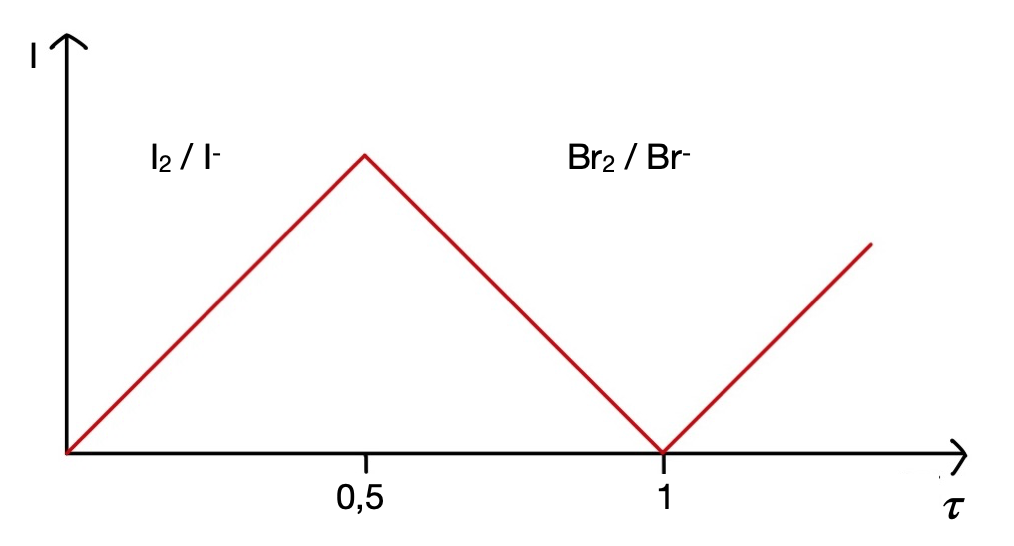
In diesem Verfahren wird eine externe Spannungsquelle angelegt und der entstehende Stromfluss gemessen. Dadurch, dass eine Bezugselektrode fehlt bzw. zwei Indikatorelektroden zum Einsatz kommen, sind die Einzelpotentiale der beiden Elektroden gegenüber der Lösung von außen nicht festgelegt. Es wird nur die Differenz der Einzelpotentiale gegen die Lösung vorgegeben. Die Elektroden werden normalerweise in entgegengesetzter Richtung, aber von der gleichen Stromstärke durchflossen. Die Voraussetzung für das Fließen eines Zellstroms ist, dass es an beiden Elektroden zu einer elektrochemischen Umsetzung kommt. Daher müssen auch im Titrationsgemisch, anders als bei der Amperometrie, zwei elektroaktive Spezies vorhanden sein, sodass ein reversibles Redoxsystem (I2 / I-) entstehen kann. Bei unserem Praktikumsversuch wird aus diesem Grund Kaliumbromid hinzugefügt, damit der Äquivalenzpunkt besser zu erkennen ist. Durch das reversible Redoxsystem kommt es im Verlauf der Titration zu einem Anstieg des Stromflusses. Am Äquivalenzpunkt liegt dann kein reversibles Redoxsystem mehr vor, sodass der Stromfluss wieder auf null sinkt. Nach dem Äquivalenzpunkt bildet sich erneut ein reversibles Redoxsystem aus (Br2/Br-), sodass der Stromfluss wieder ansteigt. Dies ist in der Abbildung Biamperometrische Kurve verdeutlicht.
| eine polarisierbare Elektrode und eine Referenzelektrode | zwei polarisierbare Elektroden | |
|---|---|---|
| potentiostatisch | Amperometrie | Biamperometrie |
| galvanostatisch | Voltametrie | Bivoltametrie |
Unterschied zur Potentiometrie
Bei der Potentiometrie werden zwei Elektroden verwendet. Zum Einen eine Indikatorelektrode und zum Anderen eine Bezugselektrode. Es entsteht eine Potentialdifferenz zwischen den beiden Elektroden, diese kann als Spannung gemessen werden, wobei das Potential der Bezugselektrode gleich bleibt und das der Indikatorelektrode sich ändert. Das Potential kann sich je nach Konzentration ändern. Die Messung erfolgt stromlos, weshalb ein Spannungsmessgerät mit einem hohen Innenwiderstand verwendet wird. Im Gegensatz dazu wird bei der Bivoltametrie ein konstanter Strom zugeschaltet, der sogenannte Polarisationsstrom, und dann die Spannung ermittelt. Diese wird mittels einer Doppelplatinelektrode gemessen. Die entstandene Spannungsdifferenz kann an das Voltmeter übermittelt werden.
Versuchsbeschreibung
Ziel ist es, die Massenkonzentration an Kaliumiodid in der Analysenlösung mithilfe der biamperometrischen und der bivoltametrischen Indikation zu bestimmen. Dies geschieht mit einer Kaliumiodat-Lösung im schwefelsauren Medium. Außerdem soll entschieden und begründet werden, welche Methode besser zur exakten Bestimmung geeignet ist.
Welche Umsetzung findet statt?
Vor dem ÄP: 5 KI + KIO3 + 3 H2SO4 —> 3 I2 + 3 K2SO4 + 3 H2ONach dem ÄP: 10 KBr + 2 KIO3 + 6 H2SO4 —> 5 Br2 + I2 + 6 K2SO4 + 6 H2O
Die reversiblen Redoxsysteme wurden rot markiert.
Instrumenteller Aufbau
Messgerät
Gearbeitet wird mit zwei verschiedenen Messgeräten. Es wird bei der Bivoltamerie mit einem automatisierten Gerät titriert. Bei der Biamperometrie wird mittels eines Dosiergerätes/ einer Handbürette per Hand titriert.
Bivoltametrie
Bei der Bivoltametrie wird mit einem geringen, konstanten Stromfluss gearbeitet.
Die Stromstärke liegt zwischen 0,5 μA und 25 μA. Jedoch wird meistens eine Stärke zwischen 2,5 μA und 5 μA genutzt.
Zum Titrieren wird der Titrino plus 848 und als Messkette eine Doppelplatinelektrode verwendet.
Es wird die entstehende Spannungsdifferenz gemessen und auf dem Voltmeter angezeigt.
Biamperometrie
Bei der Biamperometrie wird zur Dosierung der Maßlösung der Dosimat 665 verwendet.
Dazu kommt noch der Polarizer E 585 und das pH-Meter 620.
In der Abbildung Aufbau der biamperometrischen Titration sieht man links das pH-Meter, hier werden im Laufe der Titration die Skalenteile abgelesen.
In der Mitte befindet sich der Polarizer zum Einstellen der Empfindlichkeit. Rechts ist der Titrino zu sehen, der für die Titration verwendet wird.
Auch bei dieser Titration wird eine Doppelplatinelektrode als Messkette verwendet.
Reagenzien
- Maßlösung: Kaliumiodatlösung 0,02 mol/L
- Zum Auffüllen der Analysenlösung: Schwefelsäure 3 mol/L
- Zur Zugabe in das Titriergefäß für die bessere Erkennung des Äquivalenzpunktes: Natriumbromid 0,1 mol/L. 10
Durchführung
Probenvorbereitung
Die Vorbereitungen sind für die biamperometrische und die bivoltametrische Indikation gleich: Zuerst wird die erhaltene Analysenlösung in einem 200,0 ml Messkolben mit Schwefelsäure (3 mol/L) zu 200,0 ml aufgefüllt. Da die Analysenlösung lichtempfindlich ist, ist es wichtig, sie vor Licht geschützt aufzubewahren (z.B. im Schrank). 25,0 ml dieser Lösung werden dann mithilfe einer Vollpipette in das Titriergefäß (Becherglas) überführt. Dann werden 5,0 ml Natriumbromidlösung (0,1 mol/L) hinzugegeben und ein Rührfisch in das Becherglas gelegt. Die Titration erfolgt mit Kaliumiodatlösung (0,02 mol/L). Der Faktor der Maßlösung wird an dieser Stelle notiert. Jetzt wird der Endpunkt sowohl biamperometrisch als auch bivoltametrisch bestimmt.

Ende der biamperometrischen Titration. Die Bürettenspitze darf nicht in die Probenlösung tauchen.12.
Bei der bivoltametrischen Titration taucht die Bürettenspitze zusammen mit der Elektrode in die Probenlösung ein.
Bei der biamperometrischen Titration taucht nur die Elektrode, nicht jedoch die Bürettenspitze, in die Probenlösung ein.
Bivoltametrische Indikation
Es handelt sich hier um eine automatische Titration. Die Bedienungsanweisungen sind der am Platz ausliegenden SOP zu entnehmen. Wichtig ist, dass das Gerät zu Beginn mit der Maßlösung gespült wird, damit Luftblasen oder andere Verunreinigungen aus dem Schlauch entfernt werden. Bei diesem Versuch wird ein Polarisationsstrom von 5 µA angelegt. Jetzt kann das Becherglas mit der Lösung auf den Magnetrührer gestellt werden. Da es sich um eine automatische Titration handelt werden die Bürettenspitze und die Elektrode in die Lösung eingetaucht. Der Titrierautomat beendet die Titration automatisch nach 5,0 ml Maßlösung und der Drucker druckt die Titrationskurve aus. Dies wird drei Mal durchgeführt und nach jeder Messung müssen die Bürettenspitze und die Elektrode mit destilliertem Wasser gründlich gereinigt werden. Es sollte beim Reinigen darauf geachtet werden, dass nichts von dem ausgefallenen Iod an der Bürette hängen bleibt.
Biamperometrische Indikation

Messgerät zum Ablesen der Skalenteile. Obere Skala (pH-Skala) wird abgelesen und als Skalenteile bewertet. 13.
Bei dieser Methode handelt es sich um eine händische Titration. Zu Beginn müssen die Schläuche entlüftet werden, indem ein leeres Becherglas auf den Magnetrührer gestellt wird und mit Hilfe der Handbürette für kurze Zeit Kaliumiodatlösung durch die Schläuche gespült wird. Danach muss das Volumen der Maßlösung mit dem Knopf "FILL" wieder auf 10,0 ml aufgefüllt werden.
Eine Polarisationsspannung von 20 mV wird angelegt. Der Magnetrührer wird angestellt und am Polarizer wird zu Beginn des Versuchs eine Empfindlichkeit von 5 µA/1000 mV eingestellt. Nun kann mit der Handbürette die Kaliumiodatlösung hinzugegeben werden.
Im Gegensatz zur automatischen Titration darf die Bürettenspitze nicht in die Lösung eintauchen.
Nach kurzer Zeit schwankt der Zeiger, der die Skalenteile anzeigt, hoch, woraufhin der Polarizer auf 50 µA/1000mV gestellt werden soll. Es wird weiter titriert, bis sich der Zeiger von 14 Skalenteilen runter bewegt, um danach schrittweise die Empfindlichkeit des Polarizers zu erhöhen (20 µA/1000 mV und 10 µA/1000 mV). Bei jeder „Empfindlichkeitsstufe“ wird der Vorgang zuvor wiederholt: Maßlösung wird hinzugegeben bis der Zeiger weniger als 14 Skalenteile anzeigt und die Empfindlichkeit danach erhöht.
Kurz bevor der Äquivalenzpunkt erreicht wird, kann die Empfindlichkeit auf 5 µA/ 1000 mV eingestellt werden. Jetzt kann in 0,02 ml Schritten Maßlösung hinzugefügt werden. Dies wird dosiert, indem nicht mehr mit der "Fernbedienung" titriert, sondern auf das „GO“ am Dosimaten gedrückt wird. Die auf der Skala abgelesenen Werte sollten ab diesem Moment notiert werden. Es werden die Werte aufgeschrieben, sobald der Zeiger sieben Skalenteile unterschreitet, bis zu dem Moment, bis er sieben Skalenteile wieder überspringt. Zwischendurch fällt der Zeiger Richtung 0 und steigt dann wieder (siehe Biamperometrische Titrationskurve)
Beim Ablesen ist es wichtig, dass von der oberen Skala abgelesen wird und darauf geachtet wird, genau vor dem Zeiger zu stehen. Um ein ungenaues Ablesen zu verhindern, sollte das Spiegelbild des Zeigers in der Skala mit dem Zeiger übereinstimmen. Andernfalls kommt es zu falschen Messwerten.
Der Versuch wird noch zwei Mal wiederholt. Zwischen den Versuchen muss die Elektrode mit destilliertem Wasser gereinigt werden und mit der Taste „FILL“ die Kaliumiodatlösung wieder aufgefüllt werden.14
Entsorgung
Alle Lösungen werden am Ende im Behälter für wässrige Waschflüssigkeit entsorgt.
Mögliche Fehler
- Nicht korrektes Auffüllen des Messkolbens
- Falscher Umgang mit Pipetten
- Übertitrieren per Hand (BA)
- Falsches Ablesen der Skalenteile (BA)
- Hier ist vor allem darauf zu achten, dass der Zeiger sich erst einpendeln muss und nicht zu früh abgelesen wird.
- Spiegelbild des Zeigers sollte mit dem Zeiger übereinstimmen
Deshalb ist die biamperometrische Titration generell fehleranfälliger.
Auswertung
| Formelzeichen | Bedeutung |
|---|---|
| m | Masse |
| M | Molare Masse |
| c | Konzentration |
| k | Stöchiometrisches Verhältnis |
| V | Volumen |
| f | Faktor der Maßlösung |
| β | Massenkonzentration |
Bivoltametrische Indikation
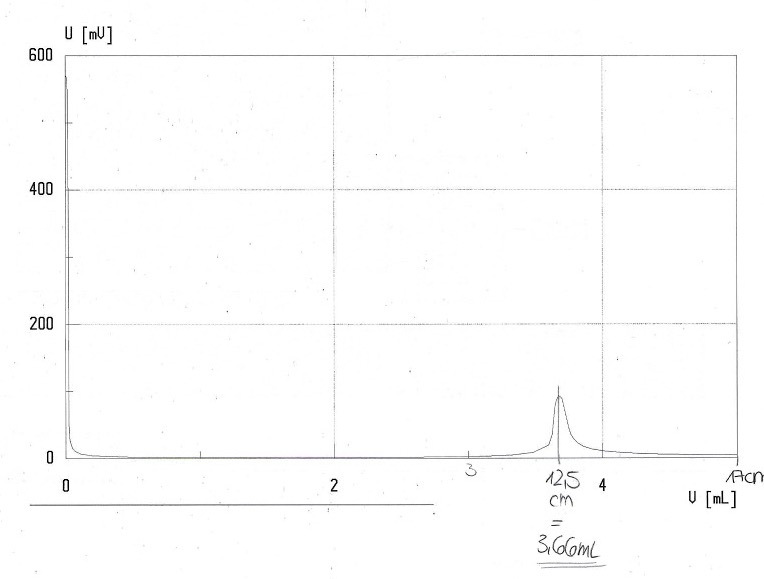
Bei der bivoltametrischen Titration wird ein Graph ausgedruckt, da die Titration mit dem Titrino durchgeführt wurde. Es wird nicht direkt die Menge der Maßlösung angezeigt. Diese muss mithilfe des Graphen bestimmt werden. Da der Drucker den Maßstab nicht jedes Mal genau gleich druckt, wird hier zuerst die Länge bis zu den 5,0 ml Maßlösung (also die ganze Länge der x-Achse) ausgemessen. Dann misst man die Länge bis zum Äquivalenzpunkt aus. Dies wird erleichtert, wenn ein Lot gefällt wird.
Jetzt lässt sich der Verbrauch der Maßlösung durch den Dreisatz errechnen.
- Berechnung des Maßlösungsverbrauchs am Äquivalenzpunkt:
⚠ $$\text{Maßlösungsverbrauch bis zum ÄP}=\left(\frac{\text{ Strecke bis zum Äquivalenzpunkt (cm)}*5ml}{\text{ Strecke bis 5,0 ml Verbrauch (cm)}}\right) \ ⚠ $$
- Diese Berechnung wird für alle drei Titrationen durchgeführt.
- Anschließend kann dann die Masse berechnet werden:
⚠ $$ m(KI)= \left(\frac{M(KI)*c(KIO_3)*k(KI)}{k(KIO_3)} *V(KIO_3)*f(KIO_3)\right) \ ⚠ $$
- Hier kann der Wert k jeweils in der Reaktionsgleichung abgelesen werden, er beträgt für KI 5 und für KIO3 1
- Nach der Berechnung der Masse folgt die Berechnung der Massenkonzentration:
⚠ $$\beta (KI)=\left(\frac{\text{Masse in mg}* 100ml} {25 ml}\right) \ ⚠ $$
- Zum Schluss wird ein Mittelwert ermittelt.
- Dafür werden alle drei ermittelten Massenkonzentrationen (mg/100ml) addiert und anschließend durch 3 geteilt.
Dieser Wert wird später für die Ansage und das Ergebnis benötigt.
Biamperometrische Indikation
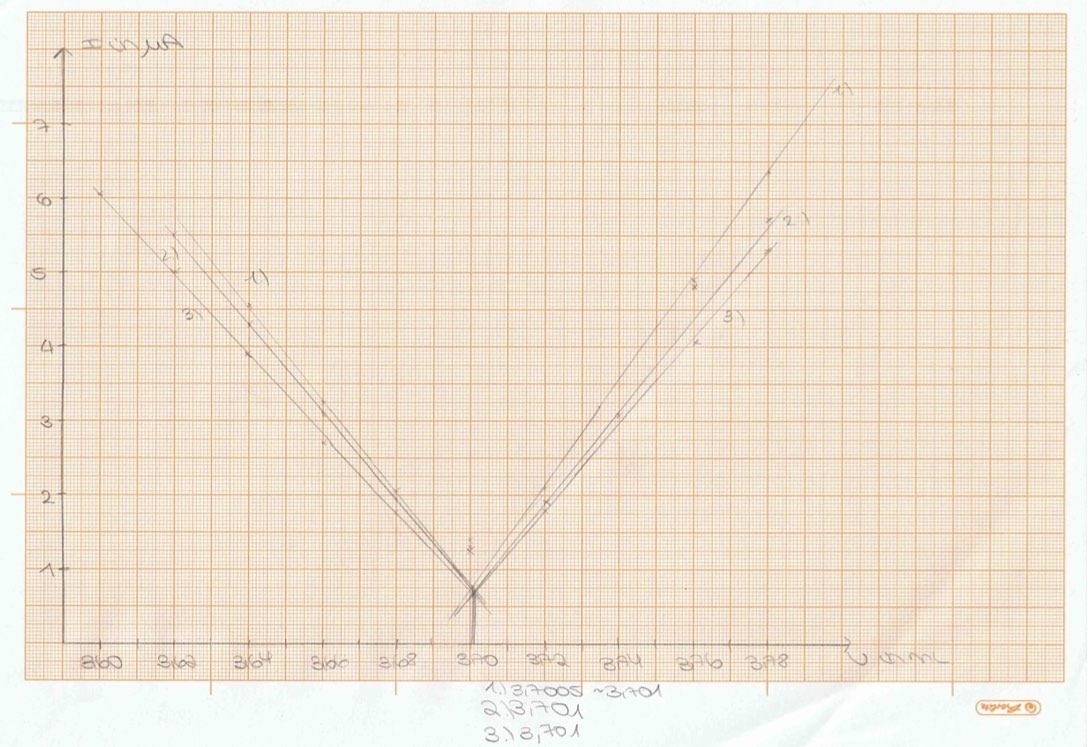
Ausgewertete biamperometrische Titrationskurven. Alle drei Titrationskurven wurden auf ein Blatt aufgetragen, um bessere Vergleiche ziehen zu können. 16.
Bei der biamperometrischen Indikation wurden während des Versuchs die Skalenteile und die jeweils verbrauchte Maßlösung notiert. Es ist sinnvoll, sich eine Tabelle mit 3 Spalten anzulegen (Verbrauch Maßlösung, Skalenteile, Stromstärke), um die Werte übersichtlicher zu erkennen. Jetzt werden die Skalenteile im Dreisatz in µA umgerechnet. Dabei ist davon auszugehen, dass 10 Skalenteile 5 µA entsprechen.
Die errechneten Werte werden danach gegen den Verbrauch der Maßlösung auf dem Millimeterpapier aufgetragen.
Bei dem Graph wird auf der y-Achse der Strom in µA aufgetragen, (dieser wurde zuvor im Dreisatz errechnet) und auf die x-Achse der Verbrauch der Maßlösung in ml.
Es bietet sich auch die Möglichkeit an, die Werte in einer Excel-Tabelle einzutragen, da diese genauer ablesbar sind. Außerdem kann es nicht zu Fehlern durch falsches Eintragen auf dem Millimeterpapier kommen. Bei der Excel-Variante ist es sinnvoll, sich zwei Ausgleichsgeraden zu legen, deren Funktionen gleichzusetzen und so den genauen Schnittpunkt zu errechnen. Durch dieses Verfahren kann das Volumen genau bestimmt werden.
Die ermittelten Werte der drei Titrationen werden notiert und die Masse anhand dieser errechnet.
Hier wird genauso vorgegangen wie bei der bivoltametrischen Indikation.
- Die Masse
⚠ $ m(KI) $wird durch folgende Gleichung beschrieben.
⚠ $$ m(KI)= \left(\frac{M(KI)*c(KIO_3)*k(KI)}{k(KIO_3)} *V(KIO_3)*f(KIO_3)\right) \ ⚠ $$
- Nach der Berechnung der Masse folgt die Berechnung der Massenkonzentration:
⚠ $$ \beta(KI)= \left(\frac{\text{Masse in mg}* 100ml} {25 ml}\right) \ ⚠ $$
- Zum Schluss wird ein Mittelwert ermittelt.
- Dafür werden alle drei ermittelten Massenkonzentrationen (mg/100ml) addiert und anschließend durch 3 geteilt.
Auch dieser Wert wird später für die Ansage und das Ergebnis benötigt.
Ansage
Bei der Ansage soll die Massenkonzentration β des Kaliumiodids in mg je 100,0 ml auf drei signifikante Stellen gerundet angegeben werden. Zudem sind mindestens zwei ausgewertete Titrationskurven der bivoltametrischen Titration und die ausgewerteten biamperometrischen Titrationskurven auf dem Millimeterpapier oder als Graph in einer Excel-Datei abzugeben. Außerdem ist ein schriftlicher Vergleich der beiden Methoden hinzuzufügen. 17
Vergleich der beiden verwendeten Methoden
Die beiden Methoden lassen sich sehr gut anhand ihrer Titrationskurven vergleichen. Bei der Bivoltametrie wird ein externer Polarisationsstrom von 5 μA angeschlossen, wodurch dann die Spannung in diesem System gemessen wird. Man hat zu Beginn eine sehr hohe Spannung, welche jedoch schnell abfällt wenn die Kaliumiodat-Lösung hinzugegeben wird. Es bildet sich ein reversibles Redoxsystem von I2 / I-. Beim Erreichen des Äquivalenzpunktes kommt es wieder zu einem hohen Spannungsanstieg, da nun kein reversibles Redoxsystem mehr vorliegt sondern I2/Br-. Nach dem Äquivalenzpunkt kommt es zum Spannungsabfall, da sich ein zweites reversibles Redoxsystem ausgebildet hat (Br2/Br-). Durch Ablesen des Verbrauches an Maßlösung (Kaliumiodat-Lösung, 0,02 mol/L ) am Äquivalenzpunkt, kann die Kurve ausgewertet werden.
Bei der Biamperometrie wird eine externe Polarisationsspannung von 20 mV angeschlossen und der Strom gemessen.
Zu Beginn der Titration fließt noch kein Strom. Erst wenn die Kaliumiodat-Lösung zugegeben wird, wird ein Strom gemessen. Es bildet sich auch hier ein reversibles Redoxsystem von I2 / I- . Am halben Äquivalenzpunkt (τ = 0,5) ist der maximale Strom erfassbar. Danach sinkt der Strom wieder auf 0 mV, da kein reversibles Redoxsystem mehr am Äquivalenzpunkt vorhanden ist. Nach dem Äquivalenzpunkt steigt der Strom wieder, da sich auch hier ein zweites reversibles Redoxsystem gebildet hat (Br2/Br-).
Zu Beachten ist, dass der Äquivalenzpunkt bei der Biamperometrie ein Minimum ist. Bei der Bivoltametrie hingegen ist er ein Maximum!
Die Auswertung erfolgt graphisch über eine eigene Titrationskurve.
Die Biamperometrie ist die ungenauere Titration, da es hier mehr Fehlerquellen gibt. Zum Einen, da die Titration händisch durchgeführt wird und zum Anderen, weil die Titrationskurve selbst gezeichnet wird. Die Bivoltametrie ist dagegen in beiden Fällen automatisch, sodass die Fehlerwahrscheinlichkeit sinkt.
Einzelnachweise
1 Instrumentelle Analytik kompakt-Dominik, Steinhilber, Wurglics (3.Auflage) ⇑
2 Instrumentelle pharmazeutische Analytik- Rücker,Neugebauer, Willems (5.Auflage) ⇑
3 Instrumentelle Analytik kompakt-Dominik, Steinhilber, Wurglics (3.Auflage) ⇑
4 Instrumentelle pharmazeutische Analytik- Rücker,Neugebauer, Willems (5.Auflage) ⇑
5 Vorlesung "Einführung in die Instrumentelle Analytik" von Dr. Oliver Orban ⇑
6 Erstellt von Paulina Bornemann ⇑
7 Erstellt von Paulina Bornemann ⇑
8 Bild fotografiert von Paulina Bornemann, am 23.11.2021 ⇑
9 Bild fotografiert von Paulina Bornemann, am 23.11.2021 ⇑
10 Praktikumsskript "Instrumentelle Analytik" WiSe-2021/22 (Version 09) von Dr. Thomas Kellner, S. 31ff ⇑
11 Bild fotografiert von Femke Nuttelmann, am 24.11.2021 ⇑
12 Bild fotografiert von Femke Nuttelmann, am 24.11.2021 ⇑
13 Bild fotografiert von Paulina Bornemann, am 23.11.2021 ⇑
14 Praktikumsskript "Instrumentelle Analytik" WiSe-2021/22 (Version 09) von Dr. Thomas Kellner, S. 31ff ⇑
15 Titration im Praktikum, Ausgewertet von Paulina Bornemann ⇑
16 Titration im Praktikum, Auswertung von Annika Behrens ⇑
17 Praktikumsskript "Instrumentelle Analytik" WiSe-2021/22 (Version 09) von Dr. Thomas Kellner, S. 31ff ⇑