AAS
Praktikumsversuch F-AAS/F-AES
Expertenbericht zum Praktikumsversuch
F-AAS/-AES
WiSe 2021/2022
Abgabedatum
15.12.2021
Expertengruppe 14
Jule van de Mötter
Zoe Michelle Stengel
Nadine Bähre
Bestimmung von Na, K, Ca & Mg in einer Hämodialyselösung (F-AAS/-AES)
Inhaltsverzeichnis
Einleitung
Die atomspektrometrischen Methoden, welche in diesem Praktikumsversuch Anwendung finden, dienen zur qualitativen und quantitativen Analyse chemischer Elemente, insbesondere von Metallen und Halbmetallen. 1 Mit einer geringen Nachweisgrenze von unter 1 ppm sind die Atomabsorptionsspektroskopie (AAS) bzw. -emissionsspektroskopie (AES) nicht nur hochempfindlich und werden deshalb auch in der Spurenanalytik eingesetzt, sondern auch extrem schnell. Dem zugrundeliegend muss die Probe zunächst atomisiert werden, wofür verschiedene Verfahren Anwendung finden können. Das Prinzip der AES ist die Vermessung der für jedes Element charakteristischen Energie in Form der Emission. Anhand dessen und der Emissionsintensität kann das zugrundeliegende Element qualifiziert und quantifiziert werden. 2 In der AAS hingegen wird die Absorption von Licht durch die Atome zur Qualifizierung und Quantifizierung herangezogen.
Versuchsbeschreibung
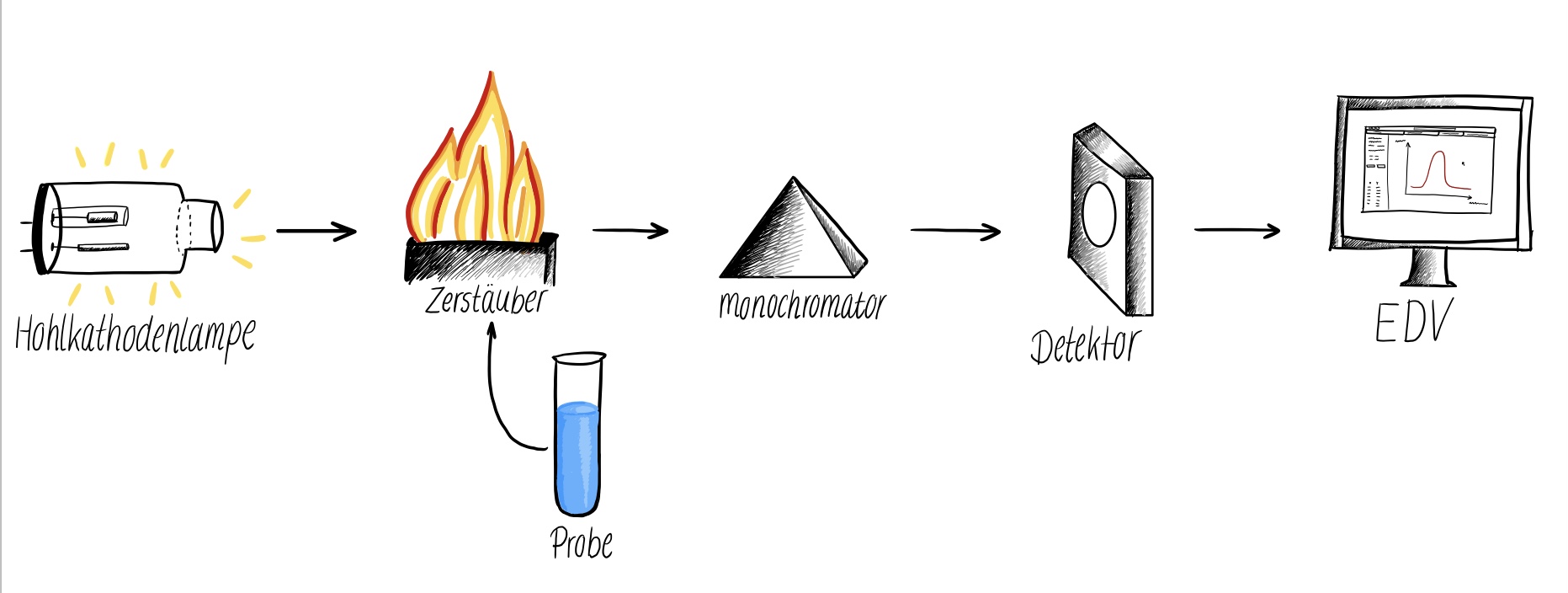
Abb.1 - AAS Schematischer Aufbau;
AES: es wird keine Lichtquelle benötigt 3
In Aufgabenteil a) des folgenden Versuchs soll der Gehalt an Calcium und Magnesium, Kalium und Natrium in einer Hämodialyselösung bestimmt werden. Ziel ist es, herauszufinden, ob die Hämodialyselösung den Anforderungen des Arzneibuchs entspricht.
In Aufgabenteil b) soll ermittelt werden, ob die ausgegebene Ca-Probe einen Ionisationspuffer enthält. Der Ionisationspuffer soll Ionisationsstörungen verringern, welche das Messsignal herabsetzen würden.
Hierfür wird die Flammen-AES bzw. Flammen-AAS-Technik verwendet. Die gelöste Probe wird dabei zunächst in einem speziellen Zerstäubergefäß in ein Aerosol überführt und anschließend in der Flamme thermisch atomisiert, zerfällt also in einzelne Atome. Der Gehalt an Calcium und Magnesium wird mittels der Atomabsorptionsspektrometrie und einer Hohlkathodenlampe bestimmt. Detektiert wird hier, wie viel des eingestrahlten Lichtes einer bestimmten Wellenlänge durch das zu messende Element absorbiert wurde. Zusätzlich wird der Gehalt an Natrium und Kalium mithilfe der AES ermittelt. Hier entfällt die Verwendung einer Lichtquelle. 4 (s. Abb. 1)
Instrumenteller Aufbau (Abb. 2)
Das Analytik Jena Zeenit 700 ist ein Atomabsorptionsspektrometer, das sich aus mehreren Komponenten zusammensetzt.
Es beginnt mit der Strahlungsquelle, der Hohlkathodenlampe (s. Abb. 3). Diese ist immer elementspezifisch. Bei der atomemissionsspektrometrischen Messung wird diese nicht benötigt. Daraufhin folgt das Probenrack in welches die Proben gestellt werden. Anschließend wird die Probe vom Gerät aufgenommen, zerstäubt und durch den Flammenatomisator (hier: Luft-Acetylen-Flamme) mit einer Deuterium-Untergrundkorrektur atomisiert werden. Der Brennerwinkel bestimmt die Schichtdicke und nimmt somit Einfluss auf die Extinktion. Für die spektrale Isolierung einer bestimmten Wellenlänge aus den einfallenden elektromagnetischen Strahlungen wird ein Monochromator eingesetzt. Es folgt schließlich der Photodetektor, welcher die Strahlung vermisst und in Form von Signalen die Informationen zur elektronischen Datenverarbeitung, auf den PC, weiterleitet. 7
Durchführung
Reagenzien & Geräte
Folgende Reagenzien stehen zur Verfügung:
Folgende Geräte werden benötigt:
Versuchsvorbereitung
Untersuchungslösung vorbereiten (Abb.4)
Zunächst wird die Untersuchungslösung in einem 100,0 ml Messkolben mit destilliertem Wasser aufgefüllt. Calcium und Magnesium werden ohne weitere Verdünnungen gemessen. Aufgrund der höheren Schichtdicke der Natrium- und Kaliumatome und der daraus folgenden erhöhten Extinktion ist eine Verdünnung notwendig um exakte Messergebnisse zu erhalten. Für die Kalium-Vermessung werden 15,0 ml von der Untersuchungslösung mit einer Vollpipette entnommen und in einem Messkolben mit Salpetersäure ( ω (HNO3) = 1 %) zu 100,0 ml verdünnt. Zuletzt wird für die Bestimmung von Natrium von der Kalium-Verdünnung 1,0 ml mit Hilfe der Eppendorf-Pipette entnommen und in einem 50,0 ml Messkolben mit Salpetersäure (ω (HNO3) = 1 %) aufgefüllt.
Prinzipiell ist es wichtig, hier auf das richtige Pipettieren und Auffüllen der Messkolben zu achten, um die richtigen Messwerte zu erhalten. Dies wird im Basics-Versuch zu Beginn des Praktikums gelehrt. 9
Herstellen der Referenzlösungen zur Kalibrierung
Für Natrium wird die 3-Punkt-Kalibrierung durchgeführt, wobei die Referenzlösungen hergestellt werden müssen. Hierbei wird von der 100 ppm Na-Stammlösung für die 5 ppm Referenzlösung 5,0 ml, für die 10 ppm Referenzlösung 10,0 ml und für die 15 ppm Referenzlösung 15,0 ml entnommen und jeweils in 100,0 ml Messkolben gefüllt. In die Messkolben werden jeweils 1,0 ml Ionisationspuffer und 1,0 ml konzentrierte Salpetersäure hinzugegeben und mit destilliertem Wasser auf 100,0 ml aufgefüllt (abweichend vom Praktikumsskript). Bei Calcium, Kalium und Magnesium wird eine 5-Punkt-Kalibrierung durchgeführt. Die Stammlösungen mit 100 ppm Calcium, 20 ppm Magnesium und 20 ppm Kalium sind bereits vorbereitet. Das Gerät mischt die Referenzlösungen selber, wobei vorher die optimalen Kalibrierbereiche zwischen dem 0,7 und dem 1,3-fachen des erwarteten Gehalts errechnet werden. Außerdem werden hierzu die Mischverhältnisse von Stammlösung und Verdünnungslösung (1% Ionisationspuffer, Salpetersäure (ω = 1%), 130 mmol/l NaCl) errechnet. Die Rechnungen sind schon vor Beginn des Praktikums durchzuführen und werden anschließend von der Praktikumsbetreuung kontrolliert. 11
Durchführung des Versuchs
Die ausgelegte detailreiche SOP hilft bei den einzelnen Schritten der Vermessungs-Durchführung. Hierbei sind nur die gelb hinterlegten Schritte selbst durchzuführen. Die Eingaben in der Software werden nach Eingabe von der Praktikumsbetreuung kontrolliert.
Zunächst findet eine Lampeneinbrennzeit von 5 min. statt. Danach werden die einzelnen Konzentrationen der Referenzlösungen in das System eingepflegt. Die Flamme steht zu Beginn der Calcium-Messung senkrecht nach vorne und wird vor der Messung der weiteren Metalle um 90° vom Assistenten gedreht. Bei hoher Temperatur (Flamme senkrecht) werden Ionisationsstörungen begünstigt, was prinzipiell verhindert werden soll. Ausnahme ist die Vermessung von Calcium. Hier wird die senkrechte Position der Flamme bevorzugt, um deutlicher zu erkennen, ob die Probe einen Ionisationspuffer enthält. Allgemein sollte die Flamme möglichst nicht flackern sondern gleichmäßig brennen.
Die Proben werden in die vorhergesehen Positionen eingesetzt, die zuvor im Gerät notiert wurden. Um hierbei Fehler zu vermeiden, bietet es sich an, die Positionen beim Eintragen in den PC niederzuschreiben. Bei dem Einsetzen der Probenröhrchen (s. Abb. 5) ist zu beachten, dass der Probenteller nicht verrückt wird.
Begonnen wird mit Calcium, wobei auch direkt die herausgegebene Calciumprobe mit dem Gehalt von 0,7 mmol/l vermessen wird, um herauszufinden, ob sich ein Ionisationspuffer in der Probe befindet (Aufgabenteil b). Hintergrund dabei ist, dass Alkali- und Erdalkalimetalle zu einem hohen Prozentsatz Ionen bilden und somit das Messsignal erniedrigen. Wenn also das (nahezu) gleiche Messsignal bei den beiden Proben zu sehen ist, erschließt sich sofort, dass die Probe einen Ionisationspuffer beinhaltet.
Für Magnesium wird die Lampe automatisch gewechselt, da die Hohlkathodenlampe stets mit dem zu untersuchenden Stoff ausgekleidet ist und sich praktisch selbst verbraucht.
Anschließend wird Kalium und zuletzt Natrium vermessen. Hier findet keine Verwendung einer Lampe statt, da die Emission, nicht aber die Absorption, gemessen wird!
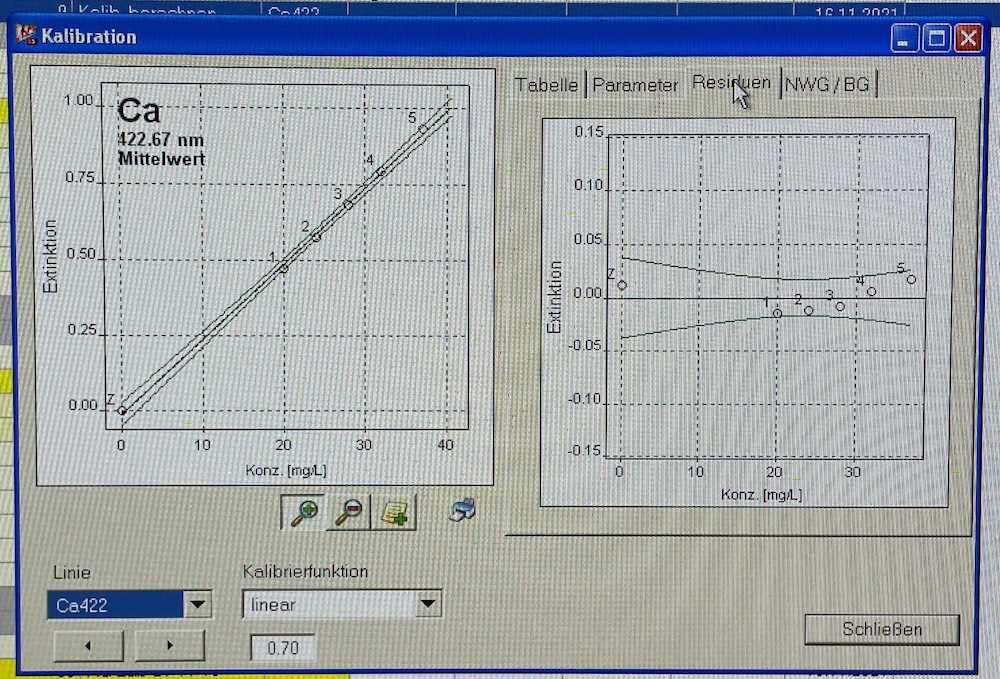
Nach den einzelnen Messungen werden die jeweiligen Kalibriergeraden mit den zugehörigen Parametern angezeigt. Hierbei sollte darauf geachtet werden, dass die einzelnen Punkte sich innerhalb des Prognoseintervalls befinden (s. Abb. 6). Ausreißer können an dieser Stelle entfernt werden.
Auswertung
Wichtig für das Analysenergebnis:
Aufgabenteil a)
In diesem Aufgabenteil wird der Gehalt der Analyten ermittelt und mit den Anforderungen des Arzneibuches verglichen.
Bestimmung der Konzentration in mmol/l
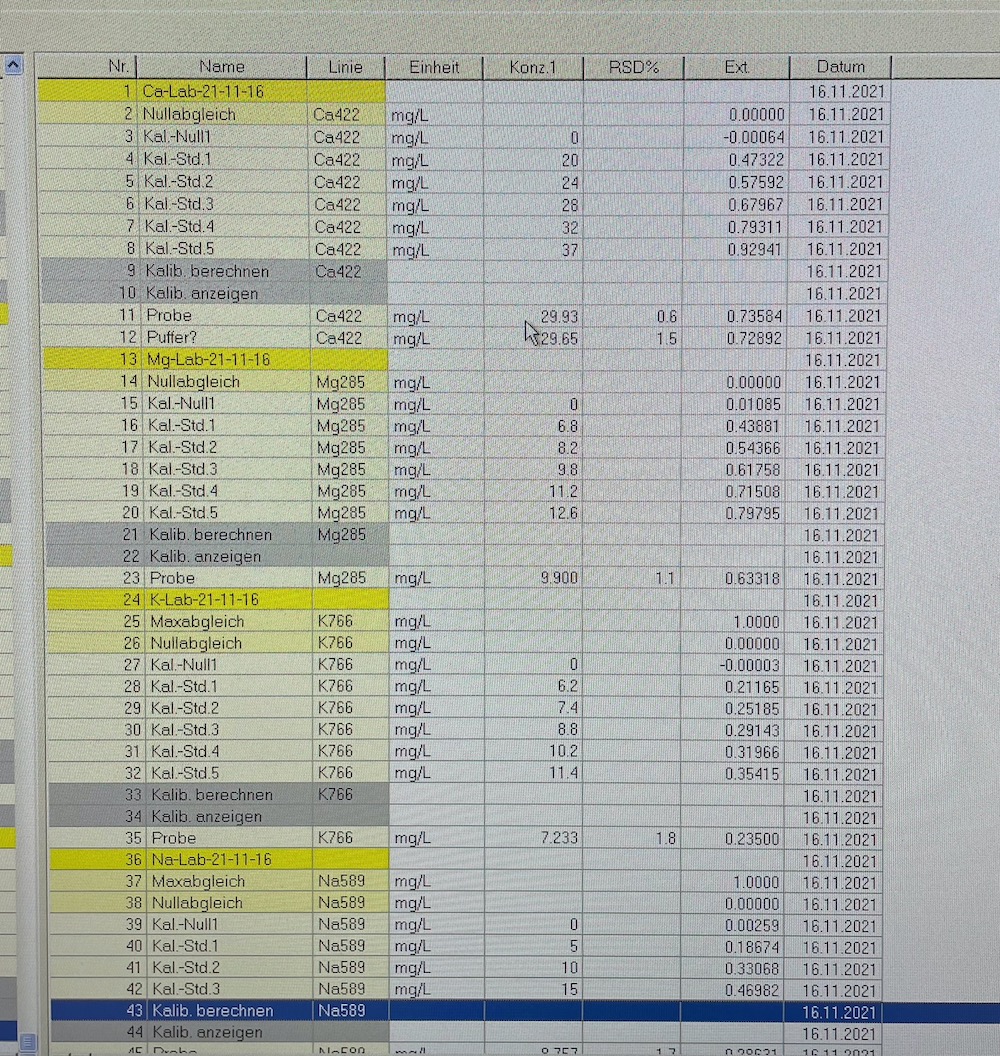
Die Konzentrationen in ppm werden aus der Tabelle des Programms (s. Abb. 7) notiert. Sie sind jeweils in der Zeile "Probe" zu finden. Mithilfe dieser wird die Konzentration in mmol/l wie folgt berechnet:
⚠ $$ c = \frac{ω (ppm) \cdot ρ (kg/l)}{M (mg/mmol)} \ \cdot F ⚠ $$
- ω = Massenanteil [ppm]ρ = Dichte, hier vereinfacht als ρ = 1 kg/lM = Molare Masse [mg/mmol]Der Faktor wird nur für die Berechnung von Natrium mit einbezogen.
Ebenso müssen die Verdünnungen für Kalium und Natrium mit einbezogen werden um die Konzentration in der Analyse zu bestimmen.
Bei Kalium wurden 15 ml der Analysenlösung auf 100 ml verdünnt.
Bei Natrium haben wir eine Zweischritt-Verdünnung: Zunächst wird 1 ml der 15 ml/100 ml Verdünnung entnommen. Dies entspricht 0,15 ml der Ausgangslösung. Es wird auf 50 ml aufgefüllt (50 ml/0,15 ml).
Soll-Gehalt ±Abweichung in mmol/l laut Arzneibuch:
In diesen Bereichen sollten unsere Werte liegen. Andernfalls entspricht unsere Lösung nicht den Anforderungen.
Aufgabenteil b)
Es erfolgt ein Vergleich der gemessenen Konzentration an Calcium mit der tatsächlichen Konzentration von 0,700 mol/l. Ist der Gehalt bei ca. 0,700 mmol/l ist ein Ionisationspuffer in der Probe enthalten. Liegt der Gehalt unter 0,7 mmol/l, so enthält die Probe keinen Ionisationspuffer, da das Calcium teilweise ionisiert und somit der Messwert sinkt. Dieser sorgt schließlich dafür, dass aufgrund der leichten Ionisation des Puffers die freie Elektronen-Konzentration in der Probe erhöht wird, wodurch das Ionisationsgleichgewicht wieder auf Seite der Atome unseres Analysten verschoben wird (Massenwirkungsgesetz!). Somit wird der Ionisierungsgrad des Elements vermindert. 15 Wenn der Messwert der Calciumprobe (0,7 mmol/l) niedriger ist, ist dementsprechend keiner enthalten.
Tipps
Tipps zur Vorbereitung
1. Theoretische Vorbereitung
(Seminarteil AAS, Praktikumsskript AAS, Wiki-Artikel zu AAS,Wiki-Artikel zu AES eventuell ergänzende Vorbereitung durch Internetrecherche, Videos, Lehrbücher)
Das solltest du schon wissen:
• Was ist der Unterschied zwischen der AES und der AAS? Was sind die zugrundeliegenden Prinzipien?
• Wie wird die F-AAS durchgeführt? Wie sieht der instrumentelle Aufbau aus?
• Was kann mithilfe der AES und der AAS bestimmt werden?
• Wieso wird eine Kalibrierung durchgeführt?
• Was ist das Ziel des Versuches? Was wird bestimmt?
• Was ist ein Ionisationspuffer? Welchen Zweck erfüllt er?
• Welchen Einfluss hat der Brennwinkel auf die Extinktion? Wieso wird dieser für die Vermessung von Calcium verstellt?
• Wieso wird die Probe für die Kalium- und Natrium-Bestimmung verdünnt?
• Wieso befinden sich in den Stammlösungen für Calcium, Kalium und Magnesium ein Zusatz an Natrium? (Hinweis:Ionisationspuffer!)
2. Berechnung der Konzentrationen der Referenzlösungen und Anteile der Stammlösung für die Referenzlösungen
(Die nötigen Tabellen sind hierfür im Praktikumsskript vorgedruckt. Was genau berechnet werden soll, findet sich ebenfalls dort.)
Tipps zur Durchführung
Es empfiehlt sich, auf diese Durchführungsschritte genau zu achten und diese Punkte zu beherrschen um letztendlich die richtige Konzentration der Stoffe zu ermitteln. Da diese sehr gering sind, ist genaues Arbeiten unabdenkbar!
• Richtiges Pipettieren
• Das richtige Befüllen eines Messkolbens (auf Augenhöhe halten!)
• Die richtige Verwendung einer Eppendorf-Pipette
• Vorsichtiges Einsetzen der Probenbehälter (auf die richtige Nummer achten!)
• Genau nach der ausliegenden SOP arbeiten, die eingetragenen Werte unbedingt nochmal kontrollieren lassen vom Assistenten.
• Die Flamme muss nach Calcium gedreht werden, dies sollte nicht vergessen werden.
• Für die Auswertung muss der Faktor der Stammlösungen notiert werden
Einzelnachweise
1 https://pharmchem.de.cool/wiki/Instru/Atomabsorptionsspektroskopie | letzter Stand: 08.12.2021, 16.49 Uhr ⇑
2 https://pharmchem.de.cool/wiki/Instru/Atomemissionsspektroskopie | letzter Stand: 08.12.2021, 16.52 Uhr ⇑
3 Zeichnung von Zoe Stengel ⇑
4 https://www.chemie.de/lexikon/Atomspektroskopie.html | Stand: 08.12.2021, 17.03 Uhr ⇑
5 fotografiert von Zoe Stengel ⇑
6 fotografiert von Zoe Stengel ⇑
7 Rücker Neugebauer, Instrumentelle pharmazeutische Analytik 3.Auflage (2001) Wissenschaftliche Verlagsgesellschaft Stuttgart S.78 ff ⇑
8 fotografiert von Zoe Stengel ⇑
9 Praktikumsskript Instrumentelle Analytik Dr. Thomas Kellner Version: 09 Stand 22.10.2021 S.20 ⇑
10 fotografiert von Zoe Stengel ⇑
11 Praktikumsskript Instrumentelle Analytik Dr. Thomas Kellner Version: 09 Stand 22.10.2021 S.61 ⇑
12 fotografiert von Jule van de Mötter ⇑
13 fotografiert von Jule van de Mötter ⇑
14 erstellt von Jule van de Mötter ⇑
15 https://www.chemie.de/lexikon/Atomspektroskopie.html | letzter Stand: 06.12.2021, 20.08 Uhr ⇑