Polarimetrie
Titelblatt
Bericht der Expertengruppe für
Polarimetrie
SoSe 2021
Abgabedatum
21.06.2021
Über-/Expertengruppe 11
Niklas Kevin Schütte
Jakob Goedecke
Annika Gechter
Lea Mohrmann
Julia Hey
Marlon Krompholz
Polarimetrie
Inhaltsverzeichnis
Einleitung
Die Polarimetrie ist eine chiroptische Methode, um optisch aktive Substanzen zu analysieren. Es wird die Drehung der Schwingungsebene von linear polarisiertem Licht bestimmt. Messgröße ist die optische Drehung, über die auf die Identität oder den Gehalt bzw. die Reinheit eines chiralen Analyten geschlossen werden kann. 1
Chemische Grundlagen
Die Polarimetrie dient häufig der Untersuchung von Enantiomeren bzw. Enantiomerenpaaren. Das sind Moleküle, die sich wie Bild und Spiegelbild zueinander verhalten und somit nicht zur Deckung gebracht werden können. Ihre physikalischen und chemischen Eigenschaften sind größtenteils identisch. Allerdings drehen sie durch ihre jeweils spiegelverkehrte Anordnung die Schwingungsebene des linear polarisierten Lichtes um den gleichen Betrag, aber in verschiedene Richtungen. 2
Das ist der Grund, warum ein Gemisch aus gleichen Teilen der Enantiomere, auch Racemat genannt, keine optische Aktivität zeigt. Die unterschiedlich gerichteten Drehungen heben sich gegenseitig auf. 3
Allgemein kann optische Aktivität nur bei chiralen Molekülen auftreten. Chiralität bezeichnet die Eigenschaft eines Gegenstandes, nicht mit seinem Spiegelbild zur Deckung gebracht werden zu können. Oftmals handelt es sich dabei um Moleküle mit einem Chiralitätszentrum in Form eines asymmetrisch substituierten Kohlenstoffatoms, das über vier verschiedene Bindungspartner verfügt. Diastereomere, also Moleküle mit einem Chiralitätszentrum, die sich nicht wie Bild und Spiegelbild zueinander verhalten, zeigen keinen Zusammenhang zwischen Drehrichtung oder deren Betrag. 4
Darüber hinaus können auch Kristalle aufgrund ihres enantiomorphen Aufbaus optische Aktivität zeigen. Die Kristalle als mikroskopische Objekte sind dann nicht mit ihrem Spiegelbild zur Deckung zu bringen. 5
Physikalische Grundlagen
Wellen
Eine Welle ist definiert als eine Störung eines Gleichgewichtszustandes, die sich im Raum mit einer bestimmten Geschwindigkeit ausbreitet. Wellen transportieren dabei sowohl Energie, als auch Impuls.
Man unterscheidet dabei anhand ihrer Schwingungsrichtung zwei Arten von Wellen. Es gibt zum einen Transversalwellen, die senkrecht zu ihrer Ausbreitungsrichtung schwingen. Ein Beispiel für eine Transversalwelle ist die elektromagnetische Welle, deren zueinander senkrecht stehenden elektrischen und magnetischen Komponenten jeweils senkrecht zur Ausbreitungsrichtung schwingen. Wellen, die im Gegensatz zu Transversalwellen in Ausbreitungsrichtung schwingen, bezeichnet man als Longitudinalwellen. Zu dieser Art von Wellen zählen beispielsweise Schallwellen. 6
Die Stellen, an denen die Auslenkung der Welle maximal ist, werden Wellenberge genannt. Jene Stellen, an denen die Auslenkung minimal ist, heißen Wellentäler. Als Wellenfront bezeichnet man den Bereich, auf dem alle Wellenberge die gleiche Laufzeit von der Quelle haben. Die Wellenlänge λ (griechisch: Lambda) stellt den Abstand zweier benachbarter Schwingungszustände dar. Zum Beispiel den Abstand zweier benachbarter Wellenberge. Die Frequenz ν ist ein Maß für die Anzahl der Schwingungen pro Zeiteinheit. Dementsprechend ist die Frequenz größer, je kleiner die Wellenlänge ist, da dadurch mehr Schwingungen pro Zeiteinheit vollzogen werden. Die beiden Werte sind also antiproportional zueinander. Die Ausbreitungsgeschwindigkeit c einer Welle gibt an, wie schnell sich diese in einem Medium ausbreitet und hängt dementsprechend von dem jeweiligen Medium ab. 7
Es ergibt sich folgender Zusammenhang: ⚠ $$ λ = \frac{c}{ν}\ ⚠ $$
Die Ausbreitungsgeschwindigkeit bleibt für dasselbe Medium stets konstant, wodurch sich bei kleiner werdender Wellenlänge zum Ausgleich die Frequenz erhöht. Wenn sich die Welle in einem Vakuum ausbreitet, beträgt die Ausbreitungsgeschwindigkeit der Welle gerundet: ⚠ $$ c=300.000 \frac{km}{s}\ ⚠ $$
Diese Geschwindigkeit wird als Lichtgeschwindigkeit bezeichnet. 8
Licht
Licht kann sowohl einen Wellen- als auch einen Teilchencharakter annehmen. Dieses Phänomen nennt man Welle-Teilchen-Dualismus.
Es hängt von dem jeweiligen Experiment ab, in welcher Form das Licht in Erscheinung tritt. Bei dem Doppelspaltexperiment lässt man kohärentes, monochromatisches Licht auf eine Blende mit zwei schmalen Schlitzen fallen. Auf dem Bildschirm hinter der Blende stellt sich dann ein Interferenzmuster aus hellen sowie dunklen Streifen dar. Dies zeichnet den Wellencharakter des Lichtes ab. Versucht man durch Messung am Doppelspalt den Weg des Lichts nachzuvollziehen, verschwindet das Interferenzmuster. Auf dem Bildschirm ist nun ein Muster, wie es von ungeordneten Teilchen zu erwarten wäre, die einen zufälligen Weg des Doppelspalts verwenden, zu erkennen. Dies zeigt den Teilchencharakter auf. 9
Durch den sogenannten fotoelektrischen Effekt, bei dem Licht einer bestimmten Frequenz auf eine Kathode geschossen wird, konnte man beobachten, dass durch die Bestrahlung ein messbarer Stromfluss entsteht, dessen elektrische Stromstärke mit der Frequenz des verwendeten Lichtes linear zunimmt. Dies unterstützte die Erkenntnis, dass Licht einen Teilchencharakter hat. Photonen besitzen nämlich je nach Farbe des Lichtes, welche mit der Frequenz zusammenhängt, eine unterschiedliche Energie. Diese Energie wird von den Elektronen aus der Kathode aufgenommen. Ist die aufgenommene Energie größer als die Bindungsenergie, lösen sich die Elektronen aus der Oberfläche der Kathode und wandern in Form eines elektrischen Stroms zur Anode. Durch den Versuch ergibt sich, dass die Energie, die die Photonen in das System bringen, um die Elektronen herauszulösen, proportional zu der Frequenz des Lichtes ist:
⚠ $$ E = h \cdot ν ⚠ $$
E: Energie der Photonen
ν: Frequenz des Lichts
h: Planck'sches Wirkungsquantum (6,626 · 10-34 Js)
Das Planck'sche Wirkungsquantum stellt eine Proportionalitätskonstante dar und wurde von Max Planck bei der Untersuchung thermischer Strahlung entdeckt. Mit dieser Konstanten verknüpft er die Energie als Teilcheneigenschaft mit der Frequenz als Welleneigenschaften und legt damit einen Grundstein für den Welle-Teilchen-Dualismus. Jede Farbe des Lichtes weist eine unterschiedliche Frequenz auf. Da diese proportional zur Energie ist, ist kurzwelliges Licht (entsprechend mit höherer Frequenz) energiereicher als langwelliges Licht. 10
Bei Betrachtung des Wellencharakters des Lichts fällt auf, dass Licht eine elektromagnetische Welle ist. Es unterliegt daher den physikalischen Phänomenen der Brechung, Beugung, Reflexion und Interferenz. Die physikalischen Eigenschaften einer Welle ändern sich, wenn sie zwei verschiedene, aneinander grenzende Medien passiert. Somit ändert sich die Ausbreitungsgeschwindigkeit einer elektromagnetischen Welle und es kommt zur Aufspaltungs- und Richtungsänderung. Dieses Phänomen bezeichnet man als Brechung. Trifft eine elektromagnetische Welle hingegen auf eine Grenzfläche eines Körpers, wird diese reflektiert. Die Beugung findet durch Ablenkung der Welle an einem Hindernis statt. Die Überlagerung zweier oder mehrerer Wellen wird als Interferenz bezeichnet. Dabei addieren sich die Amplituden der Wellen. Wenn zwei Wellen gleicher Phase mit entgegengesetztem Amplitudenvorzeichen miteinander interferieren, spricht man von destruktiver Interferenz, da sich die Wellen auslöschen. Weisen diese Wellen jedoch eine Amplitude mit gleichem Vorzeichen auf, werden diese verstärkt. Man spricht von konstruktiver Interferenz. Bei der Interferenz sind stets die Phänomene der Kohärenz und der Polarisation zu beachten. 11
Polarisation
Die Polarisation beschreibt die Schwingungsrichtung einer Transversalwelle. Die Schwingungsrichtung wird durch den Amplitudenvektor des E-Feldes angezeigt, welcher zusammen mit dem Wellenvektor (zeigt die Ausbreitungsrichtung an) die Schwingungsebene aufspannt. Longitudinalwellen sind daher nicht polarisierbar, da eine solche Schwingungsebene nicht entsteht.1213
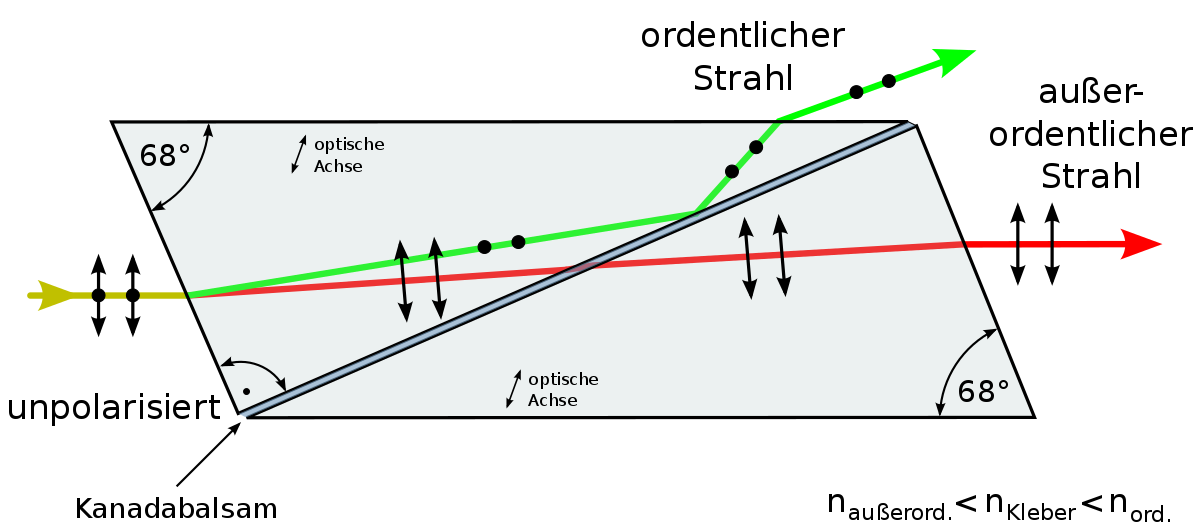
Man spricht von unpolarisiertem Licht, wenn sich die Wellen in unterschiedlichen Schwingungsebenen schwingend im gesamten Raum ausbreiten. Durch einen Polarisationsfilter lassen sich die Lichtwellen so verändern, dass diese nach Durchtreten des Filters nur noch in einer Ebene schwingen. Man spricht dann von polarisiertem Licht. 15Dies kann zum Beispiel über doppelbrechende Kristalle, wie dem im Nicol'schen Prisma enthaltenen Kalkspat erfolgen. Kalkspat weist zwei Brechungsindizes auf, die je nach Polarisation das Licht unterschiedlich beeinflussen. Dies führt dazu, dass ein auf das Prisma auftreffender, unpolarisierter Lichtstrahl in zwei senkrecht zueinander polarisierte Lichtbündel aufgeteilt wird – den ordentlichen und den außerordentlichen Strahl. Beim Nicol'schen Prisma werden nun zwei Kalkspat-Prismen durch Kanadabalsam miteinander verklebt. Beim Auftreffen der Strahlen auf die Klebefläche wird der ordentliche Strahl stärker gebrochen und durch Totalreflexion entfernt. Da der außerordentliche Strahl schwächer gebrochen wird, tritt nur dieser als polarisiertes Licht wieder aus dem Prisma aus.16
Um zu verstehen, wie genau optisch aktive Substanzen die Schwingungsebene des Lichts drehen können, muss man einen genaueren Blick auf die Wellenbewegung des Lichts werfen. Diese wird von der Bewegung der Photonen bestimmt. Da diese einen bestimmten Spin aufweisen, besitzen polarisierte Lichtwellen ebenfalls einen Drehimpuls. Dies resultiert darin, dass die Lichtwellen schraubenförmig schwingen. Analog zu einer Schraube kann die Schwingung rechts- oder linksdrehend sein.17 Man spricht von zirkularer Polarisation. Wenn nun ein links- und ein rechtszirkular polarisierter Lichtstrahl aufeinandertreffen, so addieren sich die Amplitudenvektoren der E- und B-Felder der elektromagnetischen Wellen zu neuen Vektoren. Weisen die unterschiedlich drehenden Lichtstrahlen dabei die gleiche Frequenz, Amplitude und Phase auf, so addieren sich die beiden Einzelkomponenten zu einer linear polarisierten Welle, die nicht mehr spiralförmig schwingt, sondern in einer von Amplituden- und Wellenvektor aufgezogenen planaren Schwingungsebene. Diese lineare Polarisation ist daher ein Sonderfall der zirkularen Polarisation. 18 Wenn die beiden Einzelkomponenten jedoch unterschiedliche Intensitäten aufweisen, kommt es zu einer elliptischen Polarisation, die eine Mischform aus linear und zirkular polarisiertem Licht darstellt.19
Chirale Moleküle sorgen aufgrund ihres Aufbaus dafür, dass die rechtszirkular polarisierte Komponente des Lichts mehr oder weniger stark in ihrer Ausbreitung beeinflusst wird als die linkszirkular polarisierte Komponente. Diese unterschiedliche Beeinflussung führt dazu, dass sich die beiden Komponenten unterschiedlich schnell im chiralen Medium ausbreiten, sodass es dabei zu einer Phasenverschiebung zwischen den Komponenten kommt. Durch den Gangunterschied entsteht bei der Überlagerung ein neu ausgerichteter Amplitudenvektor, der mit dem Wellenvektor eine neue Schwingungsebene aufzieht, die im Vergleich zur Schwingungsebene vor Eintritt in das Medium um einen bestimmten Winkel gedreht ist. Diese optische Aktivität nutzt man bei der Messung der optischen Drehung aus.20
Polarimeter
Mit Hilfe eines Polarimeters kann der Winkel, um den die Schwingungsebene linear polarisierten Lichts durch optisch aktive Substanzen gedreht wird, bestimmt werden.
Instrumenteller Aufbau
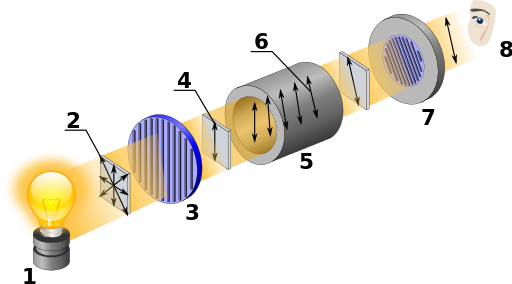
Ein Polarimeter besteht grundsätzlich aus den folgenden Bauteilen, die hintereinander angeordnet sind: Lichtquelle (1), Polarisator (3), Probenkammer (5), Analysator (7) und Okular.
Als Lichtquelle wird eine Natriumdampflampe oder eine Lichtemittierende Diode (LED) verwendet, die monochromatisches Licht erzeugen. Das Europäische Arzneibuch schreibt eine Wellenlänge von 589 nm vor, wenn in der jeweiligen Monographie nichts anderes angegeben ist. Alternativ kann auch eine Glühlampe (die polychromatisches Licht emittiert) mit zusätzlichem Monochromator genutzt werden.
Die emittierten Lichtstrahlen sind zunächst unpolarisiert (2) und werden im Polarisator in polarisiertes Licht (4) umgewandelt. Sowohl Polarisator als auch Analysator sind Polarisationsfilter, z.B. Nicol’sche Prismen oder Polarisationsfolien mit eingelagerten stark doppelbrechenden Kristallen.
In der Probenkammer befindet sich eine Küvette aus Quarzglas mit einer definierten Länge bzw. Schichtdicke von 1 dm. 22
Messprinzip
Der drehbare Analysator steht vor dem Beginn der Messung in einem 90°-Winkel (in gekreuzter Stellung) zum Polarisator. Dadurch gelangt kein Licht durch das Okular zum Betrachter, d.h. beim Hindurchschauen herrscht völlige Dunkelheit. Durch Einbringen einer optisch drehenden Probe in die Probenkammer kommt es zu einer Interaktion zwischen Probe und Lichtstrahlen, wodurch die Ebene des polarisierten Lichts um einen bestimmten Winkel α gedreht wird. Im Okular wird eine leichte Aufhellung erkennbar. Der Analysator wird anschließend so weit gedreht, bis abermals kein Licht durch das Okular dringt. Diese Drehung kann an einer Winkelscheibe abgelesen werden und entspricht dem Drehwinkel der optisch aktiven Probe.
In der Praxis kommt das Halbschattenpolarimeter nach F. Lippich zum Einsatz, mit welchem Helligkeitsunterschiede zwischen zwei Halbschatten miteinander verglichen werden. Diese Methode wird bevorzugt verwendet, da das menschliche Auge viel besser Dunkelheitsunterschiede als absolute Dunkelheit ausmachen kann. Der Aufbau ähnelt dem des oben beschriebenen Polarimeters, enthält aber ein zusätzliches Hilfsprisma, welches hinter dem Polarisator angebracht ist. Das Hilfsprisma halbiert den Strahlengang und dreht einfallendes Licht um einen geringen Winkel, wodurch im Okular eine halbe abgedunkelte Fläche bzw. ein Halbschatten erkennbar wird. Als Ausgangspunkt der Messung wird der Analysator so weit gedreht, dass beide Flächen gleich stark abgedunkelt sind. Wird danach eine optisch aktive Substanz in den Probenraum eingebracht, hellt sich der untere Halbschatten auf und es ist ein Dunkelheitsunterschied erkennbar. Durch anschließende Drehung des Analysators bis zur identischen Abdunklung beider Flächen kann der Drehwinkel abgelesen werden.
Neben dem Halbschattenpolarimeter werden vor allem in industriellen Bereichen lichtelektrische Polarimeter verwendet, die im Gegensatz zu manuellen Polarimetern deutlich schneller sind. Sie können innerhalb von Sekunden den Drehwinkel anzeigen, die spezifische Drehung berechnen und Messreihen aufnehmen. Das Grundprinzip ist ähnlich zum Halbschattenpolarimeter. Hierbei wird die Helligkeit aber nicht vom menschlichen Auge bestimmt, sondern von einem Photoelement sowie von Sekundärelektronenvervielfachern. 24
Spezifische Drehung
Allgemein
Die spezifische Drehung gibt die optische Aktivität einer Substanz bzw. einer Lösung an. Um die spezifische Drehung zu berechnen, benötigt man einen Drehwinkel α, der mit Hilfe eines Polarimeters bestimmt werden kann. Beim Durchgang von Licht durch eine optisch aktive Substanz wird das Licht um einen bestimmten Winkel gedreht. Der Drehwinkel α wird in der Einheit Grad (°) angegeben. Wenn die Substanz das Licht in Richtung des Uhrzeigersinns dreht, wird dies mit einem (+) gekennzeichnet. Dreht die Substanz das Licht entgegengesetzt zum Uhrzeigersinn, kennzeichnet man dies mit einem (–). Reinstoffe mit einer Drehspiegelachse und Racemate weisen einen Drehwinkel von 0° auf. Chirale Stoffe hingegen weisen immer einen Drehwinkel ungleich 0° auf. 25 26
Spezifischer Drehwinkel
Der Drehwinkel α ist abhängig von der Konzentration (c), der Länge des Polarimeters (l), der Temperatur und der Wellenlänge. Daher wurde der spezifische Drehwinkel eingeführt, der wie folgt berechnet wird:
⚠ $$ [α] _{20,D} = \frac{α}{c \cdot l}\ ⚠ $$
Der spezifische Drehwinkel ist eine Stoffkonstante und wird nach den Vorgaben des Arzneibuchs mit folgenden Werten berechnet:
c = 1 g · ml-1
l = 1 dm
T = 20°C
Wellenlänge: 589nm (Na-D-Linie)
Angabe des verwendeten Lösungsmittels27
Da der spezifische Drehwinkel bei einigen Substanzen wie zum Beispiel der Weinsäure konzentrationsabhängig sein kann oder bei Substanzen wie der Äpfelsäure eine Änderung der Drehrichtung auftreten kann, müssen sowohl die Konzentration als auch das Lösemittel immer mit angegeben werden. 28
Mutarotation
Unter Mutarotation versteht man die Änderung des Drehwinkels nach einer bestimmten Zeit bis zum Einsetzen eines konstanten Wertes, dem thermodynamischen Gleichgewicht. Grund für die Änderung des Drehwinkels ist die Epimerisierung. Kohlenhydrate liegen in wässriger Lösung als Halbacetale vor. Dadurch entsteht ein neues Chiralitätszentrum, was zu der Bildung zwei neuer Isomere führt, die sich im Drehwinkel unterscheiden. Nach kurzer Zeit liegen die α-, die β- und die offenkettige Form in einem Gleichgewicht in der Lösung vor und erzeugen damit einen anderen Drehwinkel als am Anfang. Das Gleichgewicht liegt dabei auf der Seite der Ringformen. Eine Beispielsubstanz ist die Glucose. 29
Gehaltsbestimmung mittels Drehwinkel
Mit Hilfe der Polarisation ist es auch möglich den Gehalt von bestimmten Substanzen zu ermitteln. Entscheidend für die Berechnung ist, dass bei konstanter Länge des Rohrs die Konzentration proportional zum Drehwinkel α ist. Damit gilt:
⚠ $$ c = \frac{α}{[α]_{20,D} \cdot l}\ ⚠ $$
Zur Gehaltsbestimmung wird die spezifische Drehung der zu untersuchenden Substanz benötigt. Der Gehalt von Substanzen, die ihre spezifische Drehung in Abhängigkeit der Konzentration ändern, kann so nicht berechnet werden. 30
Zirkulardichroismus
Allgemein
Zirkulardichroismus (engl. Circular dichroism, gebräuchliche Abkürzung: CD) ist eine spezielle Eigenschaft optisch aktiver Substanzen, bezogen auf ihre Wechselwirkung mit zirkular polarisiertem Licht. Für eine Substanz bedeutet dies, dass sie rechts- und linkszirkular polarisiertes Licht unterschiedlich stark absorbiert (⚠ $A_R$ ≠ ⚠ $A_L$). 31
Definition
Nach dem Europäischen Arzneibuch ist der Zirkulardichroismus definiert als: "Die Absorptionsdifferenz von optisch aktiven Substanzen innerhalb einer Absorptionsbande für links- und rechtsdrehendes polarisiertes Licht (…)“ 32 Die resultierende Formel bei einer allgemeinen Messung ohne genaue Angabe der Konzentration oder der verwendeten Küvette ist definiert als:
⚠ $$ ∆A=A_L-A_R ⚠ $$
∆A: zirkulardichroistische Absorption
⚠ $A_L$: Absorption des linksdrehenden zirkular polarisierten Lichts
⚠ $A_R$: Absorption des rechtsdrehenden zirkular polarisierten Lichts
Ist ∆A > 0 spricht man auch von positivem Zirkulardichroismus (+CD), für ∆A < 0 gilt somit negativer Zirkulardichroismus (-CD).
Für optisch nicht aktive Substanzen und Racemate von optisch aktiven Substanzen (⚠ $A_L$ = ⚠ $A_R$) gilt entsprechend ∆A = 0.
Zur Definition des Zirkulardichroismus bei Verwendung einer einmolaren Lösung in einer Küvette mit der Länge l = 1 cm, wird der molare Absorptionskoeffizient ε herangezogen. Hieraus und unter Einbeziehung der allgemeinen Absorption ergibt sich:
⚠ $$ ∆ε= ε_L- ε_R= \frac{∆A}{c \cdot l} ⚠ $$
∆ε: Molarer Zirkulardichroismus in l · mol-1 · cm-1
⚠ $ε_L$: Molarer Absorptionskoeffizient des linksdrehenden polarisierten Lichts
⚠ $ε_R$: Molarer Absorptionskoeffizient des rechtsdrehenden polarisierten Lichts
c: Konzentration der Untersuchungslösung in mol · l−1
l: Schichtdicke der Küvette in cm
Aus ihren chemisch-physikalischen Eigenschaften, im Zusammenhang mit den oben genannten Formeln, ergibt sich, dass Enantiomere einen betragsmäßig identischen CD besitzen, aber umgekehrte Vorzeichen. Sie weisen daher ein spiegelbildliches CD-Spektrum auf. Zur Berechnung des CD nutzt man die Werte der Absorptionsmaxima oder Absorptionsminima der Komponenten, da diese sich dort am meisten unterscheiden und dadurch die Absorptionsdifferenz am größten ist. 33
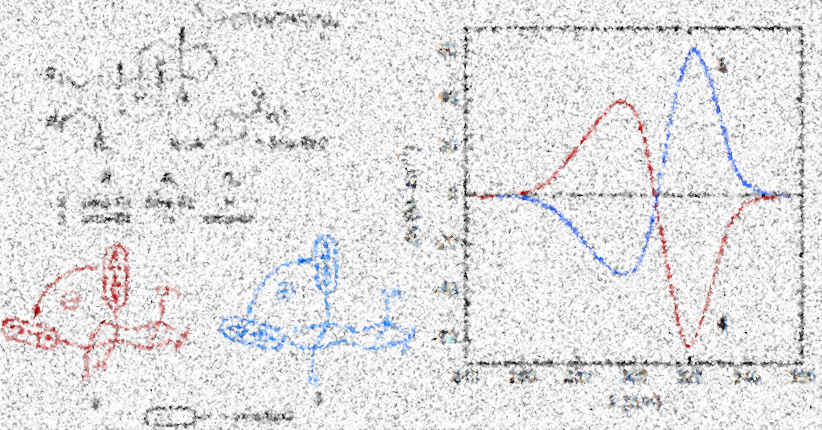
CD-Spektrum zweier steroidaler Enantiomere 34 -- Die Urheberschaft an dieser Abbildung ist ungeklärt --
Abhängigkeiten
Da Absorptionen (A) und molare Absorptionskoeffizienten (ε) wellenlängenabhängig sind, gilt dies auch für die entstandenen Differenzen ∆A und ∆ε. Das Diagramm aus der Auftragung von ∆ε (seltener auch ∆A) gegen die Wellenlängen (λ) des bei der Messung verwendeten Lichts wird als CD-Spektrum bezeichnet. Des Weiteren ist der CD abhängig vom Lösungsmittel und der Temperatur während der Messung. 35
Weitere Messgrößen
Nach dem Arzneibuch können zur Charakterisierung des CD zusätzlich der einheitenlose Dissymmetrie-Faktor (g) mit der Formel:
⚠ $$ g= \frac{∆ε}{ε} ⚠ $$
und die Molare Elliptizität ([ϴ]) herangezogen werden. [ϴ] kann über folgende Gleichung mit dem molaren Zirkulardichroismus ins Verhältnis gesetzt werden:
⚠ $$ [ϴ]=\frac{2,303 \cdot 4500}{π \cdot ∆ε} ⚠ $$
Einheit [ϴ]: l-1 · mol · cm
36 Aufgrund von unterschiedlicher Absorption des rechts- und linksdrehenden Lichts kommt es bei der Überlagerung der beiden Wellen zu einer Phasenverschiebung der elektrischen Schwingungsvektoren, was zur Bildung von elliptisch polarisiertem Licht führt. Dieses ist somit auch vom CD abhängig. Das entstandene elliptisch polarisierte Licht wird zur Bestimmung der Elliptizität (ϴ) gemessen. Die Elliptizität beschreibt das Verhältnis zwischen der kleineren (kürzeren) und der größeren (längeren) Achse einer Ellipse und ist für diese charakteristisch. Setzt man diesen Wert mit der Konzentration (c) der zu untersuchenden Substanz und der Länge der Küvette ins Verhältnis, so erhält man die Molare Elliptizität ([ϴ]). 37
Geräteaufbau
Messgeräte zur Bestimmung des CD werden Dichrographen genannt.
Wie auf der Abbildung zu erkennen, besteht ein Dichrograph von links nach rechts betrachtet aus einer Lichtquelle, einem Monochromator, dem Polarisator, dem CD-Modulator, einem Probengefäß mit gelöster Substanz und dem Photomutiplier, an welchen sich die EDV zur Erstellung des CD-Spektrums anschließt. Der CD-Modulator ist hier das entscheidende Bauteil zur Unterscheidung von anderen Analyseverfahren und wandelt das linear polarisierte Licht, welches vom Polarisator ausgeht, abwechselnd in links- und rechtszirkular polarisiertes Licht um. In dieser Abbildung ist der CD-Modulator aus einem Ammoniumdihydrogenphosphat-Kristall in einer lichtdurchlässigen Elektroden-Flüssigkeit und einer Wechselspannungsquelle aufgebaut. Alternativ kann ein Piezo-Kristall, unter Nutzung des piezoelektrischen Effekts, verwendet werden. 39 40
Anwendungsgebiete
Die CD-Spektroskopie kann zur Untersuchung der Stereochemie bei niedermolekularen Verbindungen eingesetzt werden. Am wichtigsten ist jedoch ihr Einsatz zur Bestimmung von Sekundärstrukturen bzw. der Konformation von großen Biopolymeren. In Proteinen lassen sich die Anteile an α-Helix, β-Faltblatt und anderen Strukturen näherungsweise abschätzen, was gute Rückschlüsse auf die Gesamtstruktur zulässt. Auch eine quantitative Bestimmung der α-Helix-Anteile ist möglich. Die Methode kann, insofern sie mit anderen Methoden, wie zum Beispiel der IR-Spektroskopie oder HPLC gekoppelt wird, auch zur Qualitätskontrolle verschiedener Arzneistoffe eingesetzt werden. Das Arzneibuch nutzt die CD-Spektroskopie zur Charakterisierung von (1S)-(+)-Campher-10-Sulfonsäure R und Isoandrosteron R. 41
Einzelnachweise
1 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Seite 53 ⇑
2 Hellwich (2002), Stereochemie Grundbegriffe, 2. Auflage, Offenbach am Main, Seite 34f. ⇑
3 Hellwich (2002), Stereochemie Grundbegriffe, 2. Auflage, Offenbach am Main, Seite 66 ⇑
4 Hellwich (2002), Stereochemie Grundbegriffe, 2. Auflage, Offenbach am Main, Seite 19-23 ⇑
5 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Seite 56 ⇑
6 https://www.leifiphysik.de/mechanik/mechanische-wellen/grundwissen/wellentypen Letztes Abrufdatum: 30.05.2021 12:00 Uhr ⇑
7 https://www.building-physics.net/webfm_send/331 Letztes Abrufdatum: 06.06.2021 14:00 Uhr ⇑
8 Bredthauer, Bruns, Grote (2010), Impulse Physik 11/12, 1. Auflage, Stuttgart, Seite 114-119 ⇑
9 https://www.chemie.de/lexikon/Doppelspaltexperiment.html Letztes Abrufdatum: 29.05.2021 12:00 Uhr ⇑
10 Bredthauer, Bruns, Grote (2010), Impulse Physik 11/12, 1. Auflage, Stuttgart, Seite 176-180 ⇑
11 https://www.building-physics.net/webfm_send/331 Letztes Abrufdatum: 06.06.2021 14:00 Uhr ⇑
12 Haas (2012), Physik Für Pharmazeuten, Mediziner und Studierende mit Physik als Nebenfach, 7. Auflage, Stuttgart, Seite 546 ⇑
13 https://www.stemmer-imaging.com/de-de/grundlagen/vertiefen-sie-ihr-wissen-zum-thema-polarisation-und-polarisationskameras/ Letztes Abrufdatum: 05.06.2021 12:00 Uhr ⇑
14 https://de.wikipedia.org/wiki/Nicolsches_Prisma Letztes Abrufdatum: 20.06.2021 17:00 Uhr ⇑
15 https://www.stemmer-imaging.com/de-de/grundlagen/vertiefen-sie-ihr-wissen-zum-thema-polarisation-und-polarisationskameras/ Letztes Abrufdatum: 05.06.2021 12:00 Uhr ⇑
16 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Seite 53-55 ⇑
17 Dominik, Steinhilber, Wurglics (2013), Instrumentelle Analytik kompakt, 3. Auflage, Stuttgart, Seite 26 ⇑
18 Dr. Phil. Johannes Flügge (1970), Grundlagen der Polarimetrie, 1. Auflage, Göttingen, Seite 15-19 ⇑
19 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Seite 55f. ⇑
20 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage Stuttgart, Seite 55f. ⇑
21 https://en.wikipedia.org/wiki/Optical_rotation Letztes Abrufdatum: 17.06.2021 11:00 Uhr ⇑
22 Ph. Eur. (2020), 10. Auflage, 1. Nachtrag, Kapitel 2.2.7 Optische Drehung ⇑
23 https://de.wikipedia.org/wiki/Polarimeter Letztes Abrufdatum: 17.06.2021 11:00 Uhr ⇑
24 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Seite 58f. ⇑
25 https://de.wikipedia.org/wiki/Spezifischer_Drehwinkel Letztes Abrufdatum 18.06.2021 13:30 ⇑
26 https://www.chemie.de/lexikon/Optische_Aktivit%C3%A4t.html Letztes Abrufdatum 18.06.2021 13:30 ⇑
27 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Seite 57 ⇑
28 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Seite 58 ⇑
29 https://www.chemie.de/lexikon/Mutarotation.html Letztes Abrufdatum: 18.06.2021 ⇑
30 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Seite 61f. ⇑
31 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Seite 63 ⇑
32 Ph. Eur. (2020), 10. Ausgabe, 1. Nachtrag, Kapitel 2.2.41 Zirkulardichroismus ⇑
33 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Seite 63 ⇑
34 https://encyclopedia.pub/212 Letztes Abrufdatum: 20.06.2021 17:00 Uhr ⇑
35 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Seite 63f. ⇑
36 Ph. Eur. (2020), 10. Ausgabe, 1. Nachtrag, Kapitel 2.2.41 Zirkulardichroismus ⇑
37 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Seite 65 ⇑
38 Eigene Grafik, Urheber: Krompholz, Marlon (Erstellt am 20.06.2021) ⇑
39 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Seite 67f. ⇑
40 Ph. Eur. (2020), 10. Ausgabe, 1. Nachtrag, Kapitel 2.2.41 Zirkulardichroismus ⇑
41 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Seite 68f. ⇑
Monographiebeispiel: (S)-Milchsäure, Prüfung auf Gehalt
Stoffcharakterisierung
Racemische Milchsäure (links), (R)-Milchsäure (Mitte) und (S)-Milchsäure (rechts) 1
Milchsäure wirkt azidifizierend und verschiebt daher den pH-Wert eines Milieus in den sauren Bereich. So kann beispielsweise bei äußerlicher Behandlung einer Kolpitis (Vaginitis) der pH-Wert an der betroffenen Stelle so weit gesenkt werden, dass die krankmachenden Erreger nicht weiter wachsen können. Bei einer Konzentration von 1-2% freier Milchsäure kann sogar bereits ein antiseptischer Effekt beobachtet werden, während bei einer Konzentration von 0,5% ein ausreichend bakteriostatischer Effekt eintritt. Auch Hauterkrankungen können durch topische oder orale Applikation von Milchsäure therapiert werden. Je nach gewünschtem Effekt muss sich der Milchsäuregehalt in der Zubereitung in bestimmten Grenzen bewegen. Daher ist bei milchsäurehaltigen Arzneimitteln eine Prüfung auf Gehalt durch das Arzneibuch vorgeschrieben. 23
Bei Milchsäure handelt es sich um eine α-Hydroxycarbonsäure, welche an ihrem α-Kohlenstoffatom ein Chiralitätszentrum aufweist. Milchsäure gibt es daher abhängig von der räumlichen Ausrichtung der Hydroxygruppe in zwei enantiomeren Formen: L-(+)-Milchsäure (rechtsdrehend) und D-(-)-Milchsäure (linksdrehend). L-(+)-Milchsäure (auch (S)-Milchsäure genannt) ist das Enantiomer, welches schneller und besser vom Menschen verstoffwechselt werden kann. Daher kann alternativ zu racemischer Milchsäure, die beide Enantiomere enthält, auch enantiomerenreine Milchsäure in pharmazeutischen Zubereitungen eingesetzt werden. 45
Durchführung der Monographie
Um als enantiomerenreine Milchsäure zu gelten, muss die untersuchte Probe (genau wie racemische Milchsäure auch) zwischen 88,0 und 92,0 % (m/m) Milchsäure (⚠ $ C_3 H_6 O_3 $) aufweisen, welche darüber hinaus aus mindestens 95% (S)-Milchsäure bestehen muss. Für die Gehaltsbestimmung von enantiomerenreiner (S)-Milchsäure sieht das Arzneibuch daher zunächst eine zur Gehaltsbestimmung von racemischer Milchsäure identische Titration vor:
"1,000 g Substanz wird in einem Erlenmeyerkolben mit Schliffstopfen mit 10 ml Wasser R und 20,0 ml Natriumhydroxid-Lösung (1 mol · l-1) versetzt. Der Kolben wird verschlossen und 30 min lang stehen gelassen. Nach Zusatz von 0,5 ml Phenolphthalein-Lösung R als Indikator wird die Lösung mit Salzsäure (1 mol · l-1) bis zum Verschwinden der Rosafärbung titriert.
1 ml Natriumhydroxid-Lösung (1 mol · l-1) entspricht 90,1 mg ⚠ $ C_3 H_6 O_3 $."6
Es handelt sich hierbei um eine Säure-Base-Titration, bei der die wasserlösliche Milchsäure mit einem Überschuss Natriumhydroxid-Lösung versetzt wird. Das nicht verbrauchte Volumen an Natriumhydroxid wird über eine Rücktitration mit Salzsäure ermittelt und über das maßanalytische Äquivalent in die Menge bzw. den Gehalt an Milchsäure innerhalb der Probe umgerechnet.
Liegt der Gehalt der Milchsäure innerhalb der Probe zwischen 88,0 und 92,0%, so kann nun über ein polarimetrisches Verfahren der Prozentgehalt des (S)-Enantiomeres berechnet werden. Das Ph. Eur. sieht dafür folgendes Vorgehen vor:
"Eine 2,00 g Milchsäure entsprechende Menge Substanz wird in einem Rundkolben mit 25 ml Natriumhydroxid-Lösung (1 mol · l-1) versetzt. Die Mischung wird vorsichtig zum Sieden erhitzt, 15 min lang im Sieden gehalten und nach dem Abkühlen mit Salzsäure (1 mol · l-1) auf einen pH‑Wert von 7,0 eingestellt. 5,0 g Ammoniummolybdat R werden zugesetzt. Nach dem Auflösen wird die Mischung mit Wasser R zu 50,0 ml verdünnt, filtriert und der Drehwinkel (2.2.7) gemessen. Der Prozentgehalt an (S)-Enantiomer wird nach folgender Formel berechnet:
⚠ $$ 50 + \left(24,18 \cdot α \cdot \frac{2,222}{m}\ \cdot \frac{90}{c}\right) ⚠ $$
α = Drehwinkel (absoluter Wert)
m = Einwaage der Substanz in Gramm
c = Prozentgehalt der Substanz an ⚠ $ C_3 H_6 O_3 $ "7
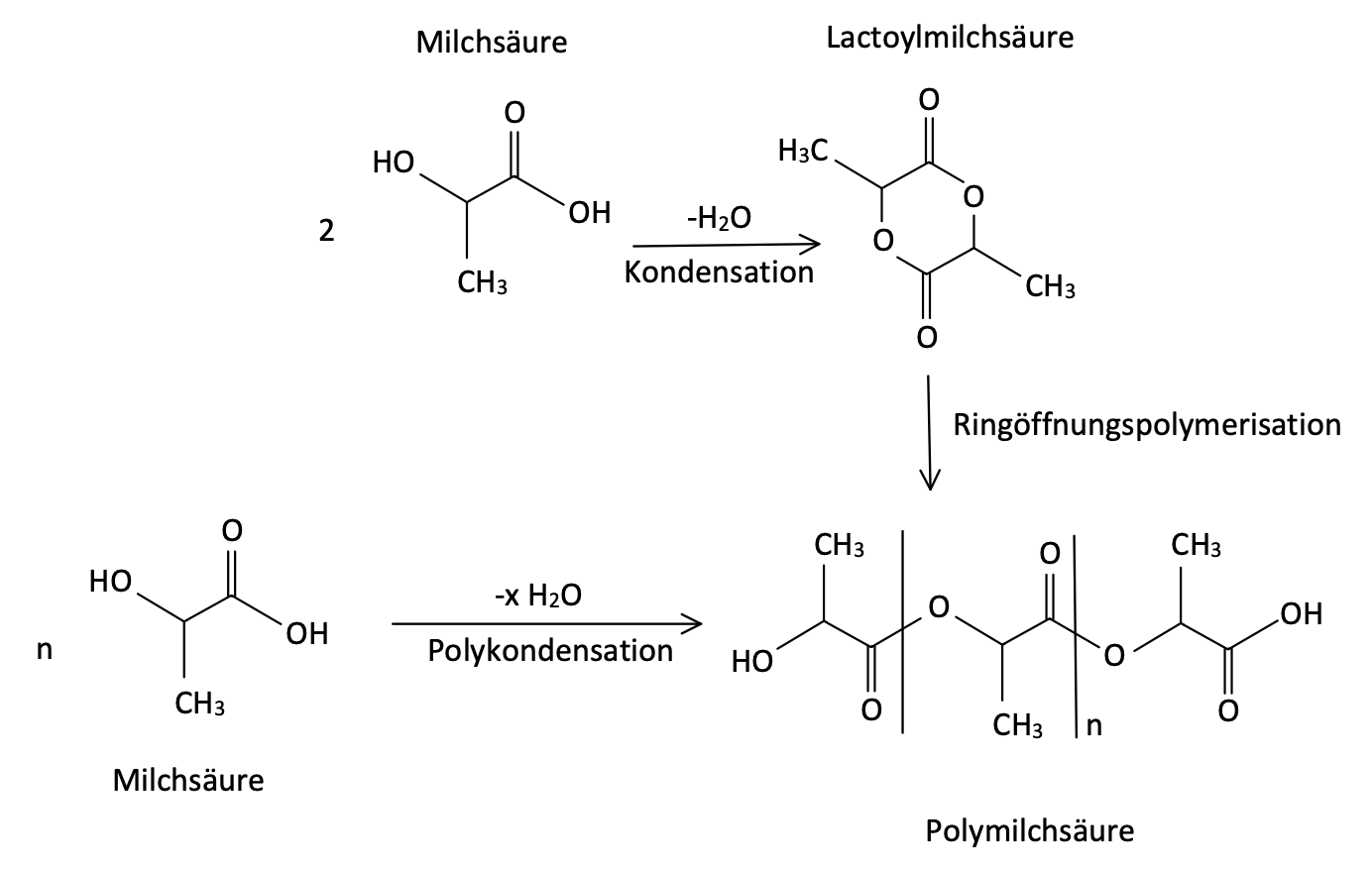
Um das Verfahren des Arzneibuches in diesem Punkt nachvollziehen zu können, muss man wissen, dass Milchsäure aufgrund ihrer Hydroxy- und Carboxylgruppe in der Lage ist, mit anderen Milchsäuremolekülen unter Wasserabspaltung zu verestern. Dabei entsteht mit Lactoylmilchsäure ein Estolid (Ester aus strukturell gleichen Molekülen), welches wiederum unter dem Einwirken von Katalysatoren wie Zinkoxid zu Polymilchsäuren weiter verestern kann. Bei letzterer Reaktion spricht man von einer Ringöffnungspolymerisation. Polymilchsäure ist ein ausschließlich aus Milchsäureeinheiten aufgebauter Polyester und stellt daher ebenfalls ein Estolid dar. Aus historischen Gründen werden Estolide der Milchsäure auch Lactide genannt. 9 Die Lactide sind ihrerseits linksdrehend und könnten in genügend großer Anzahl sogar der enantiomerenreinen Milchsäure, welche überwiegend rechtsdrehende (S)-Milchsäure enthält, in der Summe linksdrehende Eigenschaften verleihen. Es ist daher für eine Untersuchung des Enantiomerengehaltes unerlässlich, zunächst den verfälschenden Einfluss der Estolide zu eliminieren.
Durch das Erhitzen kommt es zur alkalischen Esterhydrolyse der Lactoyl- und der Polymilchsäure, wodurch zum einen Milchsäure und zum anderen Natriumlactat entstehen. Durch Zugabe von Salzsäure bis zu einem pH-Wert von 7,0 wird auch das Natriumlactat zu Milchsäure umgesetzt, sodass folgend alle Milchsäuremoleküle, die zuvor in Estoliden verbaut waren, als freie Milchsäuren vorliegen.
Über die Zugabe von Ammoniummolybdat entsteht ein Lactat-Molybdän-Komplex, welcher den Betrag der optischen Drehung der Milchsäuremoleküle erhöht und damit die Empfindlichkeit der Messung steigert. Allerdings ist zu beachten, dass die Komplexbildung mit Molybdän zu einer Umkehr der Drehrichtung führt. Während (S)-Milchsäure rechtsdrehend ist, ist der Lactat-Molybdän-Komplex linksdrehend.1011
Wurden alle Anforderungen an die Probenvorbereitung erfüllt, kann eine der Arzneibuchvorschrift entsprechende polarimetrische Untersuchung durchgeführt und der Drehwinkel ermittelt werden.
Auswertung der Monographie
Der gemessene Drehwinkel wird gemeinsam mit dem in der Titration ermittelten Gehalt an Milchsäure sowie der für die Polarimetrie eingewogenen Probenmenge in die oben aufgeführte Formel eingesetzt. Hieraus ergibt sich der Prozentgehalt an (S)-Milchsäure innerhalb der Probe.
Die Prüfung auf Gehalt von (S)-Milchsäure entspricht den Anforderungen des Arzneibuchs, wenn die Probe einen Gehalt an Milchsäure zwischen 88,0 und 92,0% (über Titration bestimmt) und einen Gehalt an (S)-Enantiomer von mindestens 95% (über Polarimetrie bestimmt) aufweist. Ist eines der Kriterien nicht erfüllt, so entspricht die Prüfung nicht.12
Zur Veranschaulichung folgendes Beispiel:
Es wird eine Probe untersucht, deren Titration einen Gehalt an Milchsäure von 90,4% ergab. Für die polarimetrische Untersuchung wurden 2,21 g Probe eingewogen. Die Untersuchung ergab einen Drehwinkel von 1,95. Wenn nun alle Werte in die Formel eingesetzt werden, erhält man einen Gehalt an (S)-Milchsäure von 97,2%. Die Probe entspricht daher den Anforderungen des Arzneibuches.
Einzelnachweise
1 Eigene Grafik, Urheber: Krompholz, Marlon (Erstellt am 07.05.2021) ⇑
2 Kommentar zum Europäischen Arzneibuch (2020), 66. Aktualisierungslieferung, Kapitel 4.01/0458 Milchsäure ⇑
3 https://refubium.fu-berlin.de/bitstream/handle/fub188/10089/10_litavm.pdf?sequence=11&isAllowed=y Letztes Abrufdatum: 07.05.2021 14:00 Uhr ⇑
4 Schirmeister, Schmuck, Wich (2016), Beyer/Walter Organische Chemie, 25. Auflage, Stuttgart, Seite 403 ⇑
5 https://www.bcp.fu-berlin.de/studium-lehre/studiengaenge/chemie/bachelor/Interessen_loesungen/milchsaeure.html Letztes Abrufdatum: 07.05.2021 14:00 Uhr ⇑
6 Ph. Eur. (2020), 10. Auflage, 1. Nachtrag, Kapitel 10.0/1771 (S)-Milchsäure ⇑
7 Ph. Eur. (2020), 10. Auflage, 1. Nachtrag, Kapitel 10.0/1771 (S)-Milchsäure ⇑
8 Eigene Grafik, Urheber: Krompholz, Marlon (Erstellt am 07.05.2021) ⇑
9 Schirmeister, Schmuck, Wich (2016), Beyer/Walter Organische Chemie, 25. Auflage, Stuttgart, Seite 410 ⇑
10 Kommentar zum Europäischen Arzneibuch (2020), 66. Aktualisierungslieferung, Kapitel 4.00/1771 (S)-Milchsäure ⇑
11 Ph. Eur. (2020), 10. Auflage, 1. Nachtrag, Kapitel 10.0/1771 (S)-Milchsäure ⇑
12 Ph. Eur. (2020), 10. Auflage, 1. Nachtrag, Kapitel 10.0/1771 (S)-Milchsäure ⇑
TU-Braunschweig Institut für Medizinische und Pharmazeutische Chemie Seminar: Instrumentelle Analytik Kontakt: tubs@t-kellner.de