UV 4
Doppelbestimmung Riboflavin und Thiaminchlorid-HCL
Expertenbericht zum Praktikumsversuch
UV4
WiSe 2021/2022
Abgabedatum
08.12.2021
Expertengruppe 09
Lisa Heemeier
Benita Zumdohme
Jasmin Frey
Doppelbestimmung Riboflavin und Thiaminchlorid-HCl (UV4)
Inhaltsverzeichnis
Einleitung
Die UV-VIS-Spektroskopie macht sich die Eigenschaft von Stoffen zu Nutze, bestimmte Wellenlängen von Licht in einem gewissen Maß absorbieren zu können. Mit Hilfe dieser stoffspezifischen Eigenschaften lässt sich unter anderem der Gehalt bestimmen, ebenfalls lässt sich mit der UV/VIS-Spektrometrie auch die Identität bestimmen. Die Mechanismen dahinter sind in dem Wiki-Artikel für UV-VIS-Spektroskopie genauer beschrieben.
Versuchsbeschreibung
Ziel des Versuches ist es den Gehalt von Riboflavin (RV) und Thiaminchlorid-HCl (TAC) in einer Probe simultan zu bestimmen. Zu diesem Zweck werden die gemessenen Gesamtabsorptionen, eine Summe aus den gemessenen Einzelabsorptionen, bei zwei festgelegten Wellenlängen (247nm und 268nm) aufgenommen und mit zwei Gleichungen mit zwei Unbekannten berechnet (s.u. unter Auswertung). Wichtig ist bei einer Simultanbestimmung, dass einer der beiden Stoffe bei 247nm eine hohe Absorption hat, während der zweite eine niedrige aufweist. Dies sollte bei der zweiten Wellenlänge entsprechend umgekehrt sein. Die spezifische Absorption der Stoffe bei den entsprechenden Wellenlängen wird der Literatur entnommen.
Instrumenteller Aufbau
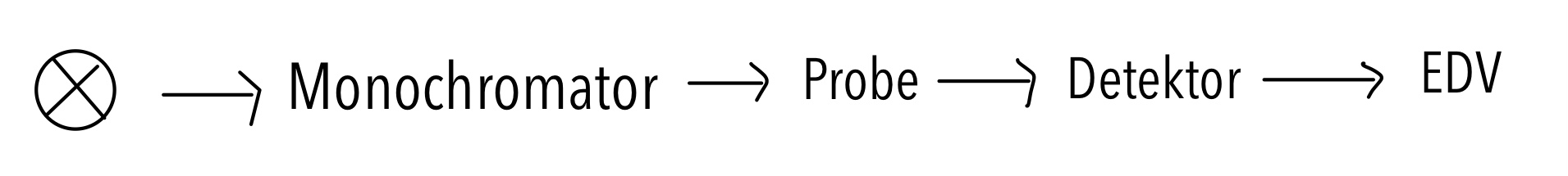
Für den Versuch wird ein Einstrahlphotometer verwendet. Dieses besteht aus einer Lichtquelle, dafür wird im UV-Bereich eine eine Wolframhalogenlampe (320-800nm), im VIS-Bereich eine Deuterium Lampe (200-320nm) oder um eine Xenonlampe (200-800nm) verwendet. Auf die Lichtquelle folgt ein Monochromator und die Probe. Bei einem Einstrahlphotometer müssen Probe und Referenz nacheinander vermessen werden. Als Detektor wird entweder ein Dioden-Array-Detektor (DAD) oder ein Photomultiplier verwendet. Die gemessenen Daten werden dann an die elektronische Datenverarbeitung geleitet, hierbei handelt es sich um einen Computer.In Abb. 1 ist noch einmal der schematische Aufbau zu sehen. Die genaue Beschreibung der einzelnen Bestandteile wird in dem folgenden Artikel genauer erläutert.
Folgend wird auf die praktische Umsetzung genauer eingegangen.
In Abb. 2 ist das Gerät von außen zu sehen. Es wird mit dem Gerät Specord 40 von Analytik Jena gearbeitet. Unter dem blauen Deckel befindet sich der Probenraum (s.Abb.2) Im Probenraum befindet sich die Halterung für die Küvette (s. Abb.3). Parallel zu dem Küvettenhalter gibt es auf beiden Seiten zwei Fenster. Das eine führt zu dem Detektor und das andere zur Lichtquelle.
Durchführung
Zur Herstellung der Analysenlösung wird der Inhalt einer Kapsel (siehe Abb.4) mithilfe eines Glastrichters in einen 50,0ml Braunglaskolben gefüllt (siehe Abb.5). Es wird ein Braunglaskolben verwendet, da das Riboflavin Licht empfindlich ist, bei sichtbarem Licht kommt es zur Abspaltung des Zuckers. Durch tropfenweise Zugabe von insgesamt 5 mL Salzsäure (6 mol/l) wird die Substanz gelöst. Um den Substanzverlust möglichst gering zu halten, können von diesen 5 mL einige Tropfen verwendet werden um die Kapsel zu spülen. Dazu werden diese vorsichtig mit einer Glaspipette eingeträufelt und in den Messkolben überführt. Zum Zweck des Arbeitsschutzes sollten hierbei Handschuhe getragen werden. Mit dem verbliebenen Volumen der Salzsäure in der Pipette wird der Glastrichter gespült. (siehe Abb.7).
Vor dem Auffüllen des Kolbens mit Wasser, muss die Substanz in der Salzsäure vollständig gelöst sein. Um dies besser erkennen zu können sollte man den Glaskolben gegen das Licht halten. Nun kann der Kolben mit demineralisiertem Wasser bis zur Eichmarke aufgefüllt und mehrmals geschwenkt werden. Darauffolgend werden 10,0ml entnommen und in einen 50,0ml Braunglaskolben gefüllt. Auch dieser wird bis zum oberen Meniskus mit demin. Wasser gefüllt und gut geschüttelt. Erneut werden 10,0ml der neu hergestellten Lösung entnommen und dieses mal in einen 100,0ml Braunglaskolben gefüllt, dieser wird wieder mit demin. Wasser aufgefüllt und geschüttelt. Damit ist die Versuchsvorbereitung abgeschlossen.
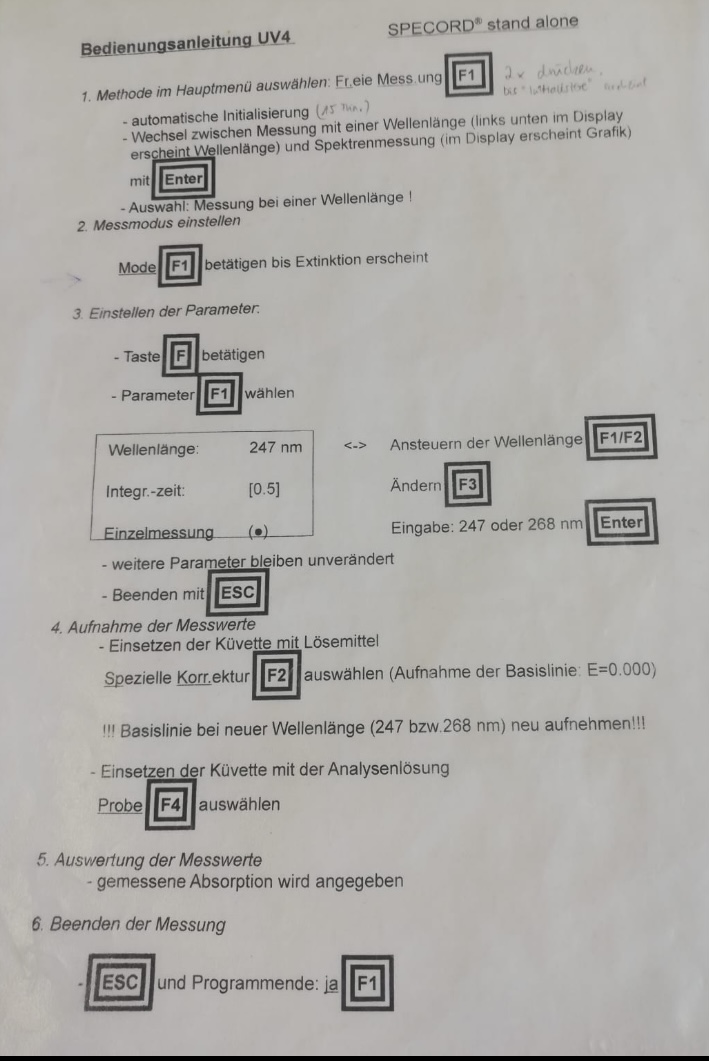
Zu Beginn der Messung wird der Blindwert bestimmt, damit die Eigenabsorption des Lösungsmittels von den Werten der Probe abgezogen werden können. Wichtig dabei ist es, die Küvette vor den Messungen immer mit der zu messenden Lösung zu spülen, um Verunreinigungen einer vorherigen Messung vorzubeugen. Außerdem sollte die Küvette nur an den matten Seiten berührt werden und vor dem Vermessen noch einmal auf Unreinheiten auf der Außenseite untersucht werden. Sollten Verunreinigungen vorhanden sein, so sollten diese mit einem Kosmetiktuch entfernt werden. Die Messung des Blindwertes und die Einstellung der Parameter wird nach der ausliegenden SOP durchgeführt (siehe Abb. 8, Punkt 3-4).
Nun wird mit der eigentlichen Vermessung der Analysenlösung begonnen. Die Küvette wird wie vorab beschrieben mit der Analysenlösung ausgespült und zu ¾ befüllt (siehe Abb 9).
>><<
Tipp: Die Messung findet überwiegend im oberen Bereich der Küvette statt, daher sollte sie ausreichend befüllt sein. Es sollte auch darauf geachtet werden, dass die hergestellte Lösung vor jedem Befüllen der Küvette nochmals geschwenkt wird, um eine gleichmäßige Konzentration zu gewährleisten. Das Behältnis wird mit dem Deckel in die Messvorrichtung des Einstrahlphotometers gestellt. Dabei ist darauf zu achten, dass die Küvette bündig zur Wand steht (siehe Abb. 10). Außerdem sollte die Küvette bei jeder Vermessung möglichst gleich eingesetzt werden, um einer Verfälschung des Messergebnisses entgegen zu wirken. Die Vermessung wird wieder nach der SOP durchgeführt (siehe Abb. 8, Punkt 4-5). Nach Anleitung der SOP wird nun der Parameter Wellenlänge von 247nm auf 268nm umgestellt und die Küvette erneut mit der Analysenlösung befüllt. Diese wird ebenfalls nach dem oben beschriebenen Verfahren vermessen.
Es sollten mindestens drei Messungen durchgeführt werden. Bei größeren Abweichungen der Messwerte bietet es sich an, eine weitere Messung durchzuführen.
Die verwendeten Analysenlösungen werden in den Behälter für wässrige Waschflüssigkeiten entsorgt.
Auswertung
Die Gesamtabsorbtion bei 247nm und 268nm kann durch folgende Formeln beschrieben werden.
⚠ $$ A_{\lambda1} = A^{1\%}_{1cm} \left({RV},{\lambda_{1}}\right) \cdot \beta_1 \cdot b + A^{1\%}_{1cm} \left(TAC, \lambda_1\right) \cdot \beta_2 \cdot b ⚠ $$
⚠ $$ A_{\lambda2} = A^{1\%}_{1cm} \left(RV, \lambda_2\right)\cdot \beta_1 \cdot b + A^{1\%}_{1cm} \left(TAC, \lambda_2\right) \cdot \beta_2 \cdot b ⚠ $$
Stellt man nun die 2. Gleichung nach ⚠ $ \beta_2 $ um und setzt diese in die 1. Gleichung ein, so können wir die Massen der beiden Stoffe wie folgt berechnen:
⚠ $$ m_{RV} = \frac {A_1 \cdot A^{1\%}_{1cm} \left(TAC, \lambda_2\right) - A_2 \cdot A^{1\%}_{1cm} \left(TAC, \lambda_1\right)}{A^{1\%}_{1cm} \left({RV},{\lambda_{1}}\right) \cdot A^{1\%}_{1cm} \left(TAC, \lambda_2\right) - A^{1\%}_{1cm} \left(RV, \lambda_2\right) \cdot A^{1\%}_{1cm} \left(TAC, \lambda_1\right)} \cdot \frac {1}{b} \cdot f ⚠ $$
⚠ $$ m_{TAC} = \frac {A_{1\%} \cdot A^{1\%}_{1cm} \left(RV, \lambda_2\right) - A_2 \cdot A^{1\%}_{1cm} \left(RV, \lambda_1\right)}{A^{1\%}_{1cm} \left({RV},{\lambda_{2}}\right) \cdot A^{1\%}_{1cm} \left(TAC, \lambda_1\right) - A^{1\%}_{1cm} \left(RV, \lambda_1\right) \cdot A^{1\%}_{1cm} \left(TAC, \lambda_2\right)} \cdot \frac {1}{b} \cdot f ⚠ $$
Legende ⚠ $A_1/A_2$:Absorptionen bei den Wellenlängen 247nm (⚠ $A_1$) und 268nm (⚠ $A_2$)⚠ $A^{1\%}_{1cm}$: Spezifische Absorption in ⚠ $100ml \cdot g^{-1} \cdot cm^{-1}$, entnommen aus der Tabelle⚠ $b$: Küvettenschichtdicke in cm⚠ $f$: Verdünnungsfaktor⚠ $E_\lambda$: molare Absorptionskoeffiziente⚠ ${I_{0}}$: Intensität des einstrahlenden Lichtes⚠ ${I_{1}}$: Intensität des ausstrahlenden Lichtes
In diese Formeln werden nun die gemessenen Werte der Gesamtabsorption, die Literaturwerte der spezifischen Absorption, die Schichtdicke der verwendeten Küvette sowie der Faktor für die durchgeführte Verdünnung eingesetzt.
Die Formel beruht auf dem Lambert-Beer'schen-Gesetzt ⚠ $ E_\lambda = \log_{10} \left(\frac{I_{0}} {I_{1}} \right) = \varepsilon_{\lambda} \cdot c \cdot b $. Sie eignet sich zur Gehaltsbestimmung, da der Gehalt proportional zur Absorption ist.
Einzelnachweise
Dr. Thomas Kellner, Skript Instrumentelle Analytik WiSe- 2021/22 Version 09: (Corona), 22. Oktober 2021
1 Gezeichnet von Lisa Heemeier ⇑
2 Bild von Lisa Heemeier, 02.12.2021 ⇑
3 Bild von Lisa Heemeier, 02.12.2021 ⇑
4 Bild von Lisa Heemeier, 02.12.2021 ⇑
5 Bild von Benita Zumdohme, 02.12.2021 ⇑
6 Bild von Lisa Heemeier, 02.12.2021 ⇑
7 Bild von Benita Zumdohme, 02.12.2021 ⇑
8 Bild von Lisa Heemeier, 02.12.2021 ⇑
9 Bild von Benita Zumdohme, 02.12.2021 ⇑
10 Bild von Benita Zumdohme, 02.12.2021 ⇑