UV 1
Titelblatt
Expertenbericht zum Praktikumsversuch
UV1
WiSe 2021/2022
Abgabedatum
16.12.2021
Expertengruppe 07
Leonie Heuter
Leonie Marie Janssen
Carlotta Schmidt-Müller
Identifizierung von Steroidhormonen (UV1)
Bestimmung der spezifischen Absorption
Inhaltsverzeichnis
Einleitung
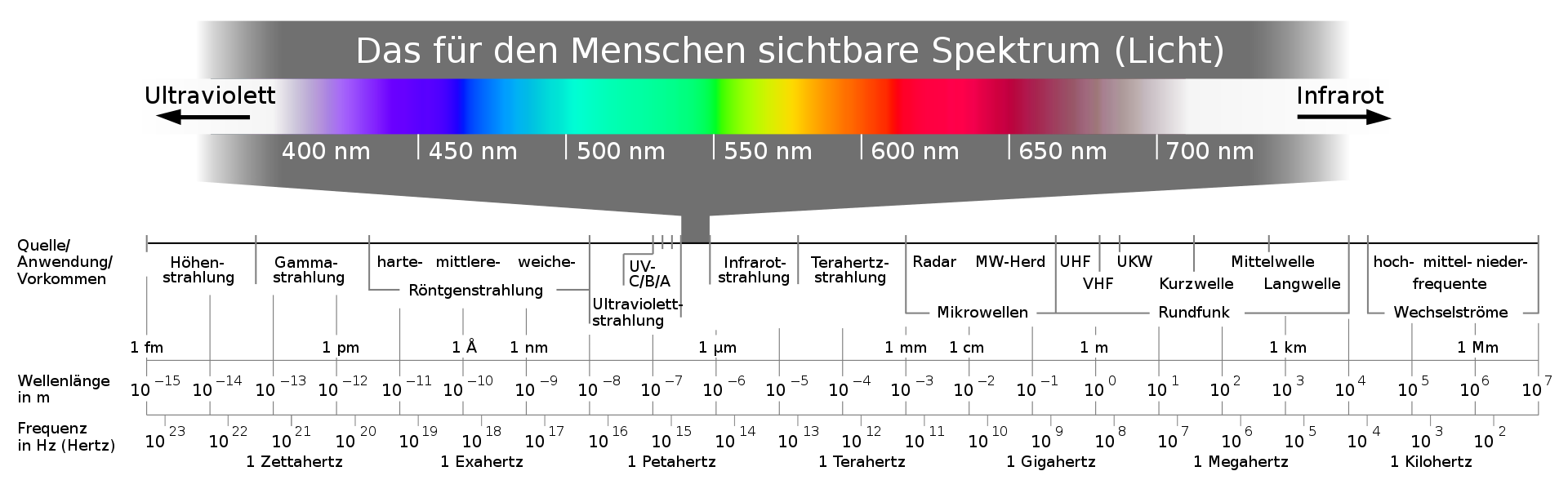
Das elektromagnetische Spektrum (der UV-Bereich ist dem kurzwelligeren Anteil des sichtbaren Lichtes angeschlossen) 1.
Die UV/VIS-Spektroskopie ist ein spektroskopisches Verfahren zur Identifizierung und Quantifizierung von Substanzen.
Grundlagen
Die Methode beruht auf der Absorption elektromagnetischer Strahlung, welche ihre Ursache in der Anregung von Elektronen hat.
Wenn die Strahlungsenergie der für einen Elektronenübergang nötigen Energie entspricht, können Elektronen auf ein höheres Energieniveau angehoben werden.
Dabei handelt es sich um Übergänge von σ-,π-oder n- Orbitalen auf angeregte, energetisch höherliegende π*- oder σ*-Orbitale.
Verantwortlich für die Absorption sind Chromophore innerhalb eines Moleküls, die in einem Farbstoff oder Pigment die Farbigkeit ermöglichen.
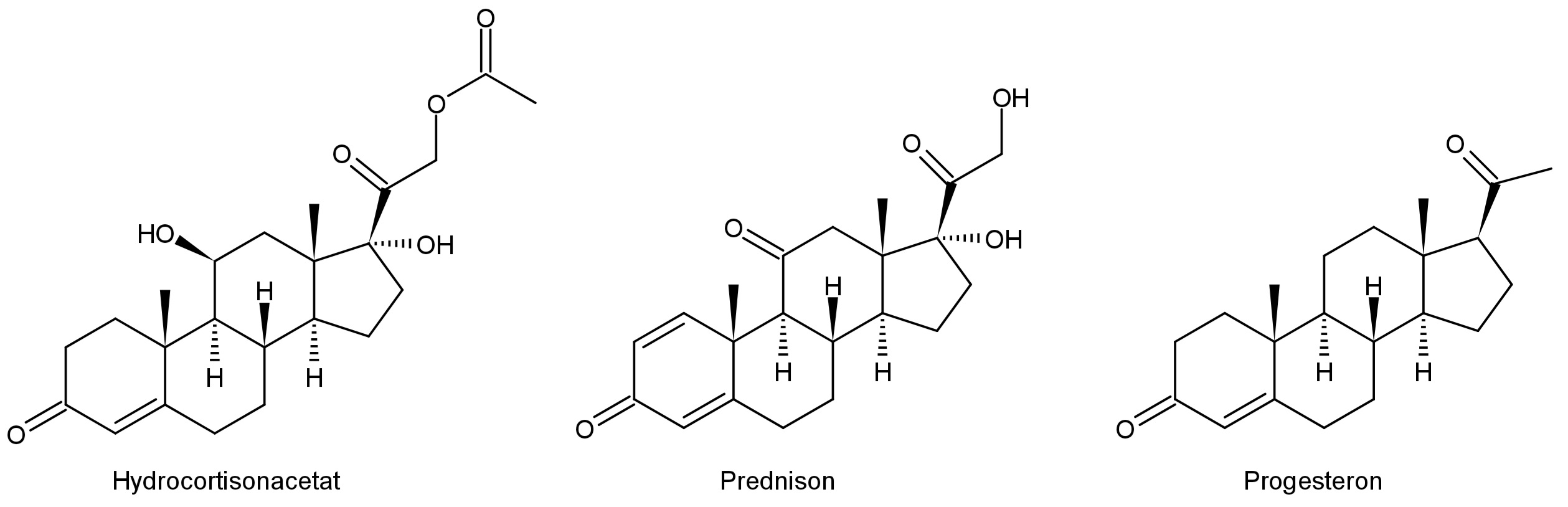
Beispiele für diese Chromophore sind Carbonyl-Teilstrukturen oder konjugierte Doppelbindungen wie die α,β-ungesättigten Ketone der in diesem Versuch untersuchten Steroidhormone.
Die Farbigkeit ist darauf zurückzuführen, dass nur bestimmte Wellenlängen absorbiert werden und die verbleibenden Wellenlängen, die keiner Absorption unterliegen, sich zu einer für das menschliche Auge sichtbaren Komplementärfarbe zusammensetzen. Die benötigte Energie für einen Elektronenübergang richtet sich nach der Größe des Chromophors. Mit zunehmender Anzahl konjugierter Doppelbindungen liegt ein immer größeres delokalisiertes π-Elektronensystem vor.
Daraus resultieren näher beieinander liegende Molekülorbitale, sodass weniger Energie (= größere Wellenlänge) für einen Elektronenübergang notwendig ist.
Dagegen benötigen kleinere Chromophore mehr Energie, um die Elektronen auf ein höheres Energieniveau anzuheben, da die Energieniveaus durch weniger delokalisierte Elektronen weiter auseinander liegen, weshalb kurzwelligeres Licht im UV-Bereich (380-100nm) zur Anregung erforderlich ist.
Beim Beispiel Hydrocortisonacetat liegt daher nur ein Absorptionsmaximum bei 240nm vor, da nur das α,β-ungesättigte Keton angeregt werden kann.
Die isolierten Chromophore lassen sich bei den verwendeten Wellenlängen (200 bis 300nm) nicht anregen, da sie mehr Energie benötigen (also kurzwelligeres Licht).
Versuchsbeschreibung
Im Praktikumsversuch UV1 wurden zwei Proben mit jeweils einer Substanz auf die Identität der drei Steroidhormone Hydrocortisonacetat, Prednison und Progesteron geprüft.
Dies ist möglich, weil jedes Molekül bzw. jede Substanz ein für sich charakteristisches, einzigartiges Absorptionsspektrum aufweist. Dementsprechend wurden anhand der Messung der Absorptionen, der Berechnung des molaren Absorptionskoeffizienten und der spezifischen Absorption die Werte der Proben mit denen der Literaturwerte der vorgegebenen Hormone verglichen. Am Ende des Versuches soll eine eindeutige Zuordnung zu einem der drei gegebenen Steroidhoromone möglich sein.
Dabei kann es vorkommen, dass beide Proben das gleiche Steroidhormon enthalten.
Die Absorption lässt sich auch durch das Lambert-Beer'sche Gesetz darstellen, mit dem wiederum die spezifische Absorption berechnet werden kann.
Lambert-Beer'sches Gesetz
⚠ $$ A=ϵ⋅c⋅b ⚠ $$
A = Absorption
ε = molarer Absorptionskoeffizient (l ⋅ mol-1 ⋅ cm-1)
c = Konzentration des Analyten in der Probe (mol ⋅ l-1)
b = Schichtdicke (cm)
Formel der spezifischen Absorption
⚠ $$ A^{1\%}_{1cm} = \left(\frac{10 \cdot ϵ}{M}\right) ⚠ $$
⚠ $A^{1\%}_{1cm}$ = spezifische Absorption (l ⋅ g-1 ⋅ cm-1)
ε = molarer Absorptionskoeffizient (l ⋅ mol-1 ⋅ cm-1)
M = Molare Masse des Analyten in der Probe (g ⋅ mol-1)
Instrumenteller Aufbau
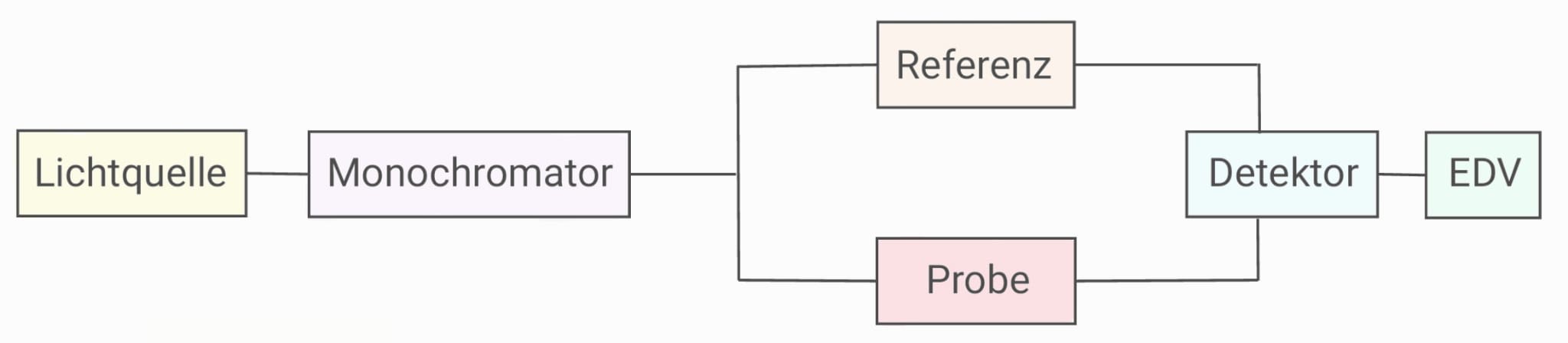
Verwendet wird das Specord 200 3, ein Zweistrahlphotometer, welches aus zwei großflächigen Photodioden besteht. Dies hat den Vorteil, dass eine gleichzeitige Messung von Probe und Referenz möglich ist. Dem gegenüber werden bei einem Einstrahlphotometer Referenz und Probe nacheinander vermessen.
Dabei werden Küvetten aus Quarzglas inklusive Deckel genutzt, da dieses im Gegensatz zu Glas bereits bei kleineren Wellenlängen keine Eigenabsorption mehr aufweist. So besteht beim Messen die Möglichkeit, einen großen Spektralbereich von 190nm bis 1100nm abzudecken.
Gerätequalifizierung
Das Arzneibuch stellt Anforderungen zur Prüfung mehrerer Parameter, sodass die Qualität des Gerätes sichergestellt ist. Dazu gehören die Richtigkeit der Wellenlänge und der Absorption, sowie das Streulicht und die spektrale Auflösung 4. Letzteres liegt beim dem Specord 200 zwischen 2 und 4 nm. Die interne Wellenlängenkalibrierung mit einem Filter (wie Holmiumperchlorat-Lösung R) sorgt in Kombination mit der Software für eine sehr gute Wellenlängenrichtigkeit (≤ ±0,5 nm) und Reproduzierbarkeit.
Die regelmäßigen Kontrollen dieser Parameter werden durch Angaben im Deutschen Arzneibuch (DAB) 5
und in internationalen Vorschriften des Europäischen Arzneibuches (Ph.Eur.) 6 vorgegeben und dienen der Überprüfung der Leistungsfähigkeit des Spektrometers.
Elemente und deren Funktion
Als erstes Element ist die Lichtquelle zu nennen, wobei hier die Deuteriumlampe zusammen mit der Halogenlampe zum Einsatz kommt. Durch die gleichzeitige Verwendung der beiden Lampen ist damit ein möglichst großer Anwendungsbereich (190-1100nm) sichergestellt. Da Störungen an der Lichtquelle zu einem fehlerhaften Ergebnis führen können, ist es von Bedeutsamkeit, fachgerecht mit diesen umzugehen. Schädigungen des Gerätes können unter anderem durch Flüssigkeiten sowie stark ätzende Stoffe oder aggressive Dämpfe entstehen.
Zunächst passiert der austretende Strahl der Lichtquelle den Monochromator, der für die Umwandlung des polychromatischen Lichts in monochromatisches Licht verantwortlich ist.
Dieses erfolgt an einem Gitter, bestehend aus Eingangsspalt, Dispersionselement und Ausgangsspalt.
Das eingestrahlte Licht (A) passiert den Eingangsspalt (B), wird an einem Konkavspiegel (C) reflektiert und an einem Gitter (D) in ein Lichtspektrum aufgefächert. Durch einen zweiten Spiegel (E) wird das Licht zum Ausgangsspalt (F) hin reflektiert, der nur die jeweils gewünschte Wellenlänge (G) austreten lässt.
Nach Erhalt eines monochromatischen Lichtstrahls trifft dieser auf die Probe. In diesem Versuch liegen die Hormone dabei gelöst in Methanol in Quarzküvetten vor, die nacheinander in die dafür vorgesehene Halterung des Gerätes eingebracht werden. Da gleichzeitig durch die mit Methanol befüllte Küvette der Blindwert ermittelt werden soll, ist darauf zu achten, dass die Küvette mit dem Lösungsmittel an der hinteren Stelle steht.
Das transmittierte Licht trifft zum Schluss auf den Leitfähigkeitsdetektor, der nach dem Prinzip des inneren inneren Photoeffekts funktioniert und aus Photonen ein elektrisches Signal erzeugt.
Wenn die Photonen auf die Photokathode treffen, werden Elektronen aus der Oberfläche der Dynoden (= Elektrode, an der eine Spannung anliegt) heraugelöst. Durch das angelegte elektrische Feld werden die freigesetzten Elektronen beschleunigt und treffen auf weitere Dynoden, an denen weitere Elektronen emittiert werden. So kommt zu einer Kaskade, da die Anzahl der Elektronen von Dynode zu Dynode zunimmt. Für diesen Effekt ist es notwendig, dass die Dynoden ein zunehmend positiveres Potential Richtung Anode aufweisen. Sobald die Elektronen auf die Anode treffen, kommt es zu einem Spannungsabfall über einen Widerstand. Diese Spannung stellt das Messsignal dar und wird durch das Computerprogramm WinASPECT in Form eines Spektrums als Funktion der Absorption zur Wellenlänge angezeigt.

SPECORD 200 (oben links), EDV-System mit dem Auswertungsprogramm WinASPECT (links unten) und geöffnetes Spektrometer mit Küvettenhalterung (rechts) und 10.
Durchführung
In dem Versuch werden zwei Proben (Probe a und Probe b) untersucht, die jeweils eine Konzentration von 3 ⋅ 10−5 mol ⋅ l−1 eines unbekannten Steroidhormons enthalten 11.
Für die Versuchsdurchführung werden zu Beginn das Spektrometer, der Computer, sowie der Bildschirm eingeschaltet und das Programm "WinAspect" geöffnet.
Durch Auswahl "Messung" im Programm und anschließender Auswahl des Parametersatzes kann die Geräteinitialisierung mit dem entsprechenden Button gestartet werden.
Diese Prozedur kann in etwa 20 Minuten andauern. Daher bietet es sich an, die Geräteinitialisierung direkt am Anfang zu starten und in der Zwischenzeit die Proben und den restlichen Laborplatz vorzubereiten.
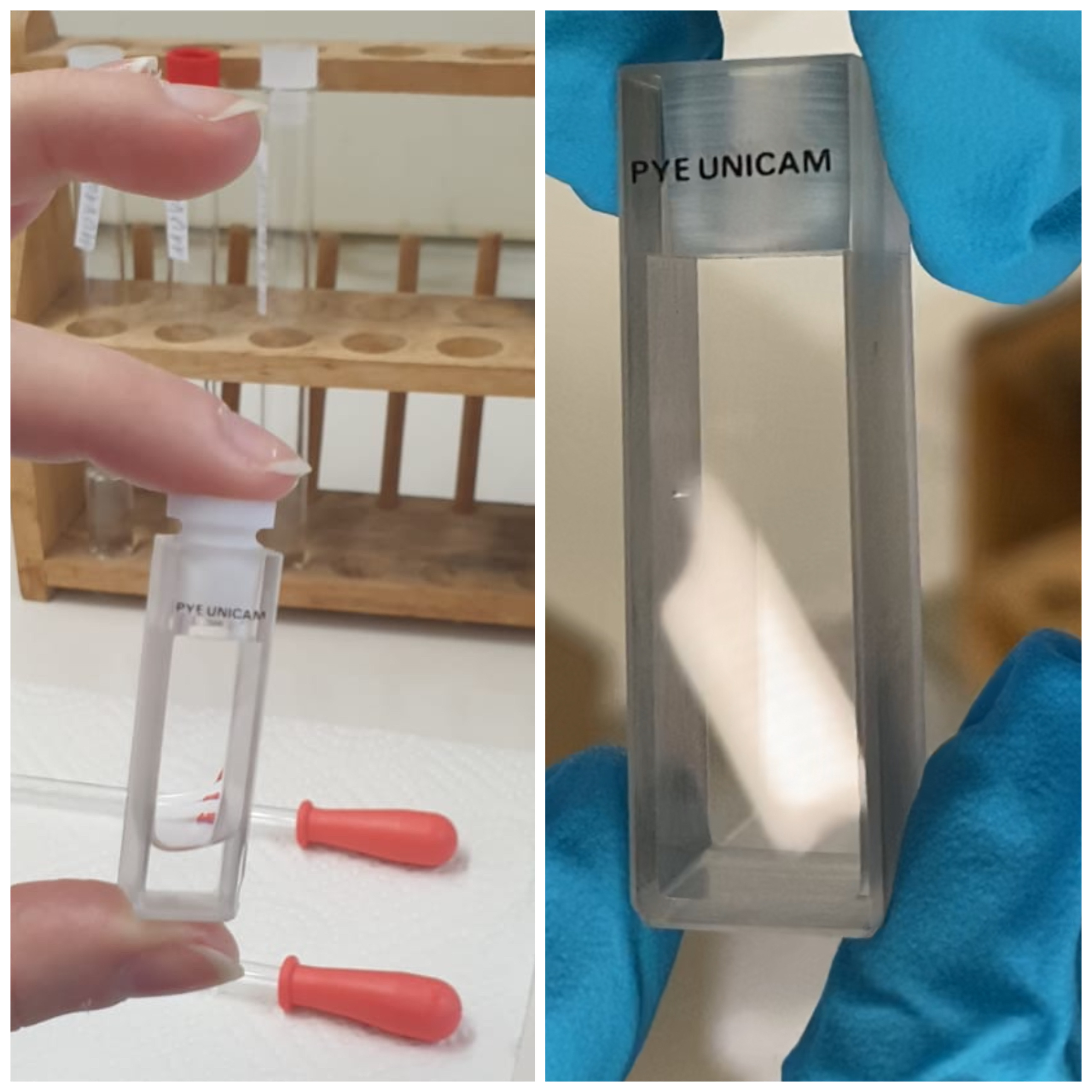
Umgang mit Küvetten
Küvetten dienen dazu, die Lösung bzw. die zuvor gelöste Substanz ins Spektrometer einzusetzen und somit untersuchen zu können.
Die Küvetten dürfen nur an den jeweils gegenüberliegenden matten Seiten angefasst werden, um eine fehlerfreie Messung zu gewährleisten.
Verunreinigungen außerhalb der Küvette (wie Fingerabdrücke, Schmutz oder Staubpartikel) sind zu vermeiden, da sie die die Messung verfälschen könnten und demnach die Absorption beeinflussen würden.
Aus diesem Grund werden die Küvetten vor dem Einsatz in das Spektrometer optisch überprüft und gegebenenfalls mit Wasser und ungefärbtem Zellstoff von außen gereinigt.
Organische Lösemittel und Spülmittel sind möglichst nicht zu verwenden.
Bestimmung des Blindwertes
Zu Beginn wird eine Vergleichsküvette mit Methanol (Reinheitsgrad für HPLC) mehrmals durchgespült und die Küvette anschließend zu ca. 60% befüllt, da das Licht nur den unteren mittleren Bereich der Küvette durchstrahlt.
Diese dient in der folgenden Messung zur Blindwertbestimmung, da Methanol in diesem Versuch als Lösemittel für die Proben verwendet und eine geringe Eigenabsorption aufweist.
Durch die gleichzeitige Messung wird durch die Software die Absorption des Methanols von der der Probe abgezogen, sodass nur noch die eigentliche Absorption der Steroidhormone übrig bleibt.
Da Methanol eine leichtentzündliche und giftige Flüssigkeit ist, sollte Hautkontakt vermieden werden. Bei Verwendung einer Pipette ist darauf zu achten, dass diese sauber und trocken ist.
Probe a
Für die Probenmessung wird die zweite Küvette mehrmals mit der Probenlösung a durchgespült und anschließend zu ca. 60% mit Probelösung a befüllt.
Da es sich um ein Zweistrahlphotometer handelt, ist die gleichzeitige Messung von Referenz und Probe möglich. Die Küvette mit der Referenz wird dafür hinten und die der Probelösung vorne in das Photometer bündig an die rechte Anlage des Küvettenhalters eingesetzt. Hierbei ist darauf zu achten, dass sich die klaren Seiten nicht an der Wand der Halterung befinden, sondern für den Lichtstrahl durchlässig sind.
Da die Schichtdicke einen entscheidenden Faktor der Extinktionsmessung darstellt, ist es ebenfalls wichtig, dass die Küvetten bei wiederholter Messung in die gleiche Lage und Position, beispielsweise mit der Beschriftung auf der Küvette zur Lichtquelle zeigend, gebracht werden, da so Keil- oder Winkelfehler bzw. paralleler Versatz der Strahlung verhindert werden kann, was sonst zu Messfehlern führen würde.
Nach dem Einsatz der Küvetten wird der Deckel des Spektrometers geschlossen und die Messung mithilfe des zuvor gestarteten Programms „WinASPECT“ begonnen. Dafür wird in der Menüleiste das Kamera-Symbol ausgewählt.
Nach der ersten Messung wird die Probenküvette entleert und in gleicher Weise wie zuvor beschrieben mit Probelösung a neu befüllt.
Mit Bestätigung der Taste "Start nächster Zyklus" beginnt die zweite Messung.
Dieser Vorgang wird zwei weitere Male wiederholt, sodass insgesamt drei Messungen mit der Probelösung a durchgeführt wurden. Die Taste "Start nächster Zyklus" wird nach der dritten Messung mit "nein" beantwortet.
Im nächsten Schritt kann die Abbildung des Spektrums maximiert und in der Registrierkarte die Tabelle auswählt werden.
Aus den in der Tabelle aufgelisteten Werten werden die Absorptionsmaxima und die Absorption bei 295nm abgelesen und notiert.
Durch Subtraktion der Restabsorption des Lösemittels Methanol von der Absorption bei 295nm ist eine Korrektur der Messwerte möglich.
Die Messung für Probe a ist somit abgeschlossen und die Tabelle kann ohne Datenspeicherung geschlossen werden.
Probe b
Die Messung der Probelösung b wird in gleicher Weise wie Probe a durchgeführt.
Entsorgung
Die Entsorgung der Lösemittel- und Probelösungen erfolgt im Sammelgefäß für organische Abfälle.
Auswertung
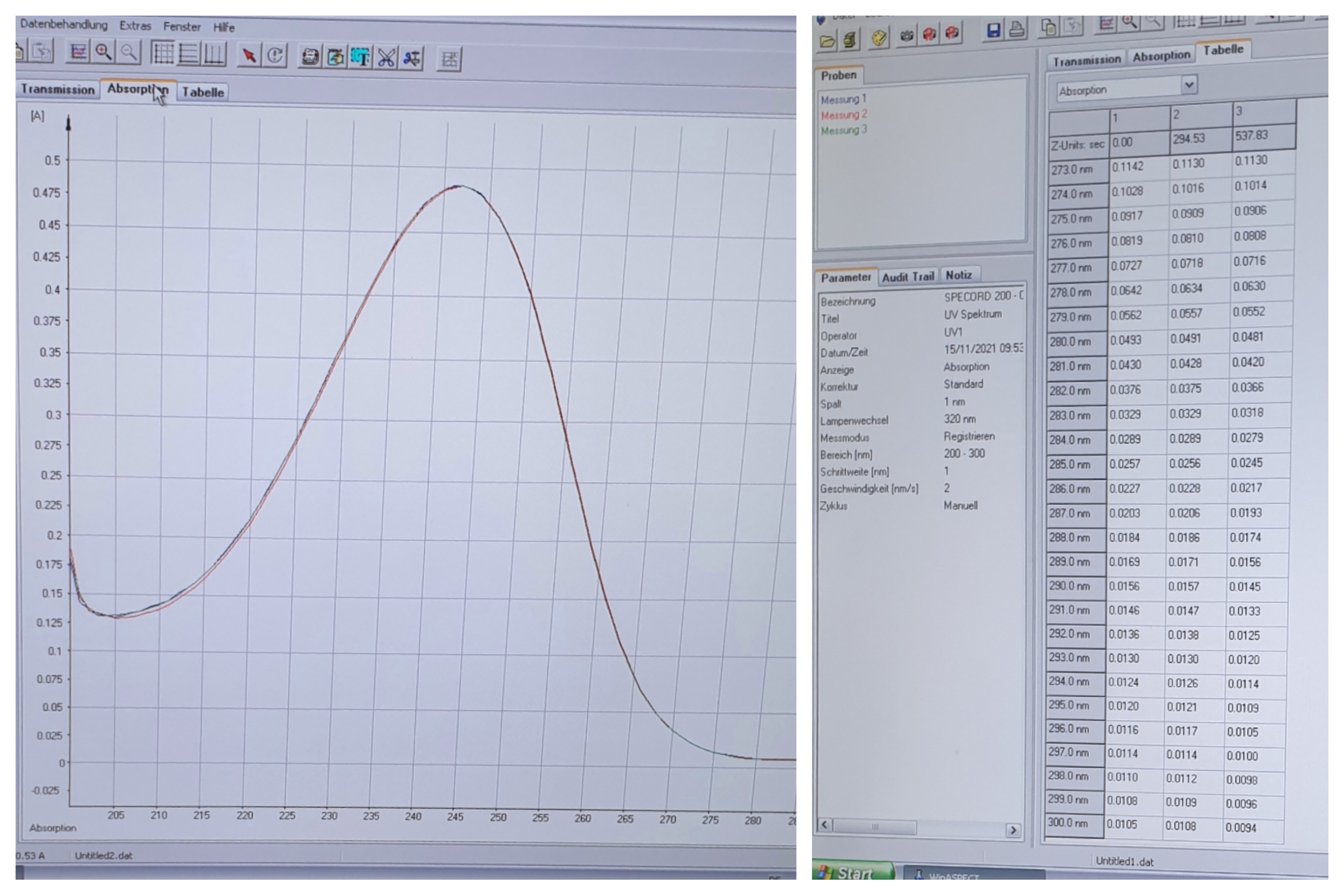
Graph der Absorptionen für die jeweilige Wellenlänge (links), Tabelle mit Messergebnissen (rechts) 14.
Durch die Messung des Photometers werden die für die Wellenlängen entsprechenden Absorptionen tabellarisch aufgeführt und die Absorptionen der Maxima der Proben herausgesucht. Da drei Messungen durchgeführt wurden, werden auch drei Absorptionen zur Berechnung des Mittelwertes genutzt.
Die Abhängigkeit der Absorption (A) von dem molaren Absorptionskoeffizienten (ϵ), der Konzentration (c) der Lösung, in diesem Versuch 3 ⋅ 10−5 mol ⋅ l−1, und der Schichtdicke (d) lässt sich durch das Lambert-Beer'sche Gesetz darstellen.
⚠ $ A = ϵ \cdot c \cdot d $
Durch das Umstellen der Gleichung kann der molare Absorptionskoeffizient berechnet werden, der für den nächsten Schritt benötigt wird.
⚠ $ ⇒ ϵ= \left(\frac{A}{c \cdot b}\right) $
Der molare Absorptionskoeffizient der unbekannten Substanz in der Probe wird daraufhin mit den Literaturwerten der drei möglichen, bekannten Steroidhormone verglichen.
Für die nächste Berechnung wird die molare Masse (M) des Hormons verwendet, bei dem der errechnete Wert am nächsten am Literaturwert liegt.
Anhand dieser und des schon zuvor errechneten molaren Absorptionskoeffizienten wird die spezifische Absorption (⚠ $A^{1\%}_{1cm}$) berechnet. Sie gibt die Absorption einer 1 %igen Lösung (10 g ⋅ l-1) an, weswegen die Multiplikation mit zehn im Zähler für die Berechnung notwendig ist, und gilt für bestimmte Wellenlängen bei einer Schichtdicke von 1 cm.
⚠ $ A^{1\%}_{1cm} = \left(\frac{10 \cdot ϵ}{M}\right) $
Zum Vergleichen, ob auch die richtige molare Masse verwendet wurde, werden die Literaturwerte der Tabelle noch einmal herangezogen. Abschließend werden die spezifischen Absorptionen im Protokoll mit drei signifikanten Stellen angegeben.
Tabelle: Stoffdaten der drei möglichen Steroidhormone
| Hormon | Molare Masse in g ⋅ mol-1 | Spez. Absorption ⚠ $A^{1\%}_{1cm}$ in l ⋅ g-1 ⋅ cm-1 | Molare Absorption ε in l ⋅ mol-1 ⋅ cm-1 |
|---|---|---|---|
| Hydrocortisonacetat | 404,5 | 400 | 16180 |
| Prednison | 358,4 | 420 | 15050 |
| Progesteron | 314,5 | 535 | 16830 |
Einzelnachweise
1 Von Horst Frank / Phrood / Anony - Horst Frank, Jailbird and Phrood, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=3726606, Stand: 05.12.2021 Abb. 1 ⇑
2 gezeichnet mit Samsung Notes von Leonie Heuter am 05.12.2021 Abb. 2 ⇑
3 vgl. Analytik Jena SPECORD 200 PC Bedienungsanleitung, https://www.manualslib.de/manual/769968/Analytik-Jena-Specord-200-Pc.html, Stand: 15.12.2021 ⇑
4 Ph.Eur. 10.0/2.02.25.00 ⇑
5 DAB-Vorschrift; https://arzneibuch.de/arzneibuch/arzneibuch/start.xav?lang=de, Stand: 08.12.2021 ⇑
6 Ph.Eur. 10.0/2.02.25.00; https://arzneibuch.de/arzneibuch/arzneibuch/start.xav?lang=de#__arzneibuch__%2F%2F*%5B%40attr_id%3D%27eab_numtext-2.02.25.00%27%5D__1638987241686, Stand: 08.12.2021 ⇑
7 https://www.nikonschool.it/experience/colore-melis2.php, Stand: 15.12.2021 Abb. 3 ⇑
8 vgl. Optische Methoden: UV/VIS-Spektroskopie, Seminarskript Dr. Thomas Kellner, Instrumentelle Analytik, 4. Semester Pharmazie, WiSe 21/22 Abb. 4 ⇑
9 Aufbau Zweistrahlphotometer SPECORD, https://www.manualslib.de/manual/769968/Analytik-Jena-Specord-200-Pc.html, Stand: 15.12.2021 Abb. 5 ⇑
10 fotografiert von Carlotta Schmidt-Müller am 09.11.2021 in den Laborräumlichkeiten der TU Braunschweig, Raum 166 Abb. 6 ⇑
11 vgl. S.37ff, Praktikumsskript Dr. Thomas Kellner, Instrumentelle Analytik, 4. Semester Pharmazie, WiSe 21/22 ⇑
12 fotografiert von Leonie Heuter am 15.11.2021 (links) und fotografiert von Carlotta Schmidt-Müller am 09.11.2021 (rechts) in den Laborräumlichkeiten der TU Braunschweig, Raum 166 Abb. 7 ⇑
13 fotografiert von Leonie Heuter am 15.11.2021 und fotografiert in den Laborräumlichkeiten der TU Braunschweig, Raum 166 Abb. 8 ⇑
14 fotografiert von Leonie Heuter am 15.11.2021 (links) und fotografiert von Carlotta Schmidt-Müller am 09.11.2021 (rechts) in den Laborräumlichkeiten der TU Braunschweig, Raum 166 Abb. 9 ⇑
15 gezeichnet mit KingDraw Chemical Structure Editor von Leonie Heuter am 05.12.2021 Abb. 10 ⇑