Potp H
Titelblatt
Expertenbericht zum Praktikumsversuch
Pot.pH
WiSe 2021/2022
Abgabedatum
08.12.2021
Expertengruppe 02
Lena Koch
Priska Nonnenmacher
Malte Schnöckelborg
Simultanbestimmung von Dihydrogen- und Hydrogenphosphat (Pot.pH)
Inhaltsverzeichnis
Einleitung
Bei dem Versuch der Simultanbestimmung von Dihydrogen- und Hydrogenphosphat (Pot. pH) kommt die instrumentelle Methode der Potentiometrie zum Tragen. Dabei wird die Potentialdifferenz zwischen einer Bezugselektrode und einer Indikatorelektrode im stromlosen Zustand gemessen.1 Es handelt sich in diesem Versuch um eine Säure-Base-Titration, bei der die Bestimmung des pH-Wertes potentiometrisch ermittelt wird. Die Potentiometrie ist eine vielseitige instrumentelle Methode, da sie sich nicht nur wie hier für Säure-Base-Titrationen eignet, sondern auch für Fällungs-, Redox- und komplexometrische Titrationen genutzt werden kann. Außerdem sind auch potentiometrische Direkttitrationen möglich, wobei anhand des gemessenen Potentials an einer ionenselektiven Elektrode direkt der Gehalt in der Probe ermittelt werden kann.
Versuchsbeschreibung

Abb.1 | Übersicht Laborbank zum Versuch: Simultanbestimmung von Dihydrogen- und Hydrogenphosphat (pot. pH), Raum 156 2
Bei dem Versuch der Simultanbestimmung (latein: simul = zugleich, zusammen) 3 geht es um die gleichzeitige Bestimmung von Dihydrogen- und Hydrogenphosphat.
Diese erfolgt quantitativ und wird nach abgeschlossener Durchführung in der Massenkonzentration ⚠ $\beta $ angegeben.
Durch diesen Versuch kann einerseits das Grundprinzip der Potentiometrie verinnerlicht und andererseits eine Methode zur Gehaltsbestimmung von Dihydrogen- und Hydrogenphosphat erlernt werden. Im europäischen Arzneibuch wird diese Methode etwa bei der Gehaltsbestimmung von Natriummonohydrogenphosphat-dodecahydrat 4 erwähnt, welches oft in Augentropfen zur Anwendung kommt.
Somit zeigt sich, dass es sich bei dem Versuch um eine Verknüpfung von einer chemisch-analytischen sowie pharmazeutisch relevanten instrumentellen Methode mit einer quantitativen Gehaltsbestimmung handelt.
Prinzipieller Ablauf der Titration
Als Erstes wird Salzsäure im Überschuss zu der Probe hinzugegeben ⚠ $\rightarrow$ das gesamte Monohydrogenphosphat in der Probe wird zu Dihydrogenphosphat umgesetzt.
⚠ $$ H_3O^{+} + HPO_4^{2-} \rightarrow H_2PO_4^} + H_2O \nrightarrow reagiert \ nicht \ mit \ HCl ⚠ $$ ⚠ $$ H_2PO_4^{⚠ $$
Es wird mit Natriumhydroxid-Lösung titriert. Es handelt sich also bis zum ersten Äquivalenzpunkt um eine Rücktitration der überschüssigen Salzsäure.
⚠ $$ H_3O^{+} + OH^{-} \rightarrow H_2O ⚠ $$ ⚠ $ \rightarrow $ dieser wird erreicht, wenn die gemessene Spannungsänderung maximal ist.
Bis zum zweiten Äquivalenzpunkt wird das gesamte Dihydrogenphosphat erfasst.
⚠ $$ H_2PO_4^} + OH^{ \rightarrow HPO_4^{2-} + H_2O ⚠ $$ ⚠ $ \rightarrow $ Die Differenz der gesamten Stoffmenge der Salzsäure und der vom ersten Äquivalenzpunkt wird mit der Stoffmenge von Dihydrogenphosphat am zweiten Äquivalenzpunkt verrechnet, um den Gehalt vom ursprünglichen Monohydrogenphosphat zu erhalten. 5
Instrumenteller Aufbau
Während es zum einen die Möglichkeit gibt, eine Titration mit einem Becherglas und einer manuellen Bürette durchzuführen, wird bei dieser Simultanbestimmung ein Titrierautomat benutzt. Dieser besteht aus mehreren miteinander vernetzten Bestandteilen und ist in der Lage den Vorgang der Titration autonom durchzuführen. Dadurch, dass der Vorgang nach einigen Vorbereitungsschritten, wie zum Beispiel der Vorbereitung der Analysenlösung und das Auffüllen an Maßlösung, weitgehend automatisch durchgeführt wird, werden mögliche Fehlerquellen minimiert. Im Umkehrschluss bedeutet das, dass die daraus resultierenden Massenkonzentrationswerte besser bestimmt werden können, wodurch ebenfalls die quantitativen Messergebnisse präziser werden.
Instrumenteller Aufbau des Titrierautomaten
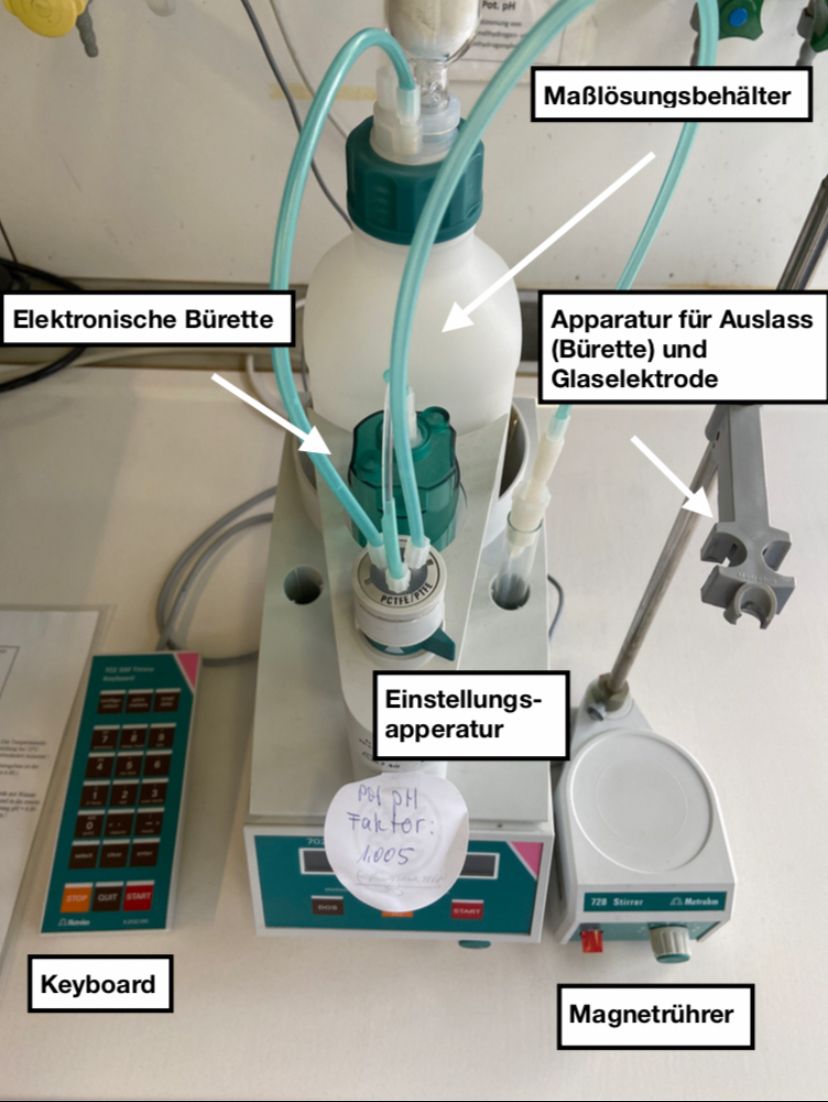 Abb.2 | Übersicht des Titrierautomaten und weiterer Bestandteile 6
Abb.2 | Übersicht des Titrierautomaten und weiterer Bestandteile 6
Bei dem Versuch wird die Titration mithilfe des Titrierautomaten 702 SM TITRINO von Metrohm durchgeführt. Zu diesem Automaten gehört eine Glasflasche, die als Behältnis für die Maßlösung verwendet wird. Diese besitzt einen verschraubbaren Deckel, in dem sich mehrere Löcher für Schläuche befinden. Zusätzlich ist in einer der Öffnungen ein Trockenrohr angebracht, dieses sorgt für einen Druckausgleich und verhindert dabei einen Feuchtigkeitseintrag. Ein weiterer Bestandteil des Titrierautomaten ist ein Display, auf welchem während der Titration die aktuelle Zugabe der Maßlösung angezeigt wird sowie am Ende der Titration der finale Verbrauch der zugegebenen Maßlösung. Darunter befinden sich drei Tasten. Ganz links die Taste DOS, in der Mitte STOP, gefolgt von der START-Taste, die ganz rechts liegt. Hauptsächlich wird die Durchführung der Titration mit diesen Bedienelementen gesteuert. Zusätzlich ist ein Keyboard angeschlossen, auf welchem weitere Tasten mit Zahlen vorhanden sind. Diese dienen der Einstellung des Automaten sowie gegebenenfalls die der angeschlossenen Komponenten und dessen Kalibrierung.
Ebenfalls wichtig ist die Einstellungsapparatur. Diese sorgt für die passende Einstellung der elektrischen Bürette, die ein definiertes Volumen an Maßlösung aus dem Behältnis entnimmt. Durch Verschieben eines Reglers sind verschiedene Volumina einstellbar. Zusätzlich zeigt eine Anzeige, die sich zentral auf der Apparatur befindet, das maximale Volumen an, das in der Bürette vorhanden ist. Die elektronische Bürette liegt dabei zwischen dem Maßlösungsbehälter und der Einstellungsapparatur. Damit es in der Zeit, in der keine Titration durchgeführt wird, zu keiner Verschmutzung der Bürette kommt, sind links und rechts in dem Titrierautomaten runde Vertiefungen eingearbeitet, in denen Reagenzgläser eingestellt werden können. In diese Gläser kann die Bürettenspitze inklusive Befestigungsapparatur hinein gestellt werden.
Des Weiteren verfügt das Gerät über Anschlüsse für die Glaselektrode sowie für ein zusätzlichen Magnetrührer 728 STIRRER, auf dem sich während des Vorgangs der Titration das Becherglas mit der Analysenlösung befindet. Damit die Messdaten, die während der Titration gewonnen wurden, visuell in Form eines Graphen ausgewertet werden können, ist zusätzlich ein Drucker angeschlossen.
 Abb.3 | Elektronische Bürette, links: vom Titrierautomat, rechts: vom Dosimat 7.
Abb.3 | Elektronische Bürette, links: vom Titrierautomat, rechts: vom Dosimat 7.
Funktionsweise der elektronischen Bürette
Bei der elektronischen Bürette handelt es sich um eine Apparatur, die eine autonome Zugabe der Maßlösung mit einem genau festgelegten Volumen ermöglicht. Sie besteht aus einem Glaszylinder, dessen Durchmesser sich nach oben hin verkleinert. In diesem Bereich ist durch einen Stopfen ein Schlauch befestigt, der mit dem Vorratsbehälter verbunden ist. In diesem Glaszylinder befindet sich eine Gewindestange, an der im oberen Bereich eine Plastikapparatur in Zylinderform angebracht ist. Diese besitzt Dichtungsringe, die an die Innenseite des Glaszylinders drücken. Dadurch wird gewährleistet, dass die Flüssigkeit, in diesem Fall die Maßlösung, nicht in das Gerät hineinfließt. Durch einen Schrittmotor, der die Gewindestange antreibt, kommt es zu einer elektronischen Signalverarbeitung. Hierdurch ist eine präzise Zugabe der Maßlösung möglich. Da das Signal, das an den Motor gesendet wird, immer je nach ausgewähltem Volumen gleich ist, ist auch die Volumenzugabe in das Becherglas bei jedem Durchgang die Gleiche. Durch diesen Vorgang wird auch bei mehreren Titrationen immer ein fest definiertes Volumen aus dem Maßlösungsbehältnis entnommen und durch einen kleinen Schlauch in das Becherglas hinzugegeben. Dadurch, dass die Auflösung bei bis zu 0,001 ml vorliegt, ist im Zusammenhang mit der Glaselektrode ein sehr genauer Titrationsverlauf möglich, der exakte Messwerte für die Auswertung liefert. 8
Instrumenteller Aufbau der Glaselektrode
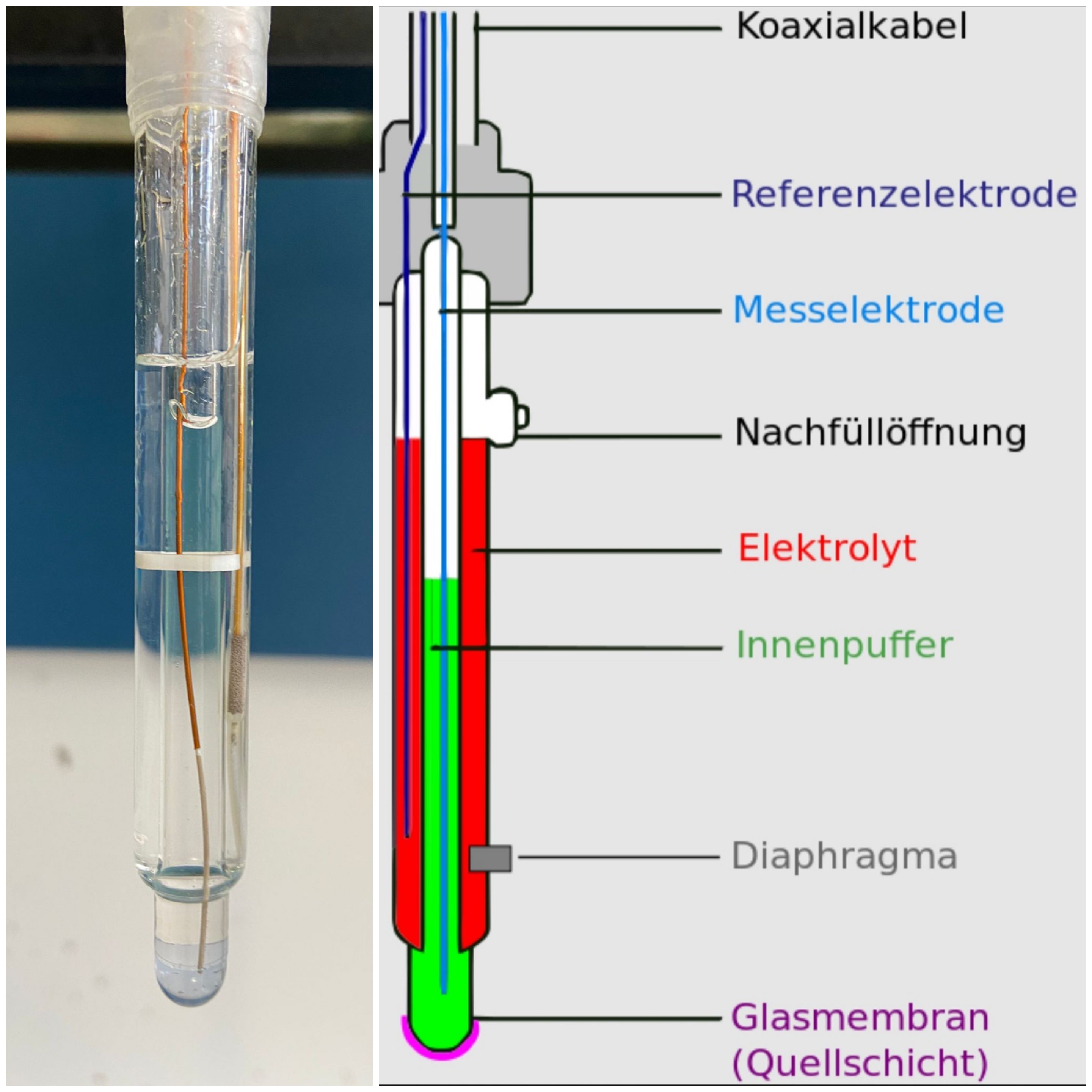 Abb.4 | Glaselektrode, links: Glaselektrode aus dem Versuch, rechts: Übersichtsschema Aufbau einer Glaselektrode 9
Abb.4 | Glaselektrode, links: Glaselektrode aus dem Versuch, rechts: Übersichtsschema Aufbau einer Glaselektrode 9
Die Glaselektrode ist eine Einstabmesskette. Sie gehört zu den pH-sensitiven Elektroden und besitzt eine pH-empfindliche Glasmembran mit Quellschicht am unteren Ende. Diese Membran wird in die Probelösung getaucht. Die Glaselektrode besitzt an der Glasmembran eine innere Bezugselektrode, bei der es sich um eine Silber-Silberchlorid-Elektrode (SSE) handelt und die als Messelektrode dient. Die innere Schicht ist mit einer Kaliumchlorid-Lösung (c = 3 mol/L), die auf einen pH-Wert von 7,0 gepuffert ist, umgeben und heißt Kalibrierlösung. Außerdem gibt es noch eine äußere Bezugselektrode (auch SSE) und ein Diaphragma, das die Probelösung von der Elektrolytlösung trennt 10.
Es kommt zu der Ausbildung eines pH-abhängigen Potentials durch Austausch von Protonen der Probelösung mit Alkali-Ionen der Glasmembran an der Phasengrenzfläche von Glas und Lösung. Diese Potentialdifferenz lässt sich durch hochohmige Voltmeter messen. Das Phasendiagramm der Glaselektrode lautet:
⚠ $$ Ag|AgCl, Cl^}, H^} || Glas|H^{ || Cl^{, AgCl|Ag ⚠ $$
Instrumenteller Aufbau und Funktionsweise Diaphragma
Ein Diaphragma besteht grundsätzlich aus einer Membran. Diese kann mit keramischen Materialien oder Ionenaustauscherharzen gefüllt sein. Eine der Grundvoraussetzungen des Diaphragmas ist, dass es sich nicht durch die Umgebung zersetzten lässt und die Trennung von zwei Lösungen gewährleistet. Trotz dieser Eigenschaft muss das Diaphragma elektrolytisch leitend sein. Es soll die Vermischung von den Lösungen verhindern, aber trotzdem den Ionenstrom, der in der Elektrolytlösung herrscht, ermöglichen. Das Diaphragma dient also als Brücke zwischen den Elektrolytlösungen, sodass die Ionen räumlich voneinander getrennt sind, aber trotzdem noch wandern können.11
 Abb.5 | Magnetrührer 12
Abb.5 | Magnetrührer 12
Instrumenteller Aufbau und Funktion des Magnetrührers
Ein zusätzliches Bauteil, das an den Titrierautomat angeschlossen ist, ist der Magnetrührer vom Typ 728 STIRRER von dem Hersteller Metrohm. Hierbei handelt es sich um eine Apparatur, die aus einer Magnetplatte in Kombination mit einem Magnetstab, auch Rührfisch genannt, besteht. Der Magnetfisch ist von außen mit einem Kunststoffüberzug bezogen. Dadurch wird die Reibung im inneren des Becherglases vermindert. 13 Auf der linken Seite befindet sich der An- und Ausstellknopf. Durch einen Regler, der sich auf der rechten Vorderseite des Geräts befindet, kann die Intensität des Feldes stufenlos von eins bis zehn eigestellt werden. Durch den Einsatz des Magnetrührers wird die autonome und vollständige Durchmischung der einzelnen Bestandteile ermöglicht. Dies ist eine wichtige Grundvoraussetzung bei der Titration, da sie zur besseren Erkennung des Potentialsprungs der Analyten führt.
Instrumenteller Aufbau des Dosierhilfeautomaten (Dosimat)
 Abb.6 | Übersicht der Bestandteile des Dosierhilfeautomaten 14
Abb.6 | Übersicht der Bestandteile des Dosierhilfeautomaten 14
Der Aufbau des Dosimaten (665 Dosimat, Hersteller: Metrohm) ähnelt stark dem des Titrierautomaten. Zum einen beinhaltet er wieder einen Vorratsbehälter, in welchem mehrere Öffnungen für Schläuche sowie eine Aussparung für ein Trockenrohr mit Füllung vorgesehen sind. Dies hat den Grund, dass keine Luftfeuchtigkeit in die Lösung gelangen soll, da es ansonsten zu unerwünschten Reaktionen kommen könnte. Zusätzlich bietet die Öffnung des Trockenrohrs eine Möglichkeit zum Druckausgleich. Die Flüssigkeit wird aus dem Behälter gesaugt, dabei könnte ohne Druckausgleich ein Unterdruck entstehen, wodurch das Gerät kaputt gehen könnte. Der Vorratsbehälter ist hier nicht für die Maßlösung, sondern für eine Lösung, die der Analysenlösung in einem bestimmten Volumen zugesetzt werden soll. Hier in diesem Versuch für die Salzsäure.
Im Vergleich zum Titrierautomten ist die Funktionsweise der elektronischen Bürette jedoch gleich. Sie wird ebenfalls über einen Schrittmotor betrieben und hat die Aufgabe das exakte Volumen über einen Auslassschlauch in das Becherglas zu geben. Hier in diesem Versuch genau 5,00 mL. Dieser Schlauch besitzt oben eine kleinere, verdickte Umrandung, wodurch die Auslassspitze an einem Stativ befestigt werden kann. Zusätzlich befindet sich neben dem Vorratsbehälter eine Halterung in Form eines Reagenzglases, in welcher der Bürettenauslassschlauch bei Nichtverwendung aufgesteckt werden kann.
Genau wie bei dem Titrierautomaten gibt es eine Fassung, in der die Schläuche zusammenkommen. Das Volumen in der elektronischen Bürette wird (im Vergleich zum Titrierautomaten) vorher nicht verändert, es ist auf 20,0 mL voreingestellt. Auf der Vorderseite des Dosimaten befindet sich ein Display, auf welchem das zugefügte Volumen der Lösung abgelesen werden kann sowie drei Knöpfe mit FILL, CLEAR und GO. Der Drehregler unter den Knöpfen beinhaltet eine Skala von 1-10.
Durchführung
Kalibrierung
Als Erstes wird der Titrierautomat eingeschaltet. Es muss eine Kalibrierung erfolgen, da es sich um eine Absolutmessung handelt und so der pK⚠ $_{s}$-Wert angegeben werden kann. Dafür wird der Titrierautomat in den "CAL"-Modus gestellt. Das Gerät ist dann bereit für eine 2-Punkt-Kalibrierung. Die Elektrode wird in die erste Pufferlösung mit einem pH Wert von 6,88 getaucht, in diesem Fall Phosphat-Puffer. Die Kalibrierung wird mit der Start-Taste gestartet. Die Temperatureinstellung wird bei 25°C gelassen, der pH-Wert der Pufferlösung muss eingetippt werden.
Sobald der Messwert das gesetzte Driftkriterium erreicht hat, wird die Messung abgebrochen und es kann der pH-Wert des zweiten Puffers abgefragt werden. Dafür wird die Elektrode mit Wasser gespült und in die zweite Pufferlösung mit einem pH-Wert von 4,00 getaucht. In diesem Fall handelt es sich um einen Kaliumhydrogenphthalat-Puffer. Auch hier muss der pH-Wert eingegeben werden. Wenn die Kalibrierung abgeschlossen ist, werden die Daten für die Asymmetrie und die Steilheit angezeigt.
Die Asymmetrie beschreibt die auftretende Potentialdifferenz zwischen der inneren und äußeren Glasmembran, vorausgesetzt dass die beiden Elektroden in die gleiche Pufferlösung getaucht sind. In diesem Versuch dient dafür der Puffer mit dem pH-Wert von 6,88.15
Die Steilheit stellt die Spannungsänderung je pH-Einheit dar und ist elektrodenspezifisch. Das heißt, die Steilheit muss für jede Glaselektrode berechnet werden mit
⚠ $Steilheit = \frac {\Delta E / \Delta pH}{U}$. Kontrolliert wird die Steilheit mit dem Puffer bei pH-Wert 4,0.16
 Abb.7 | Becherglas mit Probelösung und eingetauchter Elektrode sowie Bürette 17
Abb.7 | Becherglas mit Probelösung und eingetauchter Elektrode sowie Bürette 17
Es ist wichtig darauf zu achten, nach der Kalibrierung wieder in den Titriermodus zu wechseln.
Messung
Die Bürette wird mit der Maßlösung kurz durchgespült, um mögliche Luftblasen zu entfernen. Dafür wird die DOS- Taste länger gedrückt gehalten. Vorher wird ein Abfallgefäß unter die Bürette gestellt, um die Maßlösung aufzufangen. Danach wird mit der Taste STOP/FILL das Volumen der Maßlösung wieder auf 10,0 mL aufgefüllt. Anschließend werden die Bürette und die Glaselektrode von außen mit Wasser gespült, um mögliche Verunreinigungen zu entfernen.
Die Analysenlösung wird mit demineralisiertem Wasser auf 100,0 mL verdünnt. Davon werden 25,0 mL mit einer Vollpipette in ein Becherglas überführt. Zu der Analysenlösung werden 5,0 mL Salzsäure mit einer Konzentration von 1 mol/L gegeben. Dies erfolgt mit dem Dosimaten, mit dessen Hilfe ein ganz genaues Volumen an Salzsäure hinzugegeben werden kann.18
Anschließend wird die fertig vorbereitete Probe auf den Magnetrührer gestellt. Der Rührfisch wird in das Becherglas gelegt und der Magnetrührer eingeschaltet. Die Bürette und die Glaselektrode werden über dem Becherglas eingehängt und in die Flüssigkeit eingetaucht, sodass das Diaphragma bedeckt ist. Die Bürette muss bei dieser Titration in die Probe eintauchen, da es sich um eine automatische Titration handelt. Es ist wichtig darauf zu achten, dass der Rührfisch bei Rotation nicht gegen die Elektrode stößt. Außerdem sollten Elektrode und Bürette auf selber Höhe hängen. Zusätzlich muss das Ventil oben an der Elektrode für die Titration geöffnet werden.
Die Titration wird gestartet, indem die Start-Taste am Titrierautomaten gedrückt wird. Der Automat titriert selbstständig mit Natriumhydroxidlösung mit einer Konzentration von 1 mol/L als Maßlösung und zeigt nach der Beendigung der Titration den Verbrauch bis zu den Äquivalenzpunkten an. Nach beendeter Titration wird die Titrationskurve mit diesen Werten ausgedruckt. Währenddessen wird ein Becherglas mit einer neuen Probe vorbereitet. Die Maßlösung wird mit Stop/Fill wieder auf 10,0 mL aufgefüllt. Vor der nächsten Titration werden sowohl die Bürette als auch die Elektrode mit Wasser vorsichtig gesäubert. Der Rührfisch wird aus der titrierten Probe entfernt und ebenfalls gereinigt. Danach wird dieser in die neue Probe gelegt. Eine neue Titration kann gestartet werden. Die titrierten Proben können im Abwasser entsorgt werden. Wenn alle drei Titrationen abgeschlossen sind, werden wieder Bürette und Elektrode gereinigt und in ihre Behältnisse zurück gestellt. Das Ventil an der Elektrode muss wieder geschlossen werden. Die Elektrode sollte allgemein nicht länger als nötig im Trockenem sein, da sonst das Diaphragma beschädigt werden könnte. Der Magnetrührer und der Titrierautomat können ausgeschaltet werde.
Auswertung
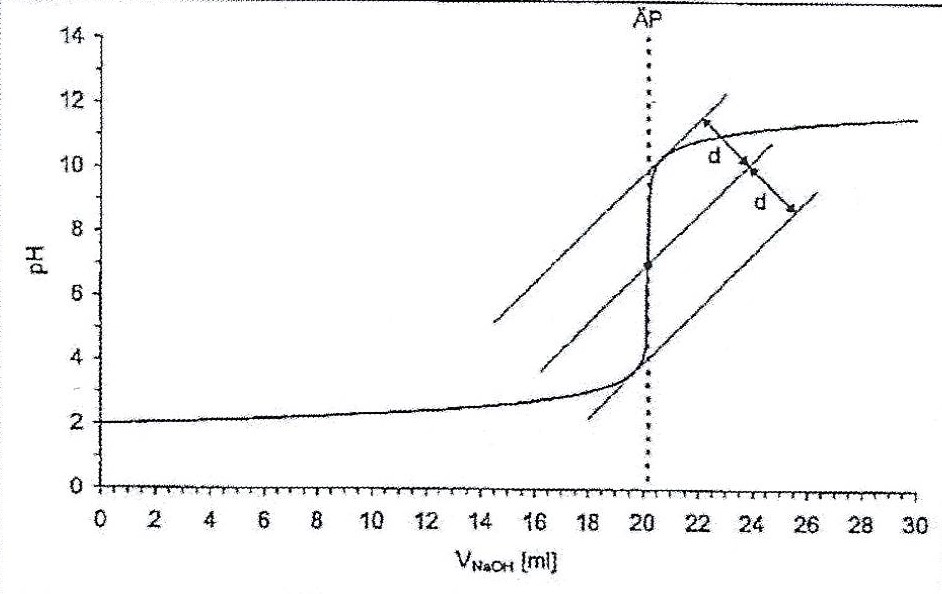 Abb.8 | Allgemeine Darstellung der Tangentenmethode19
Abb.8 | Allgemeine Darstellung der Tangentenmethode19
Der Titrierautomat erstellt selbstständig die Titrationskurve, in der zwei Potentialsprünge erkennbar sind. In der graphischen Darstellung ist der pH-Wert zum Verbrauch der Natriumhydroxidlösung in Milliliter aufgetragen. Außerdem berechnet der Titrierautomat automatisch den Verbrauch an Maßlösung. Dieser ist an den Wendepunkten der Potentialsprünge abzulesen. Die graphische Auswertung ist ungenauer als die Berechnungen des Titrierautomaten, weshalb sie deswegen in diesem Versuch nicht angewendet wird. Diese graphische Methode heißt Tangentenmethode. Dabei wird eine Tangente in den gekrümmten Bereich des Graphen gezeichnet, die die x-Achse im 75° Winkel schneiden sollte. Danach wird parallel zur ersten Tangente eine Zweite im anderen gekrümmten Bereich des jeweiligen Äquivalenzpunktes gezogen. Nun wird der Abstand der beiden Tangenten gemessen. In die Mitte wird eine dritte Tangente gezeichnet. Am Schnittpunkt dieser Tangente mit dem Graphen ist der Äquivalenzpunkt der Titration (siehe Abbildung 8).20
Für die Auswertung werden aus den Maßlösungsverbräuchen zuerst die Massen von Natriummonohydrogenphosphat und Natriumdihydrogenphosphat und anschließend mit der Masse die Massenkonzentration berechnet.
Da bis zum ersten Äquivalenzpunkt der Überschuss an Salzsäure rücktitriert wird, entspricht die Stoffmengenkonzentration von Natriummonohydrogenphosphat der Stoffmengenkonzentration der verbrauchten Natriumhydroxidlösung bis zum ersten Äquivalenzpunkt subtrahiert von der Stoffmengenkonzentration der Salzsäure. Da die Analysenlösung am Anfang auf 100,0 mL verdünnt wurde und davon 25,0 mL titriert wurden, erhält man einen Verdünnungsfaktor von vier. Mit Hilfe der folgenden Gleichung kann die Masse an Natriummonohydrogenphosphat berechnet werden:
⚠ $$ m_{Na_2HPO_4}\ = [(V_{HCl} \cdot c_{HCl} \cdot F_{HCl} - V_{NaOH 1. ÄP} \cdot c_{NaOH} \cdot F_{NaOH}) \cdot M_{Na_2HPO_4}] \cdot 4 ⚠ $$
Um die Masse von Natriumdihydrogenphosphat zu berechnen, wird von der Stoffmengenkonzentration der verbrauchten Natriumhydroxidlösung die Stoffmengenkonzentration der Salzsäure abgezogen.
⚠ $$ m_{NaH_2PO_4}\ = [(V_{NaOh 2. ÄP} \cdot c_{NaOH} \cdot F_{NaOH} - V_{HCl} \cdot c_{HCl} \cdot F_{HCl}) \cdot M_{Na_2H_2PO_4}] \cdot 4 ⚠ $$
Die errechnete Masse entspricht schon der Masse in mg in 100 mL, welches somit auch der Massenkonzentration ⚠ $\beta$ entspricht.
⚠ $m_{Na_2HPO_4}$: Masse von Natriummonohydrogenphosphat in mg⚠ $m_{NaH_2PO_4}$: Masse von Natriumdihydrogenphosphat in mg⚠ $V_{HCl}$: Volumen an Salzsäure, hier 5,0 mL⚠ $c_{HCl}$: Konzentration der Salzsäure, hier 1 mol/L⚠ $F_ {HCl}$: Faktor der Salzsäure, hier 1,055⚠ $V_{NaOH}$: Verbrauch an Maßlösung⚠ $c_{NaOH}$: Konzentration der Maßlösung, hier 1 mol/L⚠ $F_{NaOH}$: Faktor der Maßlösung, hier 1,005⚠ $M_{Na_2HPO_4}$: molare Masse von Natriummonohydrogenphosphat = 141,96 g/mol⚠ $M_{NaH_2PO_4}$: molare Masse von Natriumdihydrogenphosphat = 119,98 g/mol
Angegeben wird das Ergebnis in der Massenkonzentration ⚠ $\beta$ in mg/100 mL. Je nach den geforderten signifikanten Stellen, in diesem Fall drei, kann das Ergebnis auch in g/100 mL vorliegen, wenn der Wert sehr hoch ist.22
Außerdem soll zusätzlich der pK⚠ $_{s2}$-Wert bestimmt werden. Dies wird graphisch durchgeführt. Dafür wird eine Gerade (in Abbildung 9 die grüne Linie) zwischen den beiden Äquivalenzpunkten in der Titrationskurve gezogen. Der pH-Wert an der Stelle des Schnittpunktes der Geraden mit der Kurve entspricht dann dem pK⚠ $_{s}$-Wert.23 In Abbilldung 9 zu sehen ist die Titrationskurve der Simultantitration mit zwei Äquivalenzpunkten. Außerdem sind die ausgerechneten Verbräuche der Maßlösung und die entsprechenden pH-Werte angegeben.
Rechenbeispiel
Um die oben stehenden Formeln besser zu verinnerlichen und zu verstehen bietet es sich an, eine Beispielrechnung durchzuführen. Die Werte wurden durch eine Durchführung der Titration ermittelt.
Die Titrationen ergeben folgende Verbräuche für den ersten Äquivalenzpunkt:
- 3,685 mL
- 3,662 mL
- 3,700 mL
Und für den zweiten Äquivalenzpunkt:
- 8,172 mL
- 8,133 mL
- 8,169 mL
Es wird beispielhaft jeweils eine Masse für jeden Äquivalenzpunkt ausgerechnet.
⚠ $$ m_{Na_2HPO_4}\ = [(5,0 mL \cdot 1 mol/L \cdot 1,055 - 3,685 mL \cdot 1 mol/L \cdot 1,005) \cdot 141,96 g/mol] \cdot 4 = 892,403 mg \left( in \ 100mL \right) ⚠ $$
⚠ $$ m_{NaH_2PO_4}\ = [(8,172 mL \cdot 1 mol/L \cdot 1,005 - 5,0 mL \cdot 1 mol/L \cdot 1,055) \cdot 119,98 g/mol] \cdot 4 = 1409,938 mg \left( in \ 100mL \right) ⚠ $$
Aus allen ausgerechneten Massen für Natriummonohydrogenphosphat und Natriumdihydrogenphosphat wird jeweils der Mittelwert gebildet.
⚠ $$ m_{Na_2HPO_4}\ = \frac {\left(892,403 mg + 905,528 mg + 883,843 mg \right)}{3} = 893,925 mg \left( in \ 100 mL \right) \rightarrow \beta = 894 mg/100mL ⚠ $$
⚠ $$ m_{NaH_2PO_4}\ = \frac {\left(1409,938 mg + 1391,127 mg + 1408,491 mg \right)}{3} = 1403,186 mg \left( in \ 100 mL \right) \rightarrow \beta = 1,40 g/100 mL ⚠ $$
Einzelnachweise
1 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Wissenschaftliche Verlagsgesellschaft, Seite 553f ⇑
2 fotografiert und bearbeitet von Malte Schnöckelborg am 07.12.2021 ⇑
3 https://https://www.duden.de/rechtschreibung/simultan , entnommen aus dem Internet am 06.12.2021 ⇑
4 Ph.Eur. 10.0/2.02.25.00; https://arzneibuch.de/arzneibuch/arzneibuch/start.xav?lang=de#__arzneibuch__%2F%2F*%5B%40attr_id%3D%27eab_mono-2813%27%5D__1639581123624, letzter Abruf: 15.12.2021 ⇑
5 Praktikumseinführung Elektrochemie: Allgemeine Hinweise zu den praktischen Versuchen von Dr. Oliver Orban, Seite 6 ⇑
6 fotografiert und bearbeitet von Malte Schnöckelborg am 07.12.2021 ⇑
7 fotografiert und bearbeitet von Malte Schnöckelborg am 07.12.2021 ⇑
8 https://de.wikipedia.org/wiki/B%C3%BCrette , entnommen aus dem Internet am 02.12.2021 ⇑
9 links: fotografiert von Malte Schnöckelborg am 26.11.2021; rechts: https://de.wikipedia.org/wiki/Glaselektrode , entnommen aus dem Internet am 05.12.2021 ⇑
10 Rücker, Neugebauer, Willems (2013), Instrumentelle pharmazeutische Analytik, 5. Auflage, Stuttgart, Wissenschaftliche Verlagsgesellschaft, Seite 558 ⇑
11 https://de.wikipedia.org/wiki/Diaphragma , entnommen aus dem Internet am 03.12.2021 ⇑
12 fotografiert von Malte Schnöckelborg am 26.11.2021 ⇑
13 https://de.wikipedia.org/wiki/Magnetr%C3%BChrer, entnommen aus dem Internet am 08.12.2021 ⇑
14 fotografiert und bearbeitet von Malte Schnöckelborg am 07.12.2021 ⇑
15 Vorlesungsskript Dr. Oliver Orban, Einführung in die Instrumentelle Analytik: Elektrochemische Methoden, Seite 44 ⇑
16 Vorlesungsskript Dr. Oliver Orban, Einführung in die Instrumentelle Analytik: Elektrochemische Methoden, Seite 45 ⇑
17 fotografiert von Lena Koch am 06.12.2021 ⇑
18 Praktikumsskript Dr. Thomas Kellner, Instrumentelle Analytik 4. Semester Pharmazie, Seite 35 ⇑
19 Skript Dr. Oliver Orban: Einführung in die Instrumentelle Analytik: Elektrochemische Methoden, Folie 62 ⇑
20 Vorlesungsskript Dr. Oliver Orban, Einführung in die Instrumentelle Analytik: Elektrochemische Methoden, Seite 62 ⇑
21 fotografiert und bearbeitet von Malte Schnöckelborg am 15.12.2021 ⇑
22 Praktikumsskript Dr. Thomas Kellner, Instrumentelle Analytik 4. Semester Pharmazie, Seite 25 ⇑
23 Praktikumseinführung Elektrochemie: Allgemeine Hinweise zu den praktischen Versuchen von Dr. Oliver Orban, Seite 7 ⇑
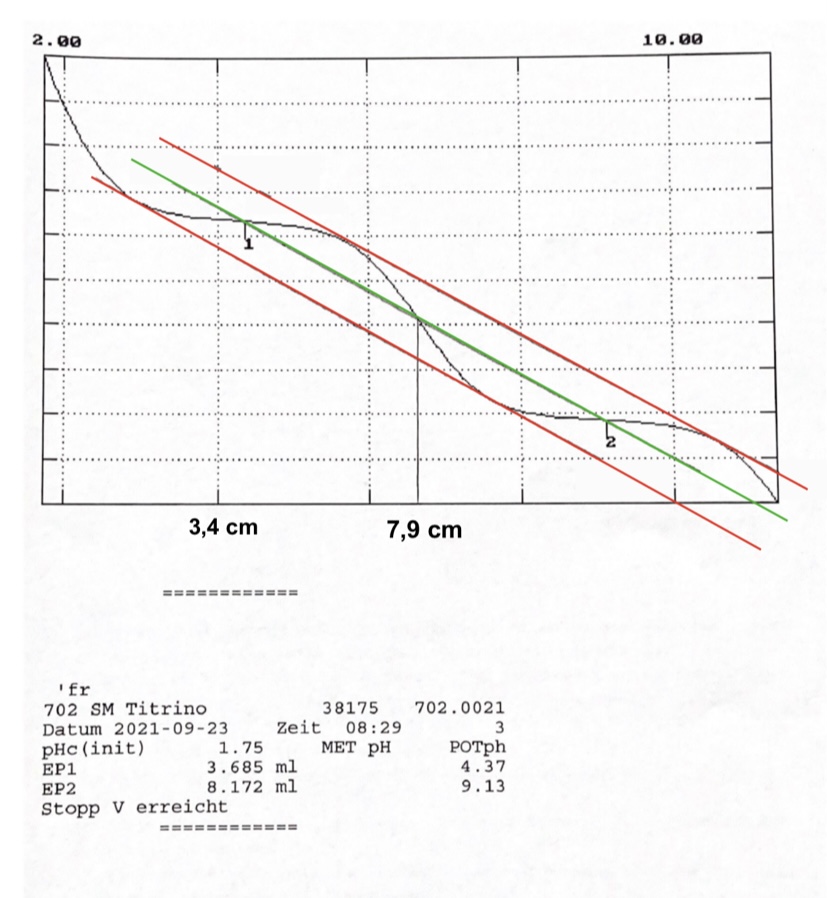 Abb.9 | Titrationskurve der Simultantitration und graphische Auswertung des pK
Abb.9 | Titrationskurve der Simultantitration und graphische Auswertung des pK
