Kond
Titelblatt
Expertenbericht zum Praktikumsversuch
Kond
WiSe 2021/2022
Abgabedatum
08.12.2021
Expertengruppe 01
Sabrina Hafke
Loreen Andersch
Jana Eßer
Simultanbestimmung von Essigsäure und Salzsäure (Kond.), Untersuchung einer Wasserprobe
Der Versuch gliedert sich in Teil a) und b). In Teil a) wird eine Wasserprobe untersucht und festgestellt, ob es sich bei dieser um Leitungswasser oder um destilliertes Wasser handelt. Im Versuchsteil b) wird der Gehalt von Essigsäure und Salzsäure einer Probe mittels einer konduktometrischen Simultanbestimmung ermittelt. 1
Inhaltsverzeichnis
Einleitung
Die Konduktometrie ist eine elektrochemische Methode, bei der durch Messung des elektrischen Leitwerts einer Elektrolytlösung die Konzentration der darin enthaltenen Ionen bestimmt werden kann. Außerdem wird sie bei Titrationen zur Bestimmung des Endpunktes verwendet. Da die Methode auf der Bestimmung des Leitwerts beruht, wird sie auch oft Leitfähigkeitsmessung genannt.2
Grundsätzlich eignet sich die Konduktometrie für Neutralisations-, Fällungs- und Komplexbildungsreaktionen. Außerdem können Indizierungen im nicht wässrigen Milieu und unter bestimmten Umständen, welche im Abschnitt 1.3.2. erläutert werden, auch Simultanbestimmungen durchgeführt werden. Dabei ist ihr besonderer Vorteil, dass sie auch bei trüben, gefärbten oder verdünnten Lösungen eingesetzt werden kann. Des Weiteren lässt sich die konduktometrische Messung bei geringen Analytkonzentrationen anwenden, dadurch grenzt sie sich von anderen Verfahren ab.
Redoxtitrationen können dagegen nicht konduktometrisch vermessen werden, da sich die auftretenden Ionenarten hinsichtlich ihrer Leitfähigkeiten nicht genug voneinander unterscheiden. 3
Es existiert bereits ein ausführlicher Wiki-Eintrag, welcher die chemischen und physikalischen Grundlagen des Versuches genauer erläutert.
Versuchsbeschreibung
Ziel des Versuchs
Der Teil a) des Versuchs ist die Vermessung einer Wasserprobe. Hier soll festgestellt werden, ob es sich bei der ausgegebenen Probe um Leitungswasser oder destilliertes Wasser handelt. Ziel des Versuchsteils b) ist die konduktometrische Messung von Salzsäure und Essigsäure und damit die simultane, also gleichzeitige, Bestimmung des Gehalts der beiden Säuren in der Probelösung.
Chemischer Hintergrund
Bei der konduktometrischen Titration wird der Leitwert in Abhängigkeit von der zugesetzten Maßlösung gemessen. Wie bei allen Titrationen ist auch hier eine Grundvoraussetzung, dass der Äquivalenzpunkt klar bestimmbar sein muss. Bei der Konduktometrie muss sich die Leitfähigkeit der Lösung am Äquivalenzpunkt sprunghaft ändern. Dementsprechend muss sich entweder die Zahl der Ladungsträger ändern oder diese müssen durch Ladungsträger einer erheblich anderen Grenzionenleitfähigkeit ersetzt werden. Außerdem muss beachtet werden, dass sich der Leitwert immer aus der Summe aller freibeweglichen Ionen zusammensetzt. 4 Das bedeutet, dass für die Simultanbestimmung einzelner Ionen, je nach Titration, weitere Anforderungen erfüllt sein müssen. Bei Neutralisationstitrationen, wie in diesem Versuch, müssen die pKs-Werte der Säuren möglichst weit, mindestens aber 3 Einheiten, auseinander liegen. Bei Salzsäure mit einem pKs-Wert von -6 5 und Essigsäure mit 4,75 6 ist dies der Fall. Sind diese Bedingungen nicht gegeben, kann die gemessene Leitfähigkeit nicht zweifelsfrei den Ionen einer Säure zugeordnet werden, da beide Säuren gleichzeitig zu einem gewissen Teil dissoziiert vorliegen.78
Reaktionen während des Versuchs
Bei der Titration von Salzsäure und Essigsäure mit Natriumhydroxid, ergibt sich ein Graph, der sich in drei Teilabschnitte einteilen lässt. Dieser Graph ist in den Abbildungen 5 und 6 zu erkennen. Im Folgenden soll erläutert werden, was innerhalb dieser Abschnitte chemisch passiert:
- 1. Abschnitt
⚠ $$ H_3O^+ + Cl^- + Na^+ + OH^- \rightarrow NaCl + 2 H_2O ⚠ $$
- 2. Abschitt
⚠ $$ CH_3COOH + Na^+ + OH^- \rightarrow CH_3COO^- +Na^+ + H_2O ⚠ $$
- 3. Abschnitt
Wie durch dieses Wissen der Gehalt der beiden Säuren bestimmt wird, ist im Punkt Auswertung erläutert.
Instrumenteller Aufbau
Im Allgemeinen besteht der Aufbau für eine konduktometrische Messung aus zwei Bestandteilen: einer Wechselspannungsquelle mit einer Frequenz von 1 bis 5 kHz und einer Messzelle.
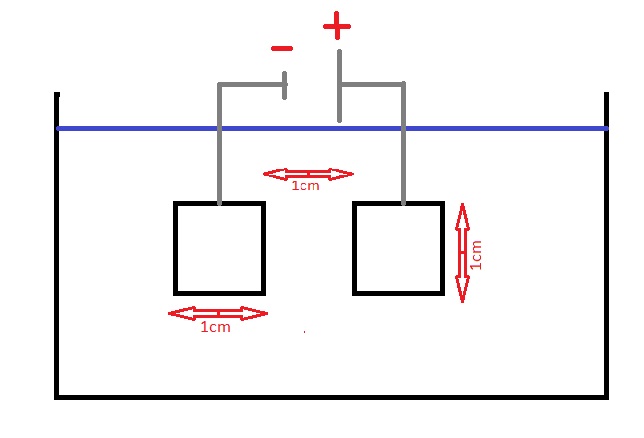
Bei der Messzelle handelt es sich um planare, elektrolytische Zellen aus Metall, welche parallel zueinander ausgerichtet sind. Im Idealfall haben die Bleche eine Kantenlänge von 1,0 cm und einen Abstand von 1,0 cm voneinander. Abweichungen davon werden durch die Zellkonstante ausgeglichen. So umgeben die Messzellen ein Flüssigkeitsvolumen von 1 cm⚠ $^{3}$.
Da für die Messung möglichst unpolarisierte Elektroden benötigt werden, finden hier Platin-Elektroden Verwendung. Das Platin allein lässt sich schwer polarisieren. Um den Effekt zu erhöhen, wird die Elektrode zusätzlich platiniert.
Dies ist ein Verfahren, bei dem die Elektrodenoberfläche bis auf das Tausendfache vergrößert wird. Dies wird durch die elektrolytische Abspaltung von Platin (Platinschwamm oder Platinmohr) auf den Elektroden erreicht.
Der Widerstand der Elektroden sollte zwischen 100 und 500 Ohm liegen. Deshalb werden bei Lösungen von geringer Leitfähigkeit große Elektroden mit einem möglichst kleinen Abstand zwischen den Elektroden beziehungsweise kleine Elektroden mit einem großen Abstand gewählt. 1314
Auf den beiden Bildern ist zum einen das Konduktometer (Abb.3) mit der Skala zum Ablesen der Skalenteile, zum anderen der Titrationsaufbau (Abb.2) zu sehen. Der Titrationsaufbau besteht aus der Messzelle mit Platinelektrode, der Bürette und einer automatischen Dosiereinheit. Außerdem ist der Rührtisch zu sehen, der dafür sorgt, dass die Probe dauerhaft durchmischt wird.
Funktionsweise des Konduktometers - Messung des Widerstands
Praktisch wird nicht der Leitwert, sondern der Widerstand gemessen. Dies ist möglich, weil der Leitwert gleich dem reziproken Widerstand ist. Der Widerstand wird mittels einer Wheatstone`schen Messbrücke gemessen. Diese ist eine Anordnung, bei der das Widerstandsverhältnis zweier Stromzweige mit abgeglichenem Nullinstrument verglichen wird. Der Widerstand b wird so lange verändert, bis kein Stromfluss mehr durch das Amperemeter angezeigt wird. An beiden Stromzweigen liegt nun die gleiche Spannung an, sodass gilt:
⚠ $$ R_x=R \cdot \frac{a}{b} ⚠ $$
⚠ $R_x:$ gesuchter Widerstand
⚠ $R,a,b:$ bekannte Widerstände der Messbrücke
In moderneren Geräten kommt auch eine direkte Messung bei bekannter Spannung und Stromstärke zur Anwendung.17
Durchführung
Generell muss bei der Durchführung beziehungsweise der Handhabung der Gerätschaften auf folgende Dinge geachtet werden:
- Der Faktor der Maßlösung muss notiert werden, da dies für die spätere Berechnung wichtig ist.
- Die Messzelle muss zu Beginn gründlich mit destilliertem Wasser gespült werden. Dabei sollte auch in die oberen Öffnungen gespült werden.
- Die Bürette darf nie in die Lösung eingetaucht werden, sondern muss während der gesamten Messung oberhalb der Flüssigkeit liegen, da es sich hier um eine Handtitration handelt.
- Vor der Messung muss geprüft werden, ob sich innerhalb der Bürettenschläuche Luftblasen gesammelt haben. Diese müssen im Zweifel durch Ablassen der Maßlösung entfernt werden.
- Die oberen Öffnungen der Messzelle müssen bei der Messung vollständig von Probenflüssigkeit umgeben sein.
- Es ist sicherzustellen, dass der Rührfisch beim Rühren nicht die Elektroden beschädigen kann.
- Der Rührer muss die gesamte Messung über gleichmäßig rühren.
- Der Leitwert muss immer so abgelesen werden, dass Zeiger und Spiegelbild exakt übereinander liegen. 18
Versuchsteil a)
Im Teil a) des Versuchs wird die Messzelle, nachdem sie gründlich gespült wurde, in die Wasserprobe eingetaucht und der Rührer wird angeschaltet. Dabei ist auf die oben erwähnten Punkte zu achten. Während die Messzelle eintaucht, wird der Zeigerausschlag beobachtet. Wie dieser zu interpretieren ist, ist unter Auswertung erläutert. 20
Versuchsteil b)
Für Teil b) des Versuchs, der Bestimmung von Salzsäure und Essigsäure, wird die erhaltene Analysenlösung im Messkolben auf 100ml aufgefüllt. Bei diesem Schritt muss sorgfältig vorgegangen werden, da es ansonsten schon hier zu einem Fehler aufgrund des ungenauen Auffüllens kommen kann. Aus der gut geschüttelten Lösung werden 25,0ml mit einer Vollpipette entnommen und in ein Becherglas gefüllt. Dieses Becherglas wird so weit mit destilliertem Wasser aufgefüllt, sodass die Messzelle vollständig eintauchen kann. Die Messzelle kann nun in die Lösung getaucht werden. Ab diesem Punkt ist darauf zu achten, dass sich das Konduktometer im "measure" Modus und nicht mehr im "Stand by" Modus befindet (roter Kippschalter siehe Abb. 3).
Vor Beginn der eigentlichen Titration wird am Konduktometer mit Hilfe des Drehreglers "cell const" (siehe Abb. 3) ein Skalenwert von 70 auf der Anzeige des Gerätes eingestellt. Da bei dieser Messung keine absoluten, sondern nur relative Änderungen gemessen werden, ist eine ungefähre Einstellung der Skalenwerte ausreichend. Jedoch muss darauf geachtet werden, dass das Ablesen, wie oben erläutert, exakt geschieht.
Durch Drücken des Druckknopfes (Vorsicht: Hier kann es schnell zu einer Doppeldosierung kommen, deshalb schnell und kurz drücken!) oder der Taste "GO" am Titrierautomaten, kann mit der Titration begonnen werden. Bis zum ersten Äquivalenzpunkt wird in 0,1ml Schritten titriert. Dabei muss darauf geachtet werden, dass vor jeder weiteren Dosierung der Leitwert konstant angezeigt und exakt notiert wurde. Die Überschreitung des ersten Äquivalenzpunktes ist durch einen Anstieg des Leitwerts erkennbar. Von dort an wird in 0,2ml Schritten weiter titriert, bis der zweite Äquivalenzpunkt erreicht ist. Auch hier wird stets gewartet bis der Leitwert nach der Dosierung konstant angezeigt wird. Der Titrierautomat titriert immer in 0,1ml Volumina, daher muss für die Abgabe von 0,2ml zweimal kurz hintereinander gedrückt werden. Nach dem zweiten Äquivalenzpunkt werden noch fünf weitere Werte aufgenommen, anschließend kann die Messung beendet werden.
Dieser Vorgang wird noch zweimal wiederholt. Jedoch sollte hier der Skalenwert zuvor auf 60 beziehungsweise auf 80 eingestellt werden, sodass bei der späteren Auftragung auf einem Blatt die Graphen voneinander unterscheidbar sind.
Die erhaltenen Werte werden auf Millimeterpapier oder in eine geeignete Software, wie Excel, übertragen. Die Nutzung einer solchen Software ist weniger fehleranfällig und somit genauer. Daran schließt sich die Auswertung an.21
Auswertung
Vermessung einer Wasserprobe
Im Teil a) des Versuchs soll bestimmt werden, ob es sich um Leitungswasser oder destilliertes Wasser handelt. Da sich für einen Leitwert Ionen im Wasser befinden müssen, kann es bei destilliertem Wasser nicht zu einem Ausschlag des Konduktometers kommen. Eventuell kann auch bei destilliertem Wasser ein minimaler Ausschlag erkennbar sein, dieser ist jedoch wirklich minimal und lässt sich auf wenige Restionen zurückführen. Bei Leitungswasser sollte ein klar erkennbarer Ausschlag zu sehen sein. Bei Unsicherheiten kann eine Vergleichsmessung mit Leitungswasser beziehungsweise destilliertem Wasser durchgeführt werden. Weitere Berechnungen sind nicht nötig.
Simultanbestimmung von Salzsäure und Essigsäure mit Natriumhydroxid
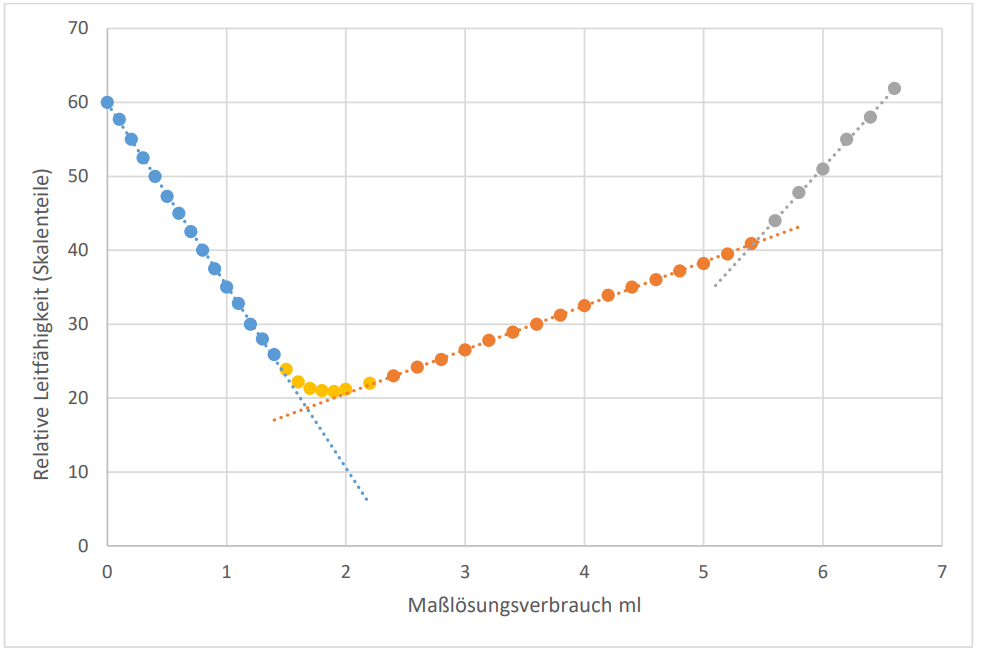
Ist die Messung richtig durchgeführt worden, kann der folgenden Graph mit den in Punkt 1.3.3. bereits erwähnten drei abzugrenzenden Abschnitten erstellt werden: auf der x-Achse ist der Verbrauch der Maßlösung und auf der y-Achse der relative Leitwert in Skalenteilen aufgetragen.
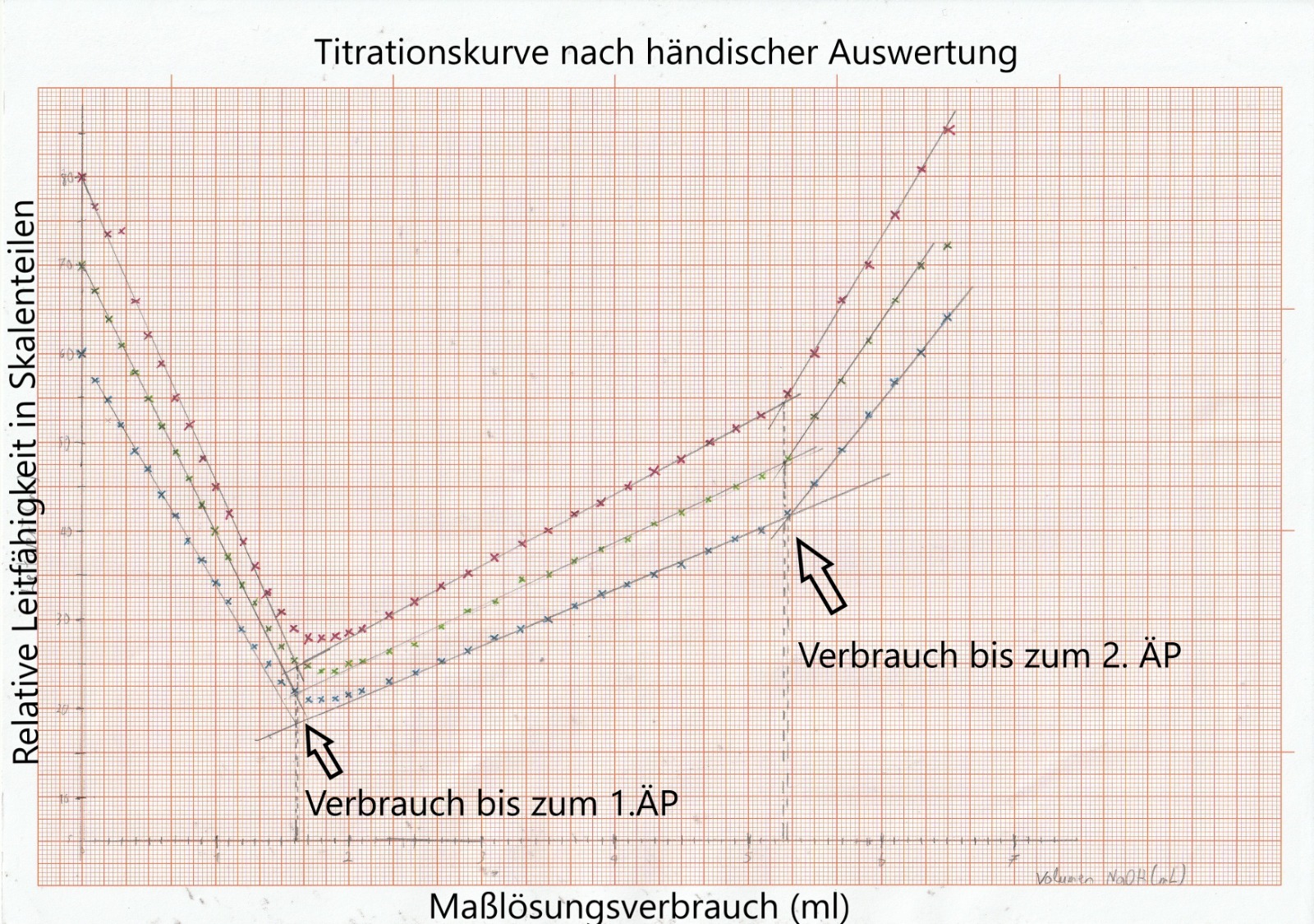
Für die Auswertung werden sogenannte Ausgleichsgeraden gezogen. Wie oben erläutert, kommt es beim ersten Äquivalenzpunkt zur Verfälschung des Messwertes durch Hydrogencarbonat, daher ist darauf zu achten, dass der erste Äquivalenzpunkt unterhalb des aufgenommenen Wertes liegt, dort wo sich die Ausgleichsgeraden schneiden. Diese Ausgleichsgeraden werden in jeder Messreihe für den ersten und zweiten Äquivalenzpunkt eingezeichnet. Durch den Schnittpunkt der Geraden kann der Verbrauch an Maßlösung an den Äquivalenzpunkten abgelesen werden.
Die Auswertung kann, wie in Abb. 5 und Abb. 6 zu sehen, sowohl händisch als auch mit einem Tabellen-Kalkulationsprogramm erfolgen. Bei der Verwendung von beispielsweise Excel muss darauf geachtet werden, dass die Titration in ihre drei beziehungsweise vier Teilabschnitte unterteilt wird. So kann für jeden Graphenteil eine Ausgleichsgerade ermittelt werden. Durch Gleichsetzen der Geradengleichungen und Auflösen dieser nach x kann ebenfalls der Maßlösungsverbrauch ermittelt werden. Der vierte, hier gelb markierte, Teil ist der Bereich des ersten Äquivalenzpunktes. Dieser sollte weder zum ersten noch zum zweiten Graphenabschnitt zugeordnet werden, da es ansonsten dazu kommen kann, dass die Ausgleichsgeraden nicht steil genug berechnet werden. Somit würde der schon erwähnte Fehler aufgrund des Hydrogencarbonats nicht berücksichtigt werden.
Es bietet sich daher an nur die linearen Abschnitte in die Ausgleichsgeraden aufzunehmen und die Werte in der Nähe der Äquivalenzpunkte nicht mit einzubeziehen.
Es folgt die Berechnung des Gehalts der Säuren in der Ausgangslösung:
Dazu müssen neben dem Verbrauch an Maßlösung weitere Werte bekannt sein:
- der Faktor der Maßlösung
- die Konzentration der Maßlösung - hier 0,5 mol/l
- die Verdünnung, die vorgenommen wurde - hier wurden nur 25ml aus dem 100ml Messkolben für die Messung verwendet
- die molare Masse von Salzsäure und Essigsäure, mit mindestens zwei Nachkommastellen
Die Werte werden in folgende Formeln eingesetzt:
⚠ $$ \beta_{HCl}= V_{NaOH 1.ÄP} \cdot c_{NaOH} \cdot f_{NaOH} \cdot M_{HCl} \cdot f_{Verd.} ⚠ $$
⚠ $$\beta_{Hac}= (V_{NaOH 2.ÄP} - V_{NaOH 1.ÄP}) \cdot c_{NaOH} \cdot f_{NaOH} \cdot M_{Hac} \cdot f_{Verd.} ⚠ $$
⚠ $ \beta_{HCl}$ : Massenkonzentration der Salzsäure in mg/100ml
⚠ $ \beta_{Hac}$ : Massenkonzentration der Essigsäure in mg/100ml
⚠ $ V_{NaOH 1.ÄP}$ : Verbrauch an Maßlösung (NaOH) bis zum ersten Äquivalenzpunkt in ml
⚠ $ V_{NaOH 2.ÄP}$ : Verbrauch an Maßlösung (NaOH) bis zum zweiten Äquivalenzpunkt in ml
⚠ $ c_{NaOH} $ : Konzentration der Natriumhydroxid-Lösung in mmol/ml
⚠ $ f_{NaOH} $ : Faktor der Maßlösung (NaOH)
⚠ $ M_{HCl} $ : Molare Masse Salzsäure in mg/mmol (36,461 mg/mmol)24
⚠ $ f_{Verd.}$ : Faktor der Verdünnung in 1/100ml
⚠ $ M_{Hac}$ : Molare Masse der Essigsäure in mg/mmol (60,052 mg/mmol)25
Die Massenkonzentrationen von Salzsäure und Essigsäure werden für alle drei Titrationen berechnet und daraus der Mittelwert gebildet. Die Ansage erfolgt in mg/100ml auf drei signifikante Stellen gerundet.26
Einzelnachweise
1 Dr. Thomas Kellner; Praktikumsskript: Instrumentelle Analytik 4. Semester; WS21/22; Version:09 (Corona), 22.Oktober 2021; Institut für medizinische und Pharmazeutische Chemie Technische Universität ⇑
2 Latscha, Hans Peter; Linti, Gerald Walter; Klein, Helmut Alfons (2004): Analytische Chemie, Chemie Basiswissen III, 4. vollständig überarbeitete Auflage S.363. Berlin/Heidelberg: Springer Verlag ⇑
3 vlg.2 S.367. ⇑
4 https://pharmchem.de.cool/wiki/Instru/Konduktometrie, zuletzt abgerufen : 06.12.21 ⇑
5 Küster; Thiel (2008): Rechentafeln für die chemische Analytik, 106.Auflage bearbeitet von Alfred Ruland, S.243. Berlin; New York: de Gruyter ⇑
6 Küster; Thiel (2008): Rechentafeln für die chemische Analytik, 106.Auflage bearbeitet von Alfred Ruland, S.244. Berlin; New York: de Gruyter ⇑
7 Dr. Oliver Orban(2021): Seminar: Instrumentelle Analytik, Einführung zu den praktischen Versuchen, Konduktometrie, zuletzt aufgerufen 06.12.21. ⇑
8 Rücker; Neugebauer; Willems; bearbeitet von Neugebauer, Michael; Scriba, Gerhard K.E.; Hubert, Marcus A. (2013) : Instrumentelle pharmazeutische Analytik, 5. Auflage, S.671-672. Stuttgart: Wissenschaftliche Verlagsgesellschaft mbH ⇑
9 Schwedt, Georg (2008): Analytische Chemie, Grundlagen, Methoden und Praxis,2. vollständig überarbeitete Auflage S.152. Weinheim: WILEY-VCH Verlag GmbH & Co. KGaA ⇑
10 vgl 2. S.370. ⇑
11 vgl. 8. S.669-672 ⇑
12 Eigene Abbildung, Loreen Andersch, 2021 ⇑
13 vgl. 2. S.365-366. ⇑
14 vgl. 8. S.666-667. ⇑
15 Eigenes Foto, Sabrina Hafke, 2021 ⇑
16 Eigenes Foto, Sabrina Hafke, 2021 ⇑
17 vgl. 2. S.365. ⇑
18 Informationen aus der Einweisung im Praktikum, Petra Reich ⇑
19 Eigenes Foto, Sabrina Hafke, 2021 ⇑
20 vgl. 1. ⇑
21 vgl. 1. ⇑
22 Eigene Grafik, Jana Eßer, 2021 ⇑
23 Eigene Grafik, Jasmin Frey, 2021 ⇑
24 Küster; Thiel (2008): Rechentafeln für die chemische Analytik, 106.Auflage bearbeitet von Alfred Ruland, S.18. Berlin; New York: de Gruyter ⇑
25 Küster; Thiel (2008): Rechentafeln für die chemische Analytik, 106.Auflage bearbeitet von Alfred Ruland, S.16. Berlin; New York: de Gruyter ⇑
26 vgl. 1. ⇑