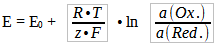Potentiometrie
Übung
Potentiometrie
SoSe 2022
Abgabedatum
30.05.2022
Expertengruppe 13
Carmen Cordes
Besan Qundus
Wajd Dukhan
Inhaltsverzeichnis
Multiple Choice (MC) Fragen
Welche Aussagen zur Potentiometrie treffen zu?
- Es können pH-sensitive Einstabmessketten verwendet werden.
- Redoxvorgänge hängen von der Konzentration der oxidierten und reduzierten Form der jeweiligen Substanz, der Temperatur der Lösung und der Substanzmasse ab.
- Bei der Direktpotentiometrie wird der pH-Wert der Analytlösung ermittelt.
- Für die Messung ist ein stromreicher Zustand für genaue Messergebnisse Voraussetzung.
- Reduktion und Oxidation sind räumlich zu trennen, dennoch müssen sie über eine Diffusionsbrücke verbunden sein.
- nur 2 und 3
- nur 1, 2 und 4
- nur 3 und 4
- nur 1 und 5
- alle 1 - 5
Antwort D ist richtig
Das Ausmaß, in dem die Redoxvorgänge geschehen, hängt von der jeweiligen Substanz, deren Konzentrationen der oxidierten bzw. reduzierten Form und der Temperatur ab. Die Abhängigkeiten des Standardpotentials werden durch die Nernst-Gleichung beschrieben (2). Die Direktpotentiometrie findet ihre Verwendung bei der Bestimmung der Konzentration eines Analyten in einer Lösung (3). Ein stromloser Zustand ist für genaue Messergebnisse ein Muss. Ist dies nicht der Fall, kommt es zu einer Veränderung der Konzentrationsverhältnisse in der Lösung bzw. direkt an der Elektrode während der Messung (4). Hier sind nur 1 und 5 korrekt. 1
Welche Aussagen treffen zu?
Bei der Potentiometrie...
- Wird die elektrische Leitfähigkeit gemessen zur Bestimmung von Ionenkonzentrationen.
- Wird die Potentialdifferenz gemessen zur Bestimmung von Ionenkonzentrationen
- Ist es wichtig, eine Wechselspannung zur Messung zu nutzen um eine Polarisationsspannung zu verhindern.
- Wird zwischen Bezugs- und Messelektroden unterschieden.
- Können nur Säure-Base-Titrationen, komplexometrische Titrationen und Fällungstitrationen durchgeführt werden.
- nur 1
- nur 2
- nur 2 und 5
- nur 2 und 4
- nur 1, 3 und 5
D ist richtig.
Hier darf die Potentiometrie nicht mit der Konduktometrie verwechselt werden, dort misst man die Leitfähigkeit (1) und eine Wechselspannung wird angelegt (3). Bei der Konduktometrie kann man auch keine Redoxtitrationen durchführen, bei der Potentiometrie gibt es jedoch keine solche Einschränkungen (5). Deshalb sind 2 und 4 richtig, nur diese beziehen sich auf die Potentiometrie. 2
Welche Aussagen zur Glaselektrode treffen nicht zu?
- Die Glaselektrode ist eine pH-sensitive Elektrode.
- Sie muss vor Verwendung immer kalibriert werden.
- Sie muss nur für die Bestimmung des pH-Wertes kalibriert werden.
- Ihre Membran muss gequollen sein, daher muss die Elektrode in Wasser aufbewahrt werden.
- Hohe Konzentrationen an Alkaliionen beeinflussen Ionenaustauschprozesse ab pH = 9.
- nur 2
- nur 3
- nur 2 und 4
- nur 4 und 5
- nur 3, 4 und 5
A ist richtig.
Die Glaselektrode ist eine pH-sensitive Indikatorelektrode (1) und kann zur Bestimmung vom pH-Wert verwendet werden. Wenn sie zur Bestimmung des pH-Wertes verwendet wird, muss sie kalibriert werden (3). Sie muss sonst nicht kalibriert werden (2). Als Voraussetzungen für die Verwendung der Glaselektrode soll die Elektrode in Wasser aufbewahrt werden (4). Hohe Konzentrationen an Alkaliionen beeinflussen das Membranpotential (5). Daher trifft nur 2 nicht zu. 3
Welche Aussagen treffen zu?
- Das messbare Potential der Potentiometrie wird als EMK bezeichnet und wird mit der Formel EMK = E(Anode) - E(Kathode) berechnet.
- Aus der Anode treten Metallionen aus und die Elektronen werden zurückgelassen.
- Bei der Kathode treten Metallionen ein, die positive Ladung wird allerdings zurückgelassen.
- Bei Titrationen im wasserfreien Medium werden schwache Säuren im basischen Medium mit sehr starken Basen titriert.
- Bei Fällungstitrationen ist die Potentialänderung abhängig vom Löslichkeitsprodukt, je kleiner dieses, desto kleiner ist der Potentialsprung.
- nur 1 und 4
- nur 3, 4 und 5
- nur 2 und 4
- nur 4 und 5
- alle 1 - 5
Antwort C ist richtig.
Die Elektromotorische Kraft ist das messbare Potential der Potentiometrie und wird durch der Formel EMK= E(Kathode)- E(Anode) beschrieben (1). In die Kathode erfolgt ein Eintritt von Metallionen unter Mitnahme positiver Ladungen (3). Bei Fällungstitrationen ist die Potentialänderung im Bereich des ÄP antiproportional zum Löslichkeitsprodukt, je kleiner dieses ist, desto größer ist der Potentialsprung (5). 4
Welche Aussagen zu Potentiometrieelektroden treffen nicht zu?
- Für eine exakte Messung muss die Glaselektrode kalibriert werden.
- Das Potential der Silber-Silberchloridelektrode (SSE) ist von der Elektrolytlösung abhängig.
- Oxidations- und Reduktionsmittel in der Analysenlösung würden zu Potentialänderung führen.
- Chinhydronelektroden werden bei der Potentiometrie häufig eingesetzt, da sie vor allem bei pH-Werten größer 8 zu makellosen Messergebnissen führen.
- Für die Verwendung von Mercurosulfatelektroden (MSE) wird Quecksilber benötigt, daher kommen diese bei der Potentiometrie selten vor.
- nur 1 und 2
- nur 3
- nur 4
- nur 3 und 5
- nur 4 und 5
Antwort C ist richtig.
Hier ist Aussage 4 falsch. Der Anwendungsbereich von Chinhydronelektroden ist begrenzt auf den pH-Bereich von 0-8, denn bei pH größer 8 wird das Hydrochinon deprotoniert, deswegen wird diese Art von Elektroden eher selten angewendet(4). Häufig greift man zu Glaselektroden. 5
Textaufgaben
Grundlagen der Potentiometrie
- Mit welcher Formel wird das Halbzellenpotential berechnet und wie lautet diese? Unter welcher Bedingung kann man eine vereinfachte Form dieser Formel nutzen?
R = molare Gaskonstante, T = Temperatur in K, z = Zahl der getauschten Elektronen, F = Faraday-Konstante, E0 = Normalpotential des Metalls, a = Aktivität des Redoxpartners
Die vereinfachte Form kann man anwenden bei einer Temperatur von 25°C. Man kann bei verdünnten Lösungen (a < 0,1) auch problemlos mit der Konzentration c rechnen. Man beachte, dass hier mit dem dekadischen Logarithmus gerechnet wird.
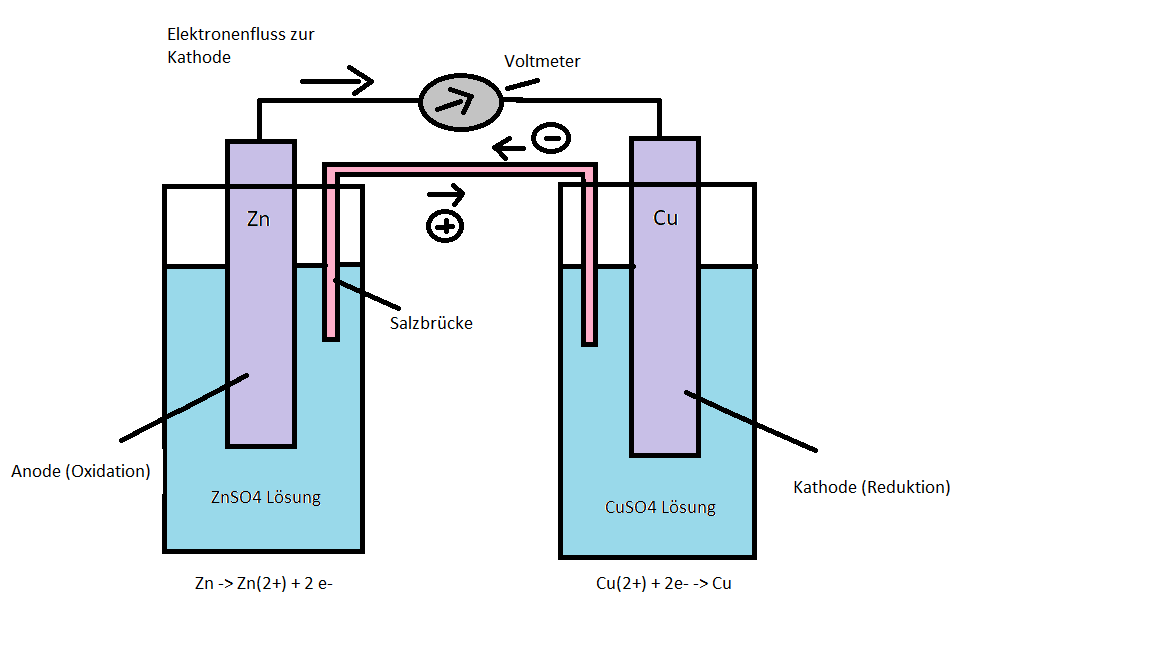
- Skizzieren Sie den prinzipiellen Aufbau eines galvanischen Elementes mit einer Kupfer- und Zinkelektrode mit den ablaufenden Reaktionen an den Halbzellen (Daniell-Element).
- Berechnen Sie die EMK für eine galvanische Zelle mit Zinkionen (c = 0,1mol/l) und Kupferionen (c = 0,01mol/l) und formulieren Sie ein Phasendiagramm für die Zelle.
E0(Zink)= -0,76V, E0(Kupfer)= +0,35V. Salzbrücke: Kaliumchlorid-Lösung
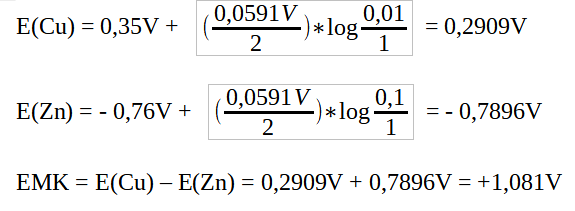
Die EMK beträgt 1,081V
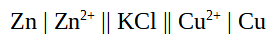
Phasendiagramm
- Erklären Sie warum für die Messung der Potentialdifferenz bzw. der elektromotorischen Kraft ein stromloser Zustand vorliegen muss und nennen Sie 2 Möglichkeiten, dies zu gewährleisten.
Die EMK ist abhängig von der Art der chemischen Reaktion sowie der Konzentration der Analyten (siehe Nernst-Gleichung). Für eine zuverlässige Berechnung der EMK bzw. der Potentialdifferenz ist eine möglichst niedrige Stromstärke wichtig für eine fehlerfreie Messung der Gleichgewichtsspannung zwischen den Elektroden. Durch einen Stromfluss zwischen den Elektroden würde sich die Spannungsdifferenz kontinuierlich verändern durch einen Stoffumsatz an den Elektroden durch Elektrolyse (bedingt durch einen Elektronenaustausch). 9 10 11
Mittel zur stromlosen Messung:
Poggendorffsche Kompensationsschaltung: Die gleiche Spannung wie die, die der Potentialdifferenz entspricht, wird entgegen geschaltet. Ein Stromfluss wird so verhindert. 12
Hochohmige Voltmeter: Durch einen extrem großen Widerstand wird die Stromstärke vernachlässigbar klein (siehe Ohmsches Gesetz R = U/I). 13
Elektroden und Titrationen bei der Potentiometrie
- Welche Gruppen von Elektroden/Halbzellen unterschiedet man bei der Potentiometrie?
Bezugselektroden und Indikatorelektroden. Die Bezugselektroden weisen ein konstantes Potential auf. Die Indikatorelektroden hingegen weisen ein variables Potential auf, welches von der Konzentration des Analyten abhängig ist. Die beiden Halbzellen werden verbunden, wobei dann die EMK bzw. die Potentialdifferenz zwischen den Elektroden gemessen wird.14
- Nennen Sie 3 Bezugselektroden. Erklären Sie kurz das Besondere an jeder der 3 Bezugselektroden.
SHE (Standardwasserstoffelektrode), SSE (Silber-Silberchlorid-Elektrode), GKE (Gesättigte Kalomel-Elektrode), MSE (Mercurosulfatelektrode)
Elektroden 2. Art wie die SSE werden bei der potentiometrischen Indikation häufig verwendet. Bei der SSE wird die Aktivität der Chloridionen durch Zugabe von Kaliumchlorid konstant gehalten. SHE wird benutzt, um Standardpotentiale zu ermitteln. Diese Elektrode wird allerdings aufgrund des apparativen Aufwands nicht verwendet. Bei der GKE bildet sich HgCl 2 an der Elektrodenoberfläche. Die MSE ist eine chloridfreie Bezugselektrode. Da die Chloridionen bei der Titration stören können, wird bei der SSE ein Zwischenelektrolyt, wie z.B. Kaliumnitratlösung eingesetzt. Somit kann die SSE auch bei Halogenid-Titrationen eingesetzt werden. 15.
- Fällungstitrationen können potentiometrisch bestimmt werden. Welche Voraussetzungen sind dabei zu beachten?
Der pKL-Wert soll größer als 8 sein, damit eine schwer lösliche Verbindung entstehen kann. Außerdem muss die Fällung ohne Verzögerung eintreten. Die Potentialdifferenz im Bereich des ÄP ist abhängig vom Löslichkeitsprodukt KL. Je kleiner das Löslichkeitsprodukt ist, desto größer ist der Potentialsprung. 16.
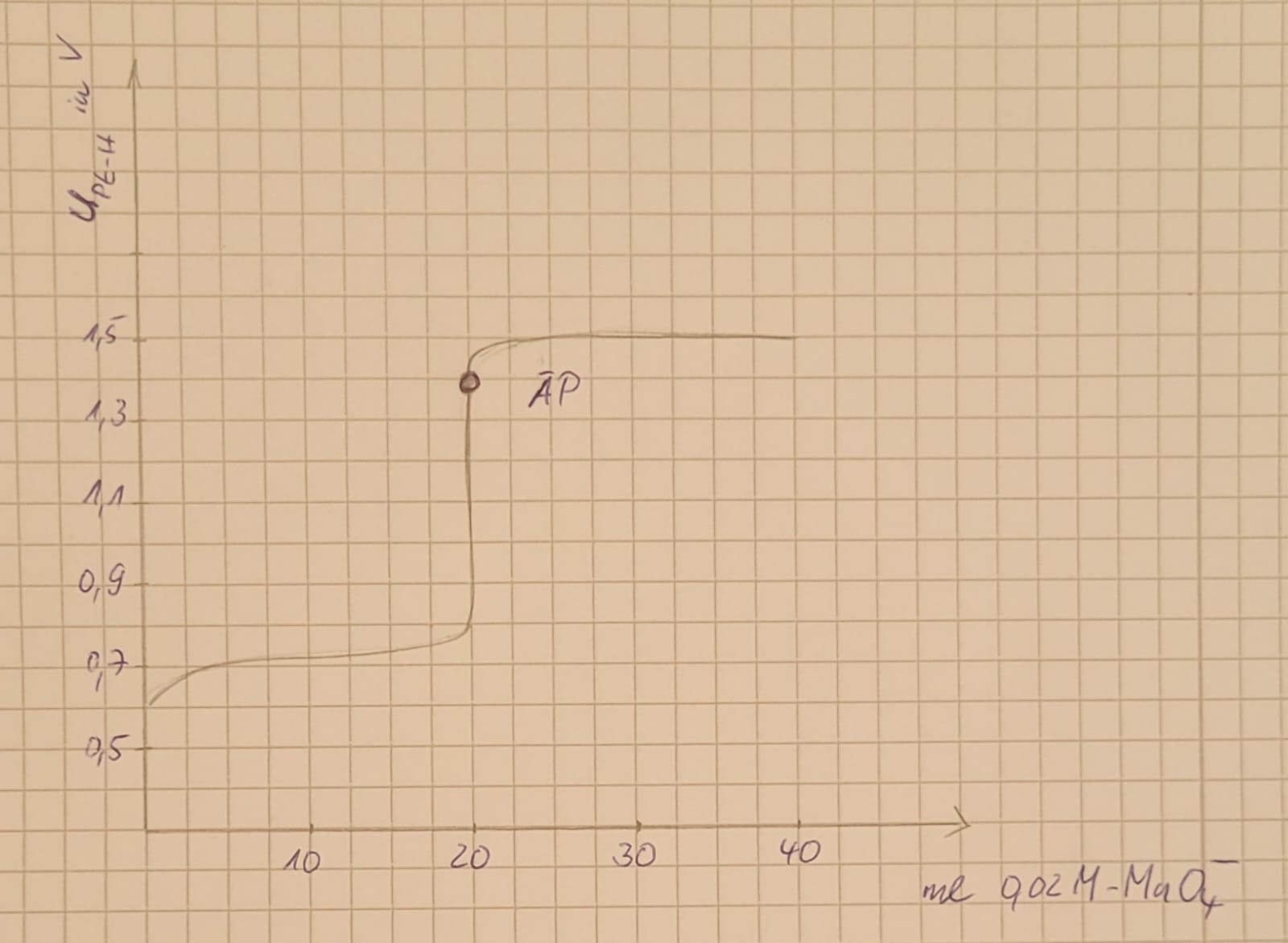
- Red-Ox-Titrationen werden auch mittels Potentiometrie indiziert. Wie ist das Potential bei τ = 0,5 , τ = 1 und τ = 1,5 bei der Titration von Eisen(II)-sulfat mit Kaliumpermanganatlösung?
τ = 0,5 => Das Potential ist gleich dem Normalpotential von Eisen, da am Anfang der Titration nur Eisenionen in der Lösung vorliegen.
τ = 1 => Das Potential am ÄP liegt näher an dem Normalpotential von Permanganat, da bei MnO4 - mehr Elektronen übertragen werden.
τ = 1,5 => Das Potential entspricht dem Normalpotential von der Maßlösung. 17
Einzelnachweise
1 https://pharmchem.de.cool/wiki/Instru/Potentiometrie Stand am 26.05.2022 um 13:00 Uhr ⇑
2 vgl. Skript "Einführung in die Instrumentelle Analytik: Elektrochemische Methoden von Dr. Oliver Orban, Wintersemester 2021/22, TU Braunschweig: Potentiometrie ⇑
3 vgl. Skript "Einführung in die Instrumentelle Analytik: Elektrochemische Methoden von Dr. Oliver Orban, Wintersemester 2021/22, TU Braunschweig: Potentiometrie ⇑
4 vgl. Skript "Einführung in die Instrumentelle Analytik: Elektrochemische Methoden von Dr. Oliver Orban, Wintersemester 2021/22, TU Braunschweig: Potentiometrie ⇑
5 https://pharmchem.de.cool/wiki/Instru/Potentiometrie Stand am 26.05.2022 um 13:10 Uhr ⇑
6 vgl. Skript "Einführung in die Instrumentelle Analytik: Elektrochemische Methoden von Dr. Oliver Orban, Wintersemester 2021/22, TU Braunschweig: Potentiometrie. Eigene Abbildung ⇑
7 vgl. Skript "Einführung in die Instrumentelle Analytik: Elektrochemische Methoden von Dr. Oliver Orban, Wintersemester 2021/22, TU Braunschweig: Potentiometrie. Eigene Abbildung ⇑
8 Eigene Zeichnung, vgl. https://studyflix.de/chemie/galvanische-zelle-1694 Stand: 19.06.22, 16:00 Uhr ⇑
9 vgl. Skript "Einführung in die Instrumentelle Analytik: Elektrochemische Methoden von Dr. Oliver Orban, Wintersemester 2021/22, TU Braunschweig: Potentiometrie ⇑
10 https://www.chemie.de/lexikon/Potentiometrie.html Stand am 20.05.2022 um 16:06 Uhr ⇑
11 https://pharmchem.de.cool/wiki/Instru/Potentiometrie Stand am 20.05.2022 um 16:09 Uhr ⇑
12 vgl. Skript "Einführung in die Instrumentelle Analytik: Elektrochemische Methoden von Dr. Oliver Orban, Wintersemester 2021/22, TU Braunschweig: Potentiometrie ⇑
13 vgl. Skript "Einführung in die Instrumentelle Analytik: Elektrochemische Methoden von Dr. Oliver Orban, Wintersemester 2021/22, TU Braunschweig: Potentiometrie ⇑
14 vgl. Skript "Einführung in die Instrumentelle Analytik: Elektrochemische Methoden von Dr. Oliver Orban, Wintersemester 2021/22, TU Braunschweig: Potentiometrie ⇑
15 vgl. Skript "Einführung in die Instrumentelle Analytik: Elektrochemische Methoden von Dr. Oliver Orban, Wintersemester 2021/22, TU Braunschweig: Potentiometrie ⇑
16 vgl. Skript "Einführung in die Instrumentelle Analytik: Elektrochemische Methoden von Dr. Oliver Orban, Wintersemester 2021/22, TU Braunschweig: Potentiometrie ⇑
17 vgl. Skript "Einführung in die Instrumentelle Analytik: Elektrochemische Methoden von Dr. Oliver Orban, Wintersemester 2021/22, TU Braunschweig: Potentiometrie ⇑
18 Eigene Zeichung ⇑