Karl-Fischer-Titration
Titelblatt
Übung
Karl-Fischer-Titration
SoSe 2022
Abgabedatum
20.06.2022
Expertengruppe 9
Seyedehzahra Mahboubi
Sarah Scheerer
Anita Styrz
Inhaltsverzeichnis
Alle Lösungen sind eingeblendet. Alle Lösungen ausblenden
Multiple Choice (MC) Fragen
Reaktionspartner
Ordnen Sie den Reaktionspartnern des Karl-Fischer-Reagenzes die richtigen Funktionen zu (Mehrfachauswahl möglich).
- Pyridin
- Methanol
- Reduziert Iod zu Iodid
- Abpufferung von Protonen
- Lösungsmittel
- Verbessert die Empfindlichkeit der Reaktion
- Bildet schwerflüchtiges Addukt mit Schwefeldioxid
1.Pyridin : B, E
Der Zusatz einer Base (hier Pyridin) ist notwendig, um entstehende Protonen abzupuffern.Dadurch wird das Gleichgewicht auf die Produktseite verschoben. Außerdem bildet das entstehende SO2 ein schwer flüchtiges Addukt mit Pyridin und verhindert damit das Austreten des Gases aus der Lösung, wodurch der Dampfdruck gesenkt wird.1
2.Methanol : C, D
Neben anderen Alkoholen wird Methanol häufig als Lösungsmittel eingesetzt, um auch polare Substanzen gut lösen zu können. Darüber hinaus ist Methanol ebenfalls als Reaktionspartner beteiligt und bildet Monomethylsulfat, wodurch sich das stöchiometrische Verhältnis von Wasser zu Iod von 2:1 auf 1:1 ändert und damit die Empfindlichkeit und Präzision erhöht wird.2
Berechnung Wirkwert
Der ermittelte Wassergehalt einer Probe nach der Titration mit dem Karl-Fischer-Titrierautomaten beträgt w(H2O)= 5,00%. Die Einwaage der Probe lautet 0,2000g und der Verbrauch an Maßlösung beträgt 2,00ml. Welche Angabe des Wirkwertes des Karl-Fischer-Reagenzes ist richtig?
- 0,50 mg/ml
- 5,00 mg/l
- 5,00 mg/ml
- 50 mg/l
- 10 mg/ml
Lösung C ist richtig.
Formel für die Berechnung des Massenanteils an Wasser in der Probe:
⚠ $$ w(H_{2}O) = \tfrac{Wirkwert _ {KF-Lösung} [\tfrac{[mg] Wasser} {[ml] KF-Lösung}] \cdot V_{KF-Lösung} [ml]} {m_ {Probe} [mg]} \cdot 100 ⚠ $$
Umstellen der Formel:
⚠ $$ Wirkwert [mg / ml] = \tfrac{\tfrac{w(H_{2}0)} {100} \cdot m _{Probe} [mg]} {V_{KF-Lösung} [ml]}⚠ $$
Einsetzen der gegebenen Werte:
⚠ $$ x = \tfrac {0,05 \cdot 200 mg} {2,00 ml}⚠ $$
⚠ $$ x= 5,00 mg/ml ⚠ $$ d.h.: 1 ml des Karl-Fischer-Reagenzes setzt 5 mg Wasser um.
3
Messkette
Welche Messkette wird bei der bivoltametrischen und der biamperometrischen Indikation der Karl-Fischer-Titration eingesetzt?
- Standardwasserstoffelektrode und Quecksilbertropfelektrode
- Doppelplatinelektrode
- Mercurosulfatelektrode (MSE) und Wasserstoffelektrode
- Mercurosulfatelektrode und Glaselektrode
- Chinhydronelekrode
- 1, 2 und 4
- 1 und 3
- nur 5
- nur 2
- 1 bis 5 richtig
Antwort D ist korrekt, da bei der biamperometrischen und bivoltametrischen Indikation die Doppelplatinelektrode verwendet wird. 4
Reversible Redoxsysteme
Welche Aussagen zu reversiblen Redoxsystemen bei der Karl-Fischer-Titration treffen zu?
- Bei der biamperometrischen Indikation kommt es zu einem starken Anstieg der Stromstärke, wenn in der Lösung kein reversibles Redoxsystem mehr vorliegt.
- Bei der bivoltametrischen Indikation liegt nach dem Äquivalenzpunkt ein reversibles Redoxsystem vor.
- Von einem reversiblen Redoxsystem spricht man, wenn Oxidation und Reduktion eines Redoxsystems bei gleichem Potential auftreten.
- Bei der Karl-Fischer-Titration liegt das reversible Redoxsystem I2/I- vor.
- Bei der Karl-Fischer-Titration liegt das reversible Redoxsystem Cl2/Cl- vor.
- 1, 3 und 4
- nur 2 und 4
- 2, 3 und 4
- nur 1 und 5
- 1 bis 5 (alle)
Antwort C ist korrekt.
Da ab dem Äquivalenzpunkt das Wasser verbraucht ist, wird das Iod nicht mehr für die Umsetzung des Wassers verwendet. Daher liegt es frei in der Lösung vor und bildet mit dem Iod, dass vorher zu Iodid reduziert wurde ein reversibles Redoxsystem (I2/I-).
Aussage 1 ist falsch, da die Stromstärke bei der biamperometrischen Indikation ansteigt, wenn ein reversibles Redoxsystem vorliegt.
Außerdem ist Aussage 5 falsch, da wir kein Chlor als Reagenz bei dieser Titration verwenden. 5
Praktische Durchführung
Der Wassergehalt einer Probe wird mithilfe des Karl-Fischer-Reagenzes bei bivoltametrischer Indikation mit einem Titrierautomaten bestimmt. Während des Titrationsvorganges wird die Lösung im Titrierautomaten trüb. Welche Aussagen treffen zu?
- Die Trübung indiziert den Endpunkt der Titration.
- Es muss eine erneute Konditionierung erfolgen, bei der der Restwasseranteil im Methanol bestimmt wird.
- Der Titrationsvorgang muss unterbrochen werden.
- Die Trübung hat keine Auswirkungen auf die Bestimmung des Wassergehaltes in der Probe.
- Das Löslichkeitsprodukt der Probe wurde überschritten.
- nur 1
- nur 2
- 1 und 4
- 3 und 5
- 2,3 und 5
Lösung E ist richtig.
Durch das Überschreiten des Löslichkeitsprodukts der Probe kommt es zur Ausfällung und folgender Trübung. Der Titrationsvorgang muss unterbrochen werden, um neues Methanol einzufüllen und um eine erneute Konditionierung mit anschließender Wirkwertbestimmung durchzuführen. Bei der Konditionierung wird der Restwasseranteil im Lösungsmittel entfernt, um eine Verfälschung des tatsächlichen Wassergehalts der Probe zu verhindern.6
Textaufgaben
Indikationsmöglichkeiten
- Es gibt viele Möglichkeiten die Karl-Fischer-Titration zu indizieren. Ordnen Sie die folgenden Graphen der biamperometrischen, bivoltametrischen und der potentiometrischen Indikation zu und beschreiben Sie kurz die Indikationsverfahren.
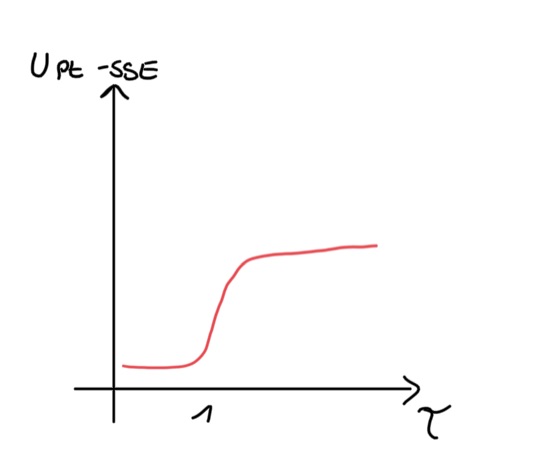
Abbildung 1:
potentiometrische Indikation: Bei der potentiometrischen Indikation wird die Potentialdifferenz im stromlosen Zustand gemessen. Da sich am Äquivalenzpunkt die Spannung ändert, kann dieser bestimmt werden. Die potentiometrische Indikation ist möglich, weil eine Redoxreaktion vorliegt. Es kann eine Bezugselektrode aus Platin mit wasserfreiem Zwischenelektrolyt (z.B. Lithiumchlorid in Ethanol) verwendet werden.
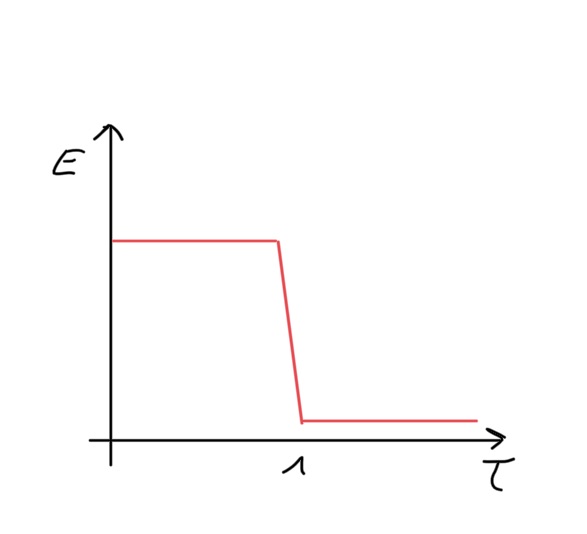
Abbildung 2:
bivoltametrische Indikation: Bei der bivoltametrischen Indikation wird zwischen den Elektroden ein konstanter Strom angelegt und die zu seiner Aufrechterhaltung nötige Spannung gemessen. Der Endpunkt der Titration wird dadurch angezeigt, dass das Potenzial ab dem Äquivalenzpunkt abfällt, da ab hier ein reversibles Redoxsystem (I2/I-) vorliegt.
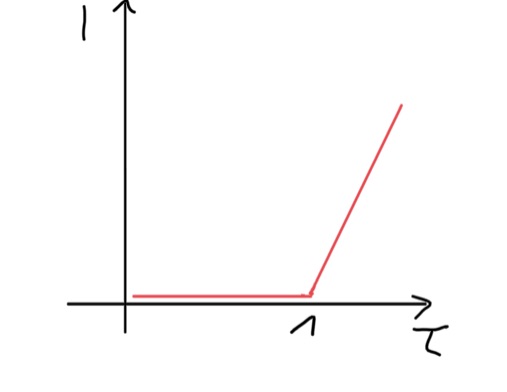
Abbildung 3:
biamperometrische Indikation. Bei der biamperometrischen Indikation wird eine konstante Polarisationsspannung angelegt und die Stromstärke, die für die Aufrechterhaltung der Spannung notwendig ist gemessen. Der Äquivalenzpunkt wird durch einen starken Anstieg der Stromstärke (Kick-Off-Kurve) angezeigt. Der starke Anstieg kommt daher, dass ab dem Äquivalenzpunkt ein reversibles Redoxsystem (I2/I-) vorliegt.1011
- Die Indikation der Karl-Fischer-Titration ist nicht nur biamperometrisch, bivoltametrisch und potentiometrisch, sondern auch coulometrisch möglich. Erklären Sie diese Indikationsmöglichkeit.
Bei der Coulometrie wird die Ladungsmenge während der vollständigen elektrochemischen Umsetzung gemessen. Die coulometrische Karl-Fischer-Titration ist eine galvanostatische Coulometrie, bei der Strom als Reagenz verwendet wird und dafür sorgt, dass der Analyt freigesetzt wird. Für die Reaktion wird Iod zunächst durch elektrochemische Oxidation erzeugt und geht dann als Edukt in die Reaktion ein. Die transportierte Ladung kann aus der gemessenen Zeit und der Stromstärke errechnet werden. Der Wassergehalt in der Probelösung kann bestimmt werden, da die benötigte Ladung proportional zur Masse ist. 12.
- Bei der biamperometrischen Bestimmung muss eine Spannung von 500 mV und bei der bivoltametrischen Bestimmung eine Stromstärke von 20 µA angelegt werden. Erklären Sie warum diese Parameter im Verhältnis zu anderen biamperometrischen und bivoltametrischen Messungen hoch gewählt werden müssen.
Die Spannung und die Stromstärke müssen höher sein, da bei der Titration im wasserfreien Medium gearbeitet wird und dadurch der Innenwiderstand der Lösung erhöht ist. Dies lässt sich erklären durch das Ohm´sche Gesetz:
⚠ $$ U = {R \cdot I} ⚠ $$ 13
- Das Arzneibuch gibt eine weitere Methode für die Wasserbestimmung in Feststoffen an. Nennen Sie diese Methode und die wesentlichen Nachteile dieser Methode gegenüber der Karl-Fischer-Titration.
Zur Bestimmung des Wassergehaltes eines Feststoffes kann auch die Bestimmung des Trocknungsverlustes durchgeführt werden.
Wesentliche Nachteile:
1. großer Zeitaufwand, da die Probe immer bis zur Massenkonstanz getrocknet werden muss.
2. Kristallwasser kann nicht bestimmt werden.
3. leicht flüchtige Substanzen gehen bei der Trocknung ebenfalls verloren und verfälschen dadurch den Wassergehalt. 14
Störeffekte
- Beschreiben Sie mit einer stöchiometrischen Reaktionsgleichung die Karl-Fischer-Titration.
Die Grundlage der Reaktion bildet die Bunsen-Reaktion: 2H2O + I2 + SO2 ⇌ 2HI + H2SO4
Die Reaktionsgleichung der Karl-Fischer-Titration mit Karl-Fischer Reagenz ( I2+ SO2+ 3 Py) lautet: H2O + I2+ SO2+ CH3OH + 3 Py -> 2 I-+ CH3OSO3- + 3 PyH+ 15
- Ist es möglich den Wassergehalt von Benzophenon mit Hilfe von Methanol als Lösungsmittel bei der Karl-Fischer-Titration zu bestimmen? Begründen Sie ihre Antwort.
Nein, weil diese Substanz als funktionelle Gruppe eine Keto-Gruppe enthält. Ketone und Aldehyde reagieren mit Methanol unter Wasserbildung zu Vollacetalen, wodurch der Wassergehalt erhöht werden würde. 16
- Beschreiben Sie zu welchen Störungen Reduktions- und Oxidationsmittel während der Karl-Fischer-Titration führen.
Durch Reaktion mit Oxidationsmitteln wie z.B. Kaliumpermanganat wird Iodid zum Iod oxidiert. Das führt zu einem geringer gemessenen Wassergehalt. Im Gegensatz zu Oxidationsmitteln reagieren Reduktionsmittel wie z.B Ascorbinsäure mit Iod. Iod wird in diesem Fall zu Iodid reduziert, dadurch kommt es zu einem höher gemessenen Wassergehalt.17
- Erklären Sie warum bei dieser Titration ein Molsieb verwendet wird.
Das Molsieb verhindert, dass Luftfeuchtigkeit in die Probe gelangt, indem es die Luftfeuchtigkeit bindet. Das ist wichtig, weil die Titration wasserfrei durchgeführt werden muss. Wenn kein Molsieb verwendet werden würde, könnte ein verfälschter Wassergehalt ermittelt werden.18
Einzelnachweise
Welche Quellen wurden verwendet.
1 vgl. URL:https://pharmchem.de.cool/wiki/Instru/Karl-Fischer-Titration (Stand 26.05.22) ⇑
2 vgl. URL:https://pharmchem.de.cool/wiki/Instru/Karl-Fischer-Titration (Stand 26.05.22) ⇑
3 vgl. Instrumentelle Analytik, Praktikumsskript, Dr.Thomas Kellner,Version 10, S.33 (11.04.2022) ⇑
4 vgl. Instrumentelle Analytik, Praktikumsskript, Dr. Thomas Kellner, Version 10, S.32 (WiSe21/22) ⇑
5 vgl. Einführung in die instrumentelle Analytik: Elektrochemische Methoden, Dr. Oliver Orban, S. 101 und 104 (WiSe2021) ⇑
6 vgl. Einführung in die instrumentelle Analytik: Elektrochemische Methoden, Dr. Oliver Orban, S. 103 (SoSe 2022) ⇑
7 eigene Zeichnung von Sarah Scheerer ⇑
8 eigene Zeichnung von Sarah Scheerer ⇑
9 eigene Zeichnung von Sarah Scheerer ⇑
10 vgl. URL:https://pharmchem.de.cool/wiki/Instru/Karl-Fischer-Titration (Stand 29.05.22) ⇑
11 vgl. Ph.Eur.10.Ausgabe, Grundwerk 2020: Komplexometrische Titrationen: 2.5.11 Halbmikrobestimmung von Wasser-Karl-Fischer-Methode S.234, 235 ⇑
12 vgl. Einführung in die instrumentelle Analytik: Elektrochemische Methoden, Dr. Oliver Orban, S.106,109 und 111 (WiSe21/22) ⇑
13 vgl. Allgemeine Hinweise zu den praktischen Versuchen: Teil Elektrochemie, Dr. Oliver Orban, S. 15 (SoSe2022) ⇑
14 vgl. Ph.Eur.10.Ausgabe, Grundwerk 2020: Allgemeine Methoden: 2.2.32 Trocknungsverlust S.77,78 ⇑
15 vgl. Einleitung in die Instrumentelle Analytik: Elektrochemische Methoden, Dr. Oliver Orban S.101 (WiSe21/22) ⇑
16 vgl. Einleitung in die Instrumentelle Analytik: Elektrochemische Methoden, Dr. Oliver Orban S.102 (WiSe21/22) ⇑
17 vgl. Einleitung in die Instrumentelle Analytik: Elektrochemische Methoden, Dr. Oliver Orban S.102 (WiSe21/22) ⇑
18 vgl. Einleitung in die Instrumentelle Analytik: Elektrochemische Methoden, Dr. Oliver Orban S.104 (WiSe21/22) ⇑