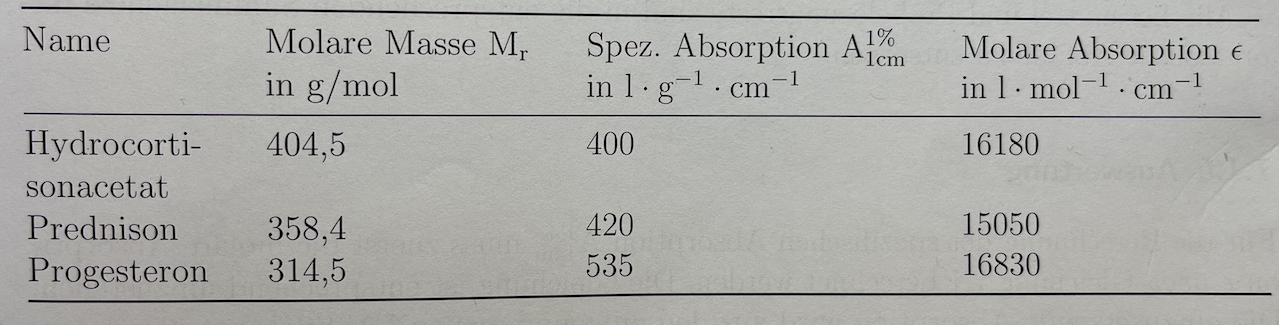UV-VIS-Spektroskopie
Übung
UV/VIS-Spektroskopie
SoSe 2022
Abgabedatum
30.05.2022
Expertengruppe 07
Joana Tonn
Yannick Reder
Inhaltsverzeichnis
Multiple Choice (MC) Fragen
Chromophore
Welche Aussagen zu Chromophoren treffen zu?
- Sichtbares Licht reicht für die Anregung von Elektronen aus großen Chromophoren mit n=10 Doppelbindungen aus.
- Für die Anregung von Elektronen aus kleinen Chromophoren wird weniger Energie benötigt als für die Anregung von Elektronen aus großen Chromophoren.
- Elektronen aus konjugierten Chromophoren werden bei höheren Wellenlängen, isolierte Chromophore bei kleineren Wellenlängen angeregt.
- Die erkennbare Farbe eines Chromophors ist die Komplementärfarbe der Wellenlänge, bei der das Licht absorbiert wurde.
- nur 1
- nur 2 und 3
- nur 1,3 und 4
- nur 1,2 und 4
- 1 bis 4 (alle)
Antwort C ist korrekt
Je weniger konjugierte Doppelbindungen, desto mehr Energie/kleinere Wellenlängen werden für die Anregung benötigt. Es gilt: Je größer ein π-Elektronensystem (große Chromophore) durch die Mesomerie mit konjugierten Doppelbindungen wird, desto geringer ist die nötige Anregungsenergie für ein höheres Energieniveau. Deshalb benötigen isolierte Chromophore eine höhere Anregungsenergie, um ein höheres Energieniveau einnehmen zu können. 1.
Lambert-Beer'sches Gesetz
Welche Aussage über das Lambert-Beer'sche Gesetz zur Quantifizierung der Absorption trifft NICHT zu?
- Das Lambert-Beer'sche Gesetz ist nur gültig für monochromatisches Licht.
- Das Lambert-Beer'sche Gesetz ist nur gültig für klare Lösungen.
- Die Absorption ist antiproportional zum molaren Absorptionskoeffizient.
- Mit dem Lambert-Beer'schen Gesetz können nur verdünnte Lösungen bestimmt werden.
- Das Lambert-Beer'sche Gesetz gilt nur, wenn die Schwächung der Strahlung in der Probe ausschließlich durch Absorption erfolgt.
Antwort C ist falsch
⚠ $\varepsilon = \frac{A}{c \cdot b}$ Hier ist zu erkennen, dass der molare Absorptionskoeffizient ⚠ $\varepsilon$ PROPORTIONAL zur Absorption ⚠ $A$ ist.2.
Aufbau eines UV/Vis-Spektrometers
Welche Aussagen über den Aufbau des UV/Vis-Spektrometers treffen zu?
- Mit einem Diodenarray-Detektor (DAD) lassen sich viele Wellenlängen gleichzeitig erfassen.
- Für die Messung bei 200 nm eignet sich eine Glasküvette.
- Ein Photomultiplier wandelt ein Lichtsignal in ein elektrisches Signal um.
- Eine Xenonlampe eignet sich ausschließlich als Lichtquelle für den Vis-Bereich.
- nur 1
- nur 3
- nur 1 und 3
- nur 3 und 4
- 1 bis 4 (alle)
Antwort C ist korrekt
Eine Glasküvette absorbiert die Wellenlängen im UV-Bereich. Für eine Messung im UV-Bereich muss zu einer Quarzglasküvette gegriffen werden.
Eine Xenonlampe kann für den gesamten UV/Vis-Bereich verwendet werden (200-800 nm). 3
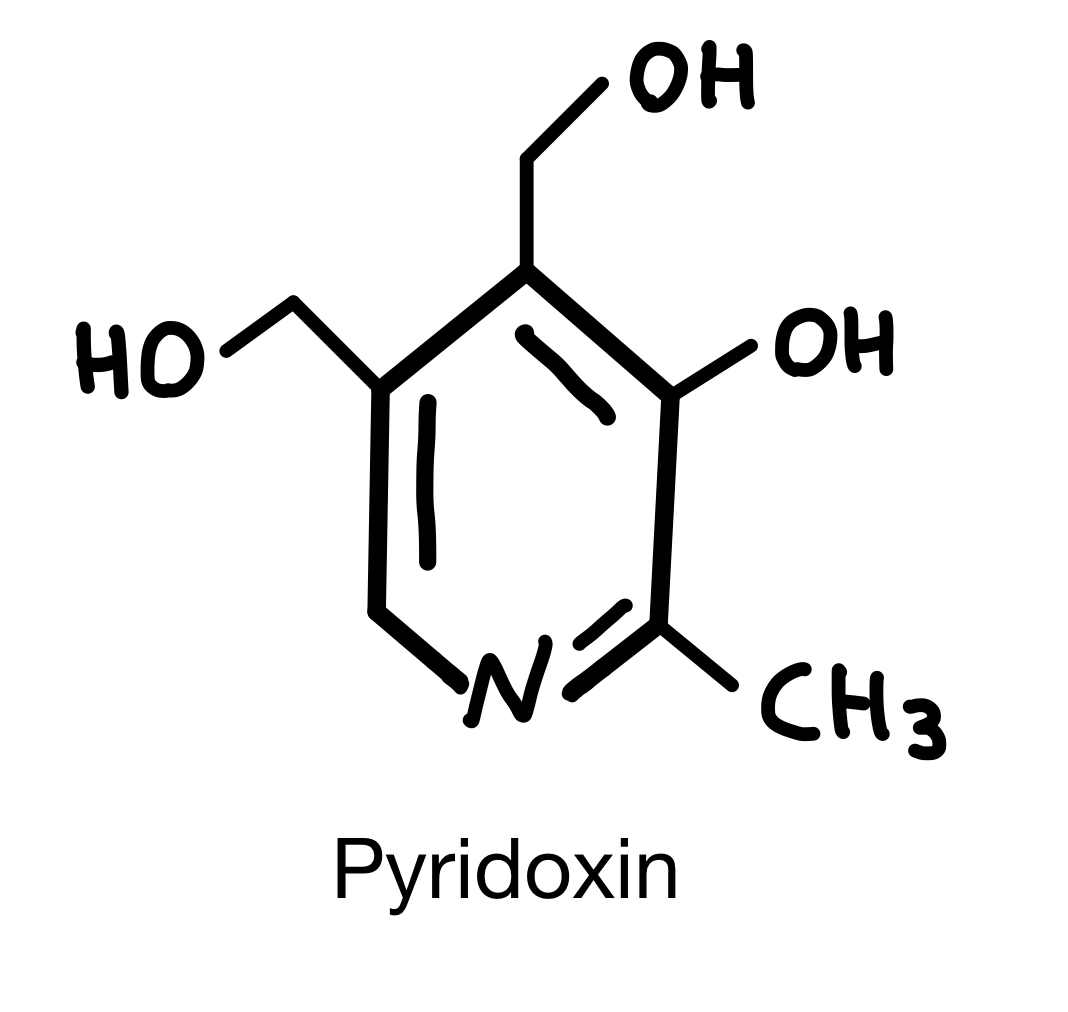
UV/Vis-Spektrum von Pyridoxin
Was erwarten Sie bei einer Veränderung des pH-Wertes?
- Wenn das Stickstoffatom protoniert wird, dann verschiebt sich das Absorptionsmaximum in den bathochromen Bereich.
- Bei einem stark sauren pH-Wert liegt Pyridoxin ungeladen vor.
- Im neutralen Bereich kommt es zum "push-pull-Effekt".
- Bei einer pH-Wert Umstellung von pH = 1,4 zu pH = 13 verschiebt sich das Absorptionsmaximum in den hypsochromen Bereich.
- nur 2
- nur 3
- nur 2 und 3
- nur 1 und 4
- 1 bis 4 (alle)
Antwort B ist korrekt
Bei einer Protonierung des Stickstoffatoms kommt es zur hypsochromen Verschiebung.
Bei einem sauren pH-Wert liegt Pyridoxin geladen (protoniert) vor. Dadurch wird die Delokalisation der π-Elektronendichte verringert, da das frei Elektronenpaar des Stickstoffs für die Bindung des Protons benötigt wird. Durch diese Erniedrigung wird mehr Energie zur Anregung benötigt.
Der "push-pull-Effekt" ist auf das Vorhandensein einer zwitterionischen Form im neutralen Bereich zurückzuführen: Es liegt ein elektronenziehender und ein elektronenschiebender Teil im Molekül vor.
Die Umstellung von pH = 1,4 auf pH = 13 bewirkt eine Deprotonierung, sowohl am Stickstoffatom als auch an der Hydroxylgruppe. Damit ist das Molekül negativ geladen. Dies führt somit zu einer Vergrößerung der Elektronendichte und zu einer bathochromen Verschiebung. 5
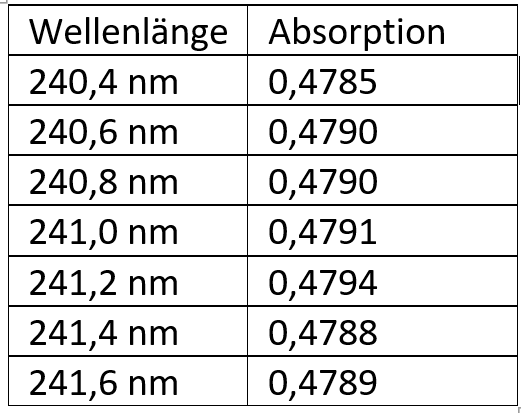
Molarer Absorptionskoeffizient von Hydrocortisonacetat
Eine Hydrocortisonacetat-Lösung mit einer Konzentration von 0,00003 mol/l (⚠ $c$) zeigt bei 240,8 nm ein Absorptionsmaximum von 0,4829 (⚠ $A$).
Wie groß ist der molare Absorptionskoeffizient (⚠ $\varepsilon$)?
M(Hydrocortisonacetat) = 404,5 g/mol, b = 1 cm
- 16097
- 160966,6
- 1609,6
- 13485
- 0,16097
Antwort A ist richtig
sehr wichtige Formel!: ⚠ $\varepsilon = \frac{A}{c \cdot b} = \frac{0,4829}{0,00003mol/l \cdot 1cm}$ 6.
Textaufgaben
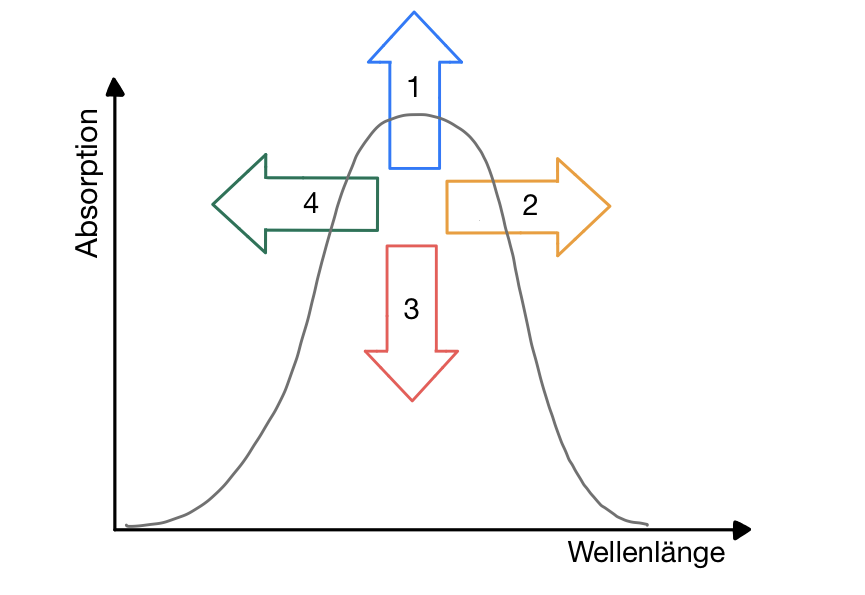
Absorptionsspektren
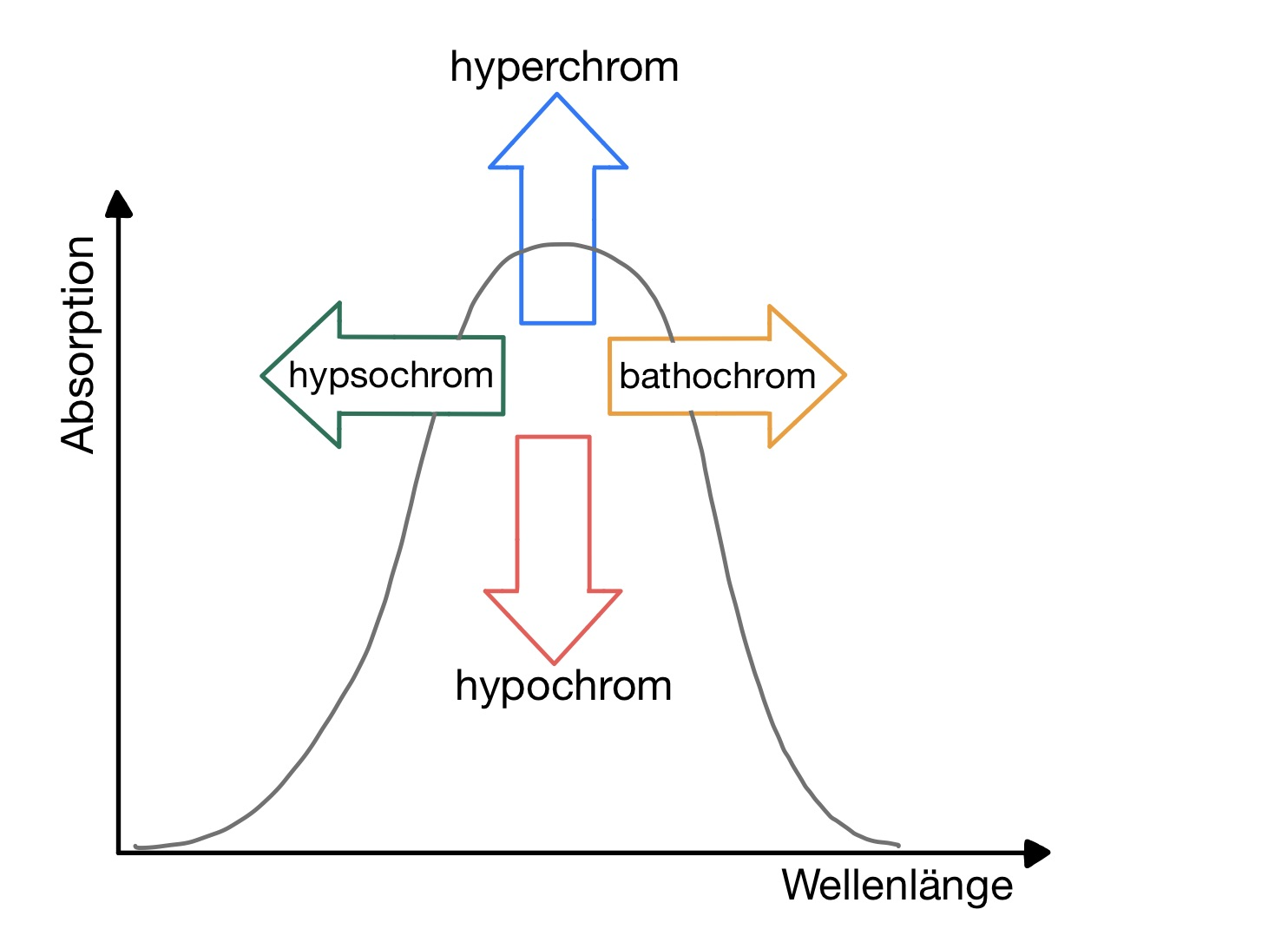
- Dargestellt sind die möglichen Verschiebungen eines Absorptionsmaximums.
 7
7
Bitte beschriften Sie die Ziffern 1-4 mit den zugehörigen Begriffen.
- Nennen Sie drei Faktoren, welche Einfluss auf die Verschiebung von Absorptionsmaxima haben.
z.B. pH-Wert Änderungen, hinzufügen auxochromer Gruppen, Redox-aktive Strukturelemente, Einfluss durch Lösemittel9.
- Welche Parameter müssen im Rahmen einer Gerätequalifizierung überprüft werden, damit keine fehlerhaften Spektren entstehen? Und was sagen diese Parameter aus?
1. Richtigkeit der Wellenlängenskala: Befinden sich die charakteristischen Absorptionsmaxima innerhalb der vom Arzneibuch festgelegten Bereiche?
2. Richtigkeit der Absorption: Messung von charakteristischen Minima/Maxima und daraus Kontrolle der spezifischen Absorption.
3. Kontrolle des Streulichts = Fehlstrahlung: Nicht absorbiertes Licht ist unerwünschtes Streulicht und verursacht Abweichungen vom Lambert-Beer'schen Gesetz, z.B. Streuung an Staubteilchen.
4. Kontrolle der spektralen Auflösung: Maß für die Fähigkeit die Absorption bei 2 verschiedenen Wellenlängen noch hinreichend genau zu trennen. 10
- Welche Fehler treten besonders häufig in Bezug auf die Durchführung einer UV/Vis-Spektroskopie (besonders im Praktikum) auf, die zu fehlerhaften Spektren führen können?
1. Wurde die Küvette vorher ausreichend gereinigt? Am besten öfter mit dem Lösungsmittel, in welchem die Probesubstanz gelöst ist, ausspülen und danach nochmal mehrmals mit der Probelösung spülen!
2. Ist die nicht mattierte Außenseite der Küvette frei von Verschmutzungen und Fingerabdrücken? Selbst minimale Reste von der vorher gemessenen Probesubstanz kann zu Messfehlern führen, genauso wie Fingerabdrücke. Lieber nach jedem Durchlauf nochmal kurz mit einem farblosen, feuchten Zellstoff säubern und trocknen lassen.
3. Ist die Probelösung frei von unerwünschten Verschmutzungen? Staubpartikel oder Flusen führen zu unerwünschtem Streulicht. Deswegen die gefüllten Küvetten nicht zu lange offen stehen lassen.
4. Korrektur der Basislinie mit reinem Lösungsmittel. Am besten das gleiche Lösemittel, welches zum Lösen der Probesubstanz verwendet wird.
etc. 11
Aufbau des Spektrometers und Interpretation von Werten
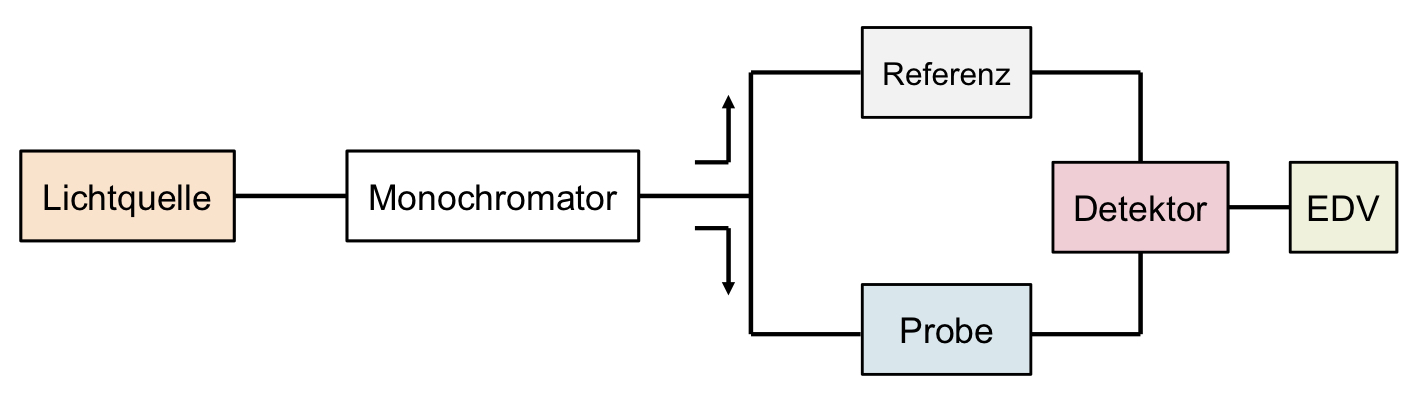
- Skizzieren Sie den Aufbau eines Zweistrahlspektrometers und beschreiben Sie die Funktion der Bauteile.
Lichtquelle: Mit kontinuierlichem, geeignetem Spektrum
Monochromator: Umwandlung von polychromatischem Licht in monochromatisches Licht.
Probenraum: Dort werden die Probe und die Referenz gleichzeitig vermessen.
Detektor: Umwandlung des Lichtsignals in ein elektrisches Signal.
EDV: Rechner, welcher das elektrische Signal auswertbar darstellt. 13
- Welche Vorteile bietet die Verwendung eines Diodenarraydetektors (DAD) und wie funktioniert er?
Es wird kein Monochromator mehr benötigt, da mehrere Wellenlängen gleichzeitig bestimmt werden können. Somit sind keine mechanischen Bauteile nötig, welche verschleißen können. Das polychromatische Licht, welches durch die Probe gelangt ist, wird an einem Reflexionsgitter (Polychromator) in seine einzelnen Wellenlängen aufgeteilt und gelangt auf Photodiode, wo jede einzelne Photodiode eine Wellenlänge wahrnimmt und an die EDV weiterleitet. Zudem wird die Messung in Sekundenbruchteilen durchgeführt.14.
- Identifizierung von Steroidhormonen
Sie erhalten eine Retoure vom Kunden, da das Etikett soweit beschädigt worden ist, dass nur noch die Aufschrift: "Steroidhormone" zu erkennen ist. Der Kunde hat keine Möglichkeit die Identität zu bestimmen und beauftragt Sie damit. Sie haben nur drei Hormone im Sortiment und haben folgende Stoffdaten vorliegen:
Sie wollen das Hormon mit einem Zweistrahlspektrometer identifizieren. Dazu wird eine Vergleichsküvette mit hochreinem Methanol befüllt, eine Probelösung mit einer Konzentration von 0,00003mol/l aus hochreinem Methanol und Probesubstanz hergestellt und diese anschließend bei 200-300nm vermessen.
Sie erhalten folgenden Auszug aus dem Spektrum und berechnen die spezifische Absorption. Um welches Hormon handelt es sich am wahrscheinlichsten? ⚠ $b = 1cm$
⚠ $\varepsilon = \frac{A}{c \cdot b} = \frac{0,4794}{0,00003mol/l \cdot 1cm} = 15980$ Hydrocortisonacetat liegt am nächsten.
⚠ $spez.Absorption = \frac{10 \cdot \varepsilon}{M(Hydrocortisonacetat)} = \frac{10 \cdot 15980}{404,5g/mol)} ≈ 395$ 17
- Schnellbestimmung
Sie möchten eine schnelle Möglichkeit entwickeln, um Riboflavin und Thiaminchlorid-HCl mittels UV/Vis-Spektroskopie quantitativ nachzuweisen, da Ihr Unternehmen ein Präparat mit beiden Inhaltsstoffen produziert. Sie möchten an der Absorption abschätzen, ob die Massenanteile im Präparat stimmen.
Auf welche Absorption kommen Sie, wenn bei 247nm die spez. Absorption von Riboflavin 355 in 100ml/g*cm und die von Thiaminchlorid-HCl 410 in 100ml/g*cm beträgt und die passenden Massenanteile in definierten Probelösungen von Riboflavin bei 0,7mg/100ml und von Thiaminchlorid-HCl bei 0,6mg/100ml18 liegen? ⚠ $b = 1cm$
Diese Absorption soll als festgelegter Wert zum Abschätzen dienen.
Was wurde an dieser Art des Nachweises nicht bedacht?
⚠ $A = spez. Absorption(RV, 247nm) \cdot ß(RV) \cdot b + spez. Absorption(TAC, 247nm) \cdot ß(TAC) \cdot b$
⚠ $A = 355 \frac{100ml}{g \cdot cm} \cdot \frac{0,0007g}{100ml} \cdot 1cm + 410 \frac{100ml}{g \cdot cm} \cdot \frac{0,0006g}{100ml} \cdot 1cm = 0,4945$
Da die Absorption immer die Summe aller Einzelabsorptionen ist, ist diese Art der Gehaltsbestimmung nicht wirklich genau. Sollte nämlich bei einem Stoff deutlich mehr und beim anderen Stoff deutlich weniger enthalten sein, dann bleibt die Absorption im schlimmsten Fall gleich.
Info
Uns fiel das Buch "Instrumentelle Analytik kompakt" besonders positiv auf. Wenn ihr einen schnellen Überblick über alle Themen braucht, dann holt es euch.
Einzelnachweise
1 Seminarskript: "Instrumentelle Analytik-UV-Vis-Spektroskopie", 4. Semester, Dr. Thomas Kellner, SoSe2022, S. 25-30 ⇑
2 Seminarskript: "Instrumentelle Analytik-Grundlagen-Spektrometrie", 4. Semester, Dr. Thomas Kellner, SoSe2022, S. 16-19 ⇑
3 Seminarskript: "Instrumentelle Analytik-UV-Vis-Spektroskopie", 4. Semester, Dr. Thomas Kellner, SoSe2022, S. 5-14 ⇑
4 eigene Zeichnung, Joana Tonn, 25.05.2022 ⇑
5 Seminarskript: "Instrumentelle Analytik-UV-Vis-Spektroskopie", 4. Semester, Dr. Thomas Kellner, SoSe2022, S. 32-34 ⇑
6 Praktikumsskript: "Instrumentelle Analytik", 4. Semester, Dr. Thomas Kellner, Version 10, SoSe2022, S. 35-37 ⇑
7 eigene Zeichnung, Joana Tonn, 25.05.2022 ⇑
8 eigene Zeichnung, Joana Tonn, 25.05.2022 ⇑
9 Seminarskript: "Instrumentelle Analytik-UV-Vis-Spektroskopie", 4. Semester, Dr. Thomas Kellner, SoSe2022, S. 31-42 ⇑
10 Seminarskript: "Instrumentelle Analytik-UV-Vis-Spektroskopie", 4. Semester, Dr. Thomas Kellner, SoSe2022, S. 16-20 ⇑
11 Seminarskript: "Instrumentelle Analytik-UV-Vis-Spektroskopie", 4. Semester, Dr. Thomas Kellner, SoSe2022, S. 22-23 ⇑
12 Abbildung aus: Seminarskript: "Instrumentelle Analytik-UV-Vis-Spektroskopie", 4. Semester, Dr. Thomas Kellner, SoSe2022, S. 5 ⇑
13 Seminarskript: "Instrumentelle Analytik-UV-Vis-Spektroskopie", 4. Semester, Dr. Thomas Kellner, SoSe2022, S. 5-14 ⇑
14 Seminarskript: "Instrumentelle Analytik-UV-Vis-Spektroskopie", 4. Semester, Dr. Thomas Kellner, SoSe2022, S. 12-14 ⇑
15 Praktikumsskript: "Instrumentelle Analytik", 4. Semester, Dr. Thomas Kellner, Version 10, SoSe2022, S. 35 ⇑
16 ausgedachte Daten, Yannick Reder, 25.05.2022 ⇑
17 Dominik, Steinhilber, Wurglics: "Instrumentelle Analytik kompakt", 3. Auflage, S. 13 ⇑
18 ausgedachte Daten, Yannick Reder, 25.05.2022 ⇑