Konduktometrie
Übung
Konduktometrie
SoSe 2022
Abgabedatum
20.06.2022
Expertengruppe 11
Siarhei Nishchyk
Jonas Schneider
Sebastian John
1) Konduktometer 2) Dosimat 3) Schalter, um Maßlösung abzugeben 4) Bürette 5) Leitfähigkeitsmesszelle
Inhaltsverzeichnis
Multiple Choice (MC) Fragen
Leitvermögen
Welche kennzeichnenden Größen beeinflussen das Leitvermögen?
- Konzentration der Ionen (c in mol/L)
- Ladungszahl der Ionen (z*)
- Wanderungsgeschwindigkeit (v)
- Ionenbeweglichkeit (u)
- Temperatur (T)
- nur 1
- nur 1 und 2
- nur 2 und 5
- nur 1, 2, 3 und 4
- 1 bis 5 (alle)
Antwort E ist korrekt
Der Leitwert ist abhängig von der Konzentration c, der Ladungszahl z*, der Wanderungsgeschwindigkeit v und der Ionenbeweglichkeit u,
da
⚠ $ Λ = \frac{1000 \cdot k}{c \cdot z \cdot n}\ $
gilt.
Die Temperatur T soll während der Messung konstant bleiben, da diese die Wanderungsgeschwindigkeit und Ionenbeweglichkeit bzw. die Grenzionenäquivalentleitfähigkeit beeinflusst. Sonst ist das für die Richtigkeit der Messung notwendige lineare Verhältnis zwischen c und G (Leitwert), bzw c und k (Leitfähigkeit) nicht mehr gegeben. 2
Titrationsverlauf
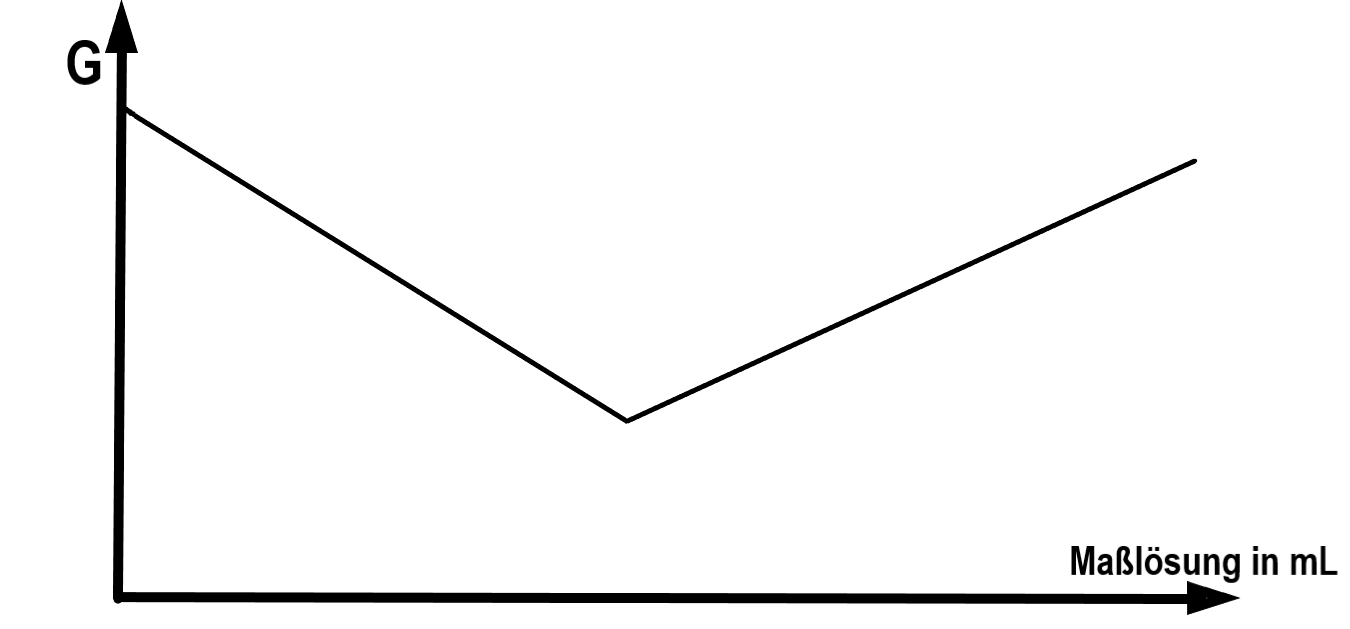
G: Leitwert
Welche der unten beschriebenen konduktometrischen Titrationen können durch den dargestellten Titrationsverlauf beschrieben werden?
- Salzsäure mit Natriumhydroxidlösung
- Natriumacetat mit Salzsäurelösung
- Salzsäure mit Ammoniaklösung
- Ammoniumchlorid mit Natriumhydroxidlösung
- Essigsäure mit Natriumhydroxidlösung
- nur 1
- nur 2
- nur 2 und 4
- nur 1 und 3
- nur 1 und 5
Antwort A ist korrekt
1. Vor dem Äquivalenzpunkt wird ⚠ $H_{3}O^{+}$ durch die Natriumionen der Natronlauge ersetzt, dessen Leitfähigkeit deutlich schlechter ist. Dadurch sinkt die Gesamtleitfähigkeit. Nachdem der Äquivalenzpunkt erreicht ist, steigt die Gesamtleitfähigkeit aufgrund der Zugabe der gut leitenden ⚠ $OH^{-}$ Ionen wieder an. 4
2. Bei der Titration des Natriumacetats treten an die Stelle der Acetationen die etwas besser leitenden Chloridionen. Die dadurch entstehende Essigsäure liegt weitgehend undissoziiert vor (Bsp. ca. 5% bei 0,01 mol/L), sodass die Leitfähigkeit nur leicht ansteigen wird. Nachdem der Äquivalenzpunkt erreicht wird, gibt es einen starken Leitfähigkeitsanstieg durch die ⚠ $H_{3}O^{+}$ Ionen. 5
3. Die Titration von Salzsäure mit Ammoniak ist eine Titration starker Säure mit schwacher Base. Zunächst fällt die Gesamtleitfähigkeit durch Neutralisation der ⚠ $H_{3}O^{+}$ Ionen, nach dem Äquivalenzpunkt wird die Gesamtleitfähigkeit kaum beeinflusst. Ammoniak dissoziiert im Wasser nur zum geringen Anteil. 6
4. Bei der Titration von Ammoniumchlorid ersetzen die schlechter leitenden Natrium-Ionen die Ammonium-Ionen. Dadurch sinkt zunächst leicht die Leitfähigkeit, bis der Äquivalenzpunkt erreicht wird. Der Abfall der Leitfähigkeit ist dabei deutlich flacher im Vergleich zum Anstieg nach dem Äquivalenzpunkt. 7
5. Die Essigsäure liegt nur schwach dissoziiert vor, und kann keinen so hohen Leitwert zu Beginn haben. Der Leitwert wäre deutlich geringer und würde langsam ansteigen. Nachdem der Äquivalenzpunkt erreicht wird, gibt es einen starken Leitfähigkeitsanstieg durch die ⚠ $OH^{-}$ Ionen.8
Elektrische Polarisation
Welche Aussagen zur elektrischen Polarisation treffen zu?
- Die durch die Polarisation gebildete Spannung beeinflusst den Widerstand nicht.
- Der elektrochemische Zustand, bei welchem kein Stromfluss trotz angelegter Spannung vorliegt, nennt man Polarisation.
- Die Polarisation kann verhindert werden, wenn mit Wechselspannung gearbeitet wird.
- Die Verwendung großflächiger Elektroden führt zu verstärkter Polarisation.
- Die Ladungszahl des Elektrodenmaterials beeinflusst die Polarisation.
- nur 2
- nur 1 und 2
- nur 2 und 3
- nur 1, 2 und 4
- 1 bis 5 (alle)
Antwort C ist korrekt
1. Der Widerstand wird von der Polarisationsspannung beeinflusst: ⚠ $ R = \frac{U-U_{p}}{I}\ $ 9
2. Es handelt sich um die Definition der elektrischen Polarisation. 10
3. Durch Einsatz von Wechselspannung, wechselt ständig die Polarität der Spannung. Die kurze Zeit zwischen der Umpolung reicht dabei nicht aus, um eine Polarisation der Elektroden zuzulassen. 11
4. Die Verwendung großflächiger Elektroden erschwert die Polarisation, da hier eine größere Fläche polarisiert werden muss. 12
5. Die Ladungszahl des Elektrodenmaterials beeinflusst die Polarisation nicht. Die Polarisation entsteht unabhängig von der Ladungszahl. 13
Leitwert
Welche Verunreinigungen im Wasser würden im Vergleich zu Reinstwasser eine deutliche Änderung des relativen Leitwerts ergeben?
- Essigsäure
- Natriumchlorid
- Aceton
- Harnstoff
- Dihydrogencarbonat
- nur 1 und 2
- nur 2 und 5
- nur 1, 3 und 4
- nur 1, 2 und 5
- 1 bis 5 (alle)
Antwort D ist korrekt
1. Essigsäure liegt in Wasser dissoziiert vor und ist somit nachweisbar. 14
2. Natriumchlorid ist ein wasserlösliches Salz. 15
3. Aceton liegt nicht geladen vor. 16
4. Harnstoff liegt im Wasser praktisch ungeladen vor. 17
5. Dihydrogencarbonat liegt im Wasser dissoziiert und geladen vor. 18
Da Aceton und Harnstoff in Wasser ungeladen vorliegen, führen beide Verunreinigungen zu keiner deutlichen Änderung des relativen Leitwerts.19
Grenzionenäquivalentleitfähigkeit
Warum ist die Grenzionenäquivalentleitfähigkeit von ⚠ $H_{3}O^{+}$ und ⚠ $OH^{-}$ deutlich höher als bei anderen Ionen?
- Weil diese im Wasser den stärksten Einfluss auf den pH-Wert aufweisen.
- Dies liegt an der geringen Ladungszahl der Ionen.
- Weil diese am besten mit anderen Ionen wechselwirken.
- Weil es zur Ausbildung einer Solvathülle kommt, und somit mehr Ionen transportiert werden können.
- Diese reichen die Ladung direkt weiter, ohne zu wandern.
Antwort E ist korrekt
A.: Der Einfluss der Ionen auf den pH-Wert hat keinen Einfluss auf die Grenzleitfähigkeit. Die starke Verdünnung, die zur zuverlässigen konduktometrischen Indikation benötigt wird, lässt keine starke Abweichung vom pH-Wert 7 zu, was auch darauf hindeutet, dass diese keinen Einfluss nehmen kann.20
B.: Auch andere Ionen haben die gleiche Ladungszahl (z*=1) wie ⚠ $H_{3}O^{+}$ und ⚠ $OH^{-}$, dafür aber eine deutlich geringere Grenzleitfähigkeit (z.B. ⚠ $Li^{+}$=38,7; ⚠ $H_{3}O^{+}$= 349,8).21
C.: Die Wechselwirkung verschlechtert die Grenzionenleitfähigkeit. Deswegen setzt man stark verdünnte Lösungen ein.22
D.: Die Solvathülle verschlechtert die Grenzionenleitfähigkeit. Diese entsteht bei ⚠ $H_{3}O^{+}$ und ⚠ $OH^{-}$ nicht.23
E.: Diesen Vorgang nennt man Tunneleffekt.24
Textaufgaben
Konduktometrisches Rechnen
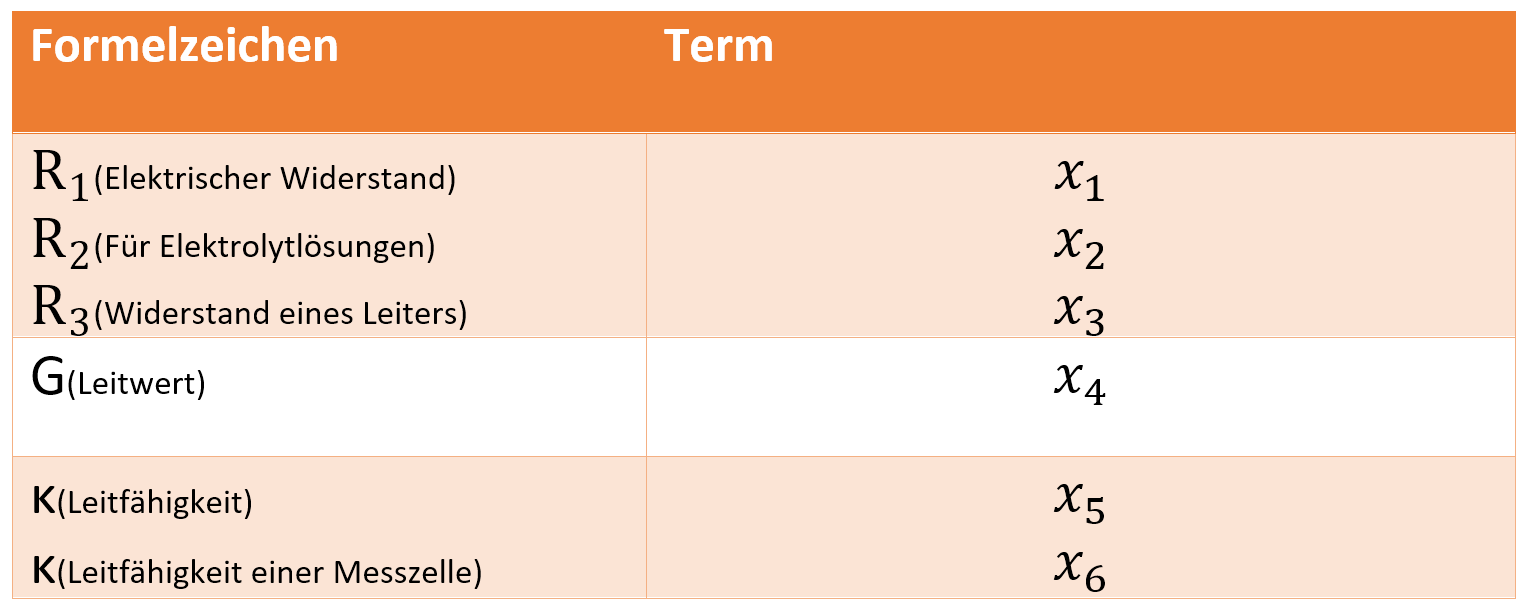
- Ergänzen Sie die obige Tabelle mit den korrekten Termen von
⚠ $ x_{1} $-⚠ $ x_{6} $!
⚠ $ x_1 = \frac{U}{I}\ $
⚠ $ x_2= \frac{U-U_P}{I}\ $
⚠ $ x_3=ρ \cdot \left(\frac{L}{S}\right) $
⚠ $ x_4=\frac{1}{R}\ $
⚠ $ x_5=\frac{1}{ρ}\ $
⚠ $ x_6=G \cdot K_{Zelle} $
⚠ $ K_{Zelle}= \frac{L(Länge)}{S(Querschnitt)}\ $ 26
- Es wurde eine konduktometrische Titration von 100mL Salzsäure unbekannter Konzentration mit Natronlauge durchgeführt. Bestimmen Sie die Massenkonzentration der Salzsäure. Gegeben: c(NaOH) = 0,5mol/L, f(NaOH) = 1,026, M(HCl) = 36,4g/mol. Der Verbrauch an Maßlösung beträgt 1,430 mL. Eignet sich die Konduktometrie auch zur qualitativen Bestimmung?
26,7 mg/100mL.
Es gilt:
⚠ $ ß(HCl) = V(NaOH) \cdot c(NaOH) \cdot f(NaOH) \cdot M(HCl) $
⚠ $ ß(HCl) = 1,430 mL \cdot 0,5 mol/L \cdot 1,026 \cdot 36,4 g/mol = 26,7 mg/100mL $
Nein, da die Leitfähigkeit von mehreren Faktoren abhängt, die zum Teil nicht ionenspezifisch sind (Konzentration, Ladung, Beweglichkeit).27
- Die Leitfähigkeit k einer Substanz soll bestimmt werden. Die Messzelle weicht jedoch vom Ideal ab. Ein Platinblech hat eine Oberfläche von 5cm² und ist vom anderen 1,2cm entfernt. Der Widerstand beträgt 3Ω. Kann bei der Messung mit Gleichspannung gearbeitet werden?
⚠ $ k = G \cdot K_{Zelle} = \frac{1}{R}\ \cdot \frac{L}{S}\ $
⚠ $ k= \frac{1}{3Ω}\ \cdot \frac{1,2cm}{2 \cdot 5cm^{2}}\ = 0,04 \frac{1}{Ω \cdot cm}\ = 0,04 \frac{S}{cm}\ $
Gleichspannung sollte hier nicht verwendet werden, da es sonst zur Ausbildung der unerwünschten Polarisation kommt. 28
- Was wird bei der Grenzionenäquivalentleifähigkeit im Gegensatz zur Grenzleitfähigkeit berücksichtigt? Warum geht man von einer unendlichen Verdünnung aus (ideale Lösung)?
Bei der Grenzionenäquivalentleitfähigkeit ist berücksichtigt, dass Ionen unterschiedlich hohe Ladungszahlen haben. Zur besseren Vergleichbarkeit, sind alle mit der Ladungszahl +/- 1 angegeben. Bei einer idealen Lösung mit unendlicher Verdünnung geht man davon aus, dass zwischen den Ionen keine Wechselwirkungen stattfinden können.29
Simultanbestimmung von Essigsäure und Salzsäure
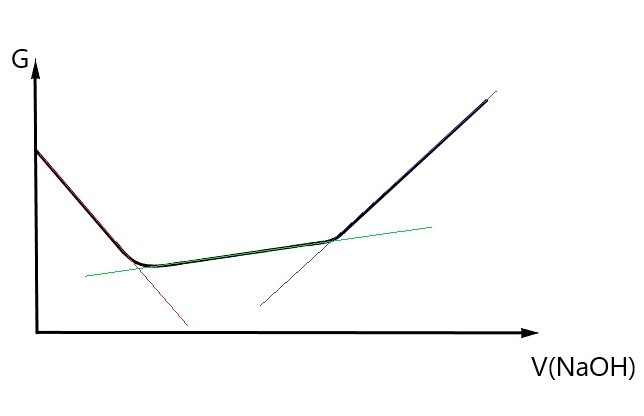
Im Folgenden soll eine bereits ausgewertete Titrationskurve untersucht werden. Titriert wurde mit NaOH-Maßlösung.
Beantworten Sie hierzu folgende Fragestellungen:
- Welche chemischen Reaktionen laufen bei dieser Titration ab? Ordnen Sie diese den Äquivalenzpunkten zu (stöchiometrisch vollständige Gleichung).
Ausgangsstoffe: ⚠ $ HCl, CH_{3}COOH, NaOH $
Bis zum 1.ÄP: ⚠ $ HCl + NaOH → NaCl + H_{2}O $
Bis zum 2.ÄP: ⚠ $ CH_{3}COOH + NaOH → CH_{3}COONa + H_{2}O $
31
- Was für ein Messgerät kam zur Erfassung der Werte zum Einsatz?
Ein Konduktometer mit Leitfähigkeitsmesszelle, bestehend aus zwei planparallelen platinierten Platinblechen. 32
- Beschreiben Sie das bei der Abbildung verwendete mathematische Verfahren, mit dem der Verbrauch an Maßlösung an den Äquivalenzpunkten bestimmt wurde. Nennen Sie außerdem eine weitere Möglichkeit zur Bestimmung des Maßlösungsverbrauchs und erläutern Sie diese. Vergleichen Sie anschließend die Genauigkeit der beiden Verfahren.
In diesem Beispiel wurde der Maßlösungsverbrauch mithilfe von Ausgleichsgeraden berechnet, die durch ein Tabellenkalkulationsprogramm (Excel, Numbers, LibreOffice Calc) dargestellt wurden. Dadurch ergaben sich insgesamt drei Ausgleichsgeraden, von denen durch entsprechende Gleichsetzung die Schnittpunkte berechnet werden konnten. Eine weitere Möglichkeit ist die händische/grafische Bestimmung des Maßlösungverbrauchs. Hierbei werden die Äquivalenzpunkte, welche sich aus dem Kurvenverlauf ergeben, per Hand bestimmt, indem durch alle Werte, die jeweils nach Augenmaß eine Gerade ergeben, ein Strich gezogen wird. Insgesamt ergeben sich im obigen Beispiel somit drei Striche, welche das Pendant zu den Ausgleichsgeraden der Tabellenkalkulationsprogramme bilden. An den Schnittpunkten dieser Striche/Geraden werden dann Lote zur x-Achse gefällt. Die dabei entstehenden Schnittpunkte mit der x-Achse geben den Maßlösungsverbrauch am jeweiligen Äquivalenzpunkt an. Von den beiden genannten Verfahren ist die händische Methode, bei der ein Lot gefällt wird, am fehleranfälligsten und somit auch am ungenauesten. Das Verfahren der Ausgleichsgeraden ist von den Möglichkeiten die wohl effizienteste, sowohl was Genauigkeit als auch Bequemlichkeit/Schnelligkeit angeht. 33
- Beurteilen Sie abschließend die beiden Äquivalenzpunkte. Was beschreibt der erste und was beschreibt der zweite Äquivalenzpunkt? Mithilfe welcher Gleichungen erfolgen die Berechnungen der jeweiligen Massenkonzentrationen? Erklären Sie außerdem was aus den Berechnungen geschlussfolgert werden kann und wofür sich die Konduktometrie demnach besonders gut eignet.
Bei dem ersten Äquivalenzpunkt wurde wie in der Reaktionsgleichung (siehe a) HCl komplett zu NaCl umgesetzt, dadurch wird hier der Verbrauch an Maßlösung für die Salzsäure dargestellt. Bei dem zweiten Äquivalenzpunkt wurde ⚠ $CH_{3}COOH$ komplett zu ⚠ $CH_{3}COONa$ umgesetzt, weshalb hier der Verbrauch an Maßlösung für die Essigsäure beschrieben wird. Da zuerst die stärkere Säure titriert wurde und somit keine parallele Umsetzung von HCl und ⚠ $CH_{3}COOH$ statt fand, ist zu beachten, dass lediglich die Differenz an Maßlösungsverbrauch zwischen dem ersten und zweiten Äquivalenzpunkt dem Verbrauch an NaOH für die Essigsäure entspricht.
34
⚠ $ ß(HCl)=V(NaOH,1.ÄP) \cdot c(NaOH) \cdot M(HCl) \cdot f(NaOH) \cdot f(Verd.) $
⚠ $ ß(CH_{3}COOH)=[V(NaOH, 2.ÄP)-V(NaOH,1.ÄP)] \cdot c(NaOH) \cdot M(CH_{3}COOH) \cdot f(NaOH) \cdot f(Verd.) $
Nach den Berechnungen kann man darüber Auskunft geben, wieviel mg Substanz an HCl und an ⚠ $CH_{3}COOH$ sich in 100ml Analysenlösung befinden. Dadurch ist die Konduktometrie ein Verfahren, welches sich besonders gut zur Quantifizierung von Substanzen eignet, bei dem die Ausgangsstoffe bereits bekannt sind. Mögliche Einsatzgebiete sind außerdem auch Reinheitsprüfungen auf ionische Verunreinigungen von Wasser für den pharmazeutischen Gebrauch, als Detektor bei der Hochleistungsflüssigkeitschromatographie(HPLC) und das Bestimmen der Titrationsendpunkte von: Säure-, Base-, Fällungs- und komplexometrischen Titrationen. 35
Einzelnachweise
1 Eigene Abbildung. Siarhei Nishchyk,2022 ⇑
2 vgl. S.6 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
3 Eigene Abbildung. Siarhei Nishchyk,2022 ⇑
4 vgl. S.643 Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; ⇑
5 vgl. S.645 Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; ⇑
6 vgl. S.644-645 Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; ⇑
7 vgl. S.644-645 Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; ⇑
8 vgl. S.644 Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; ⇑
9 vgl. S.11 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
10 vgl. S.9 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
11 vgl. S.11 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
12 vgl. S.11 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
13 vgl. S.8-11 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
14 vgl. S.642 Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; ⇑
15 vgl. S.642 Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; ⇑
16 vgl. S.642 Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; ⇑
17 vgl. S.642 Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; ⇑
18 vgl. S.642 Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; ⇑
19 vgl. S.642 Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; ⇑
20 vgl. S.14-16 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
21 vgl. S.16 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
22 vgl. S.16 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
23 vgl. S.16 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
24 vgl. S.16 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
25 Eigene Abbildung. Sebastian John,2022 ⇑
26 vgl.S.8-17 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
27 vgl. S.638 Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; ⇑
28 vgl. S.11,17 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
29 vgl.S.15-16 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
30 Eigene Abbildung. Jonas Schneider,2022 ⇑
31 vgl. S.3 Skript: Praktikumseinführung Elektrochemie, Dr. Oliver Orban ⇑
32 vgl. S.17 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑
33 vgl.S.21 Praktikumsskript: Instrumentelle Analytik, Dr. Thomas Kellner ⇑
34 vgl. S.642-647 Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; ⇑
35 vgl.S.20 Skript: Einführung in die Instrumentelle Analytik, Dr. Oliver Orban ⇑