Kernresonanzspektroskopie
Übung
Kernresonanzspektroskopie
SoSe 2022
Abgabedatum
30.05.2022
Expertengruppe 02
Lisa-Marie Hedderich
Mareike Ellmann
Jana Hölscher
Lara Kiese
Inhaltsverzeichnis
Alle Lösungen sind eingeblendet. Alle Lösungen ausblenden
Multiple Choice (MC) Fragen
Elemente
Welche Isotope sind nicht NMR-aktiv?
- 2D
- 6Li
- 13C
- 32S
- 2 und 4
- nur 4
- 1, 2 und 4
- 1, 2 und 3
- alle
Antwort B ist korrekt!
Atome mit gerader Ordnungs- und Massenzahl sind nicht NMR-aktiv und weisen somit keinen Kernspin auf.
2D: OZ=1, MZ=2, K=1
6Li: OZ=3, MZ=6, K=1
13C: OZ=6, MZ=13, K=1/2
32S: OZ=16, MZ=32, K=0 1
Vergleich 1H-NMR- und 13C-NMR-Spektroskopie
Welche Aussage trifft nicht zu?
- Die 13C-NMR-Spektroskopie ist empfindlicher.
- Als Standard wird Tetramethylsilan (TMS) verwendet.
- Bei der 13C-NMR-Spektroskopie ist die Signalintensität nicht auswertbar.
- Bei der 1H-NMR- und 13C-NMR-Spektroskopie kann man die chemische Verschiebung berechnen.
- Bei der 1H-NMR-Spektroskopie kann man eine Kopplungskonstante berechnen.
Antwort A ist falsch!
A) Die 1H-NMR-Spektroskopie ist empfindlicher, da die natürliche Häufigkeit des Isotops 99,985% beträgt. Bei der 13C-NMR-Spektroskopie werden nur 1,1 % aller Kohlenstoffatome erfasst, da ein kleineres gyromagnetisches Verhältnis herrscht.
B) Als Nullpunkt wird immer die chemische Verschiebung vom Tetramethylsilan (TMS) verwendet.
C) Jeder Kohlenstoffkern hat im Spektrum ein Singulett.
D) Als chemische Verschiebung δ bezeichnet man den Abstand eines Peaks der Probe (Frequenz der Probe) von der Resonanzlinie eines Standards (Frequenz des Standards), welchem die chemische Verschiebung 0 zugewiesen wird. Dies wird in ppm angegeben. 2
E) Bei 1H-NMR-Spektroskopie treten zahlreiche homonukleare Kopplungen auf. Bei der 13C-NMR-Spektroskopie gibt es kein Aufspaltungsmuster.
Aufspaltungsmuster
Welche Aufspaltungsmuster ergeben sich aus Ibuprofen?
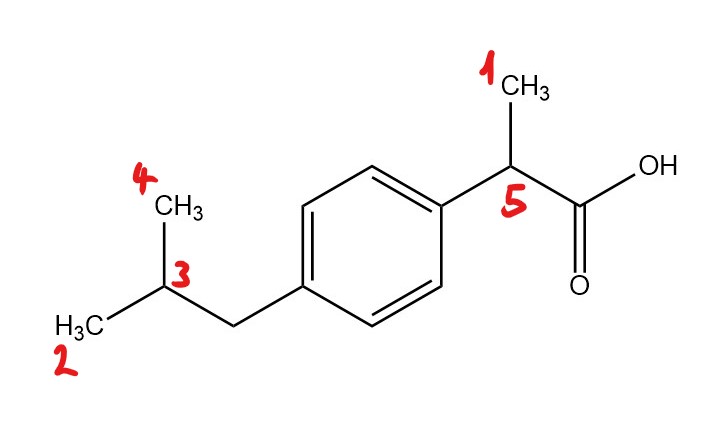
Abbildung 1: Ibuprofen 4
- 1:s, 2:q , 3:d, 4:t, 5:d
- 1:t, 2:t, 3:d, 4:d, 5:d
- 1d:, 3:sept., 2/4:d, 5:q
- 1:d, 2:q, 3:d, 4:t, 5:q
- 1:d, 2/3:d, 4:sept, 5:t
Antwort C ist korrekt!
Bei der Kopplung zwischen den H-Atomen bei 2, 3 und 4 kann man die Formel n+1 anwenden. Dadurch weist Ibuprofen als Aufspaltungsmuster ein Dublett und ein Septett auf. Dies entsteht durch die Äquivalente der H-Atome der beiden Methyl-Gruppen (2 und 4). Diese verhalten sich wie 6 H-Atome und sind dadurch sehr intensiv. Bei den H-Atomen bei 1 findet eine Kopplung mit der Methyl-Gruppe (5) statt. Deshalb entsteht hier als Aufspaltungsmuster ein Quadruplett und ein Dublett. Es gilt somit wieder die n+1-Regel. 5
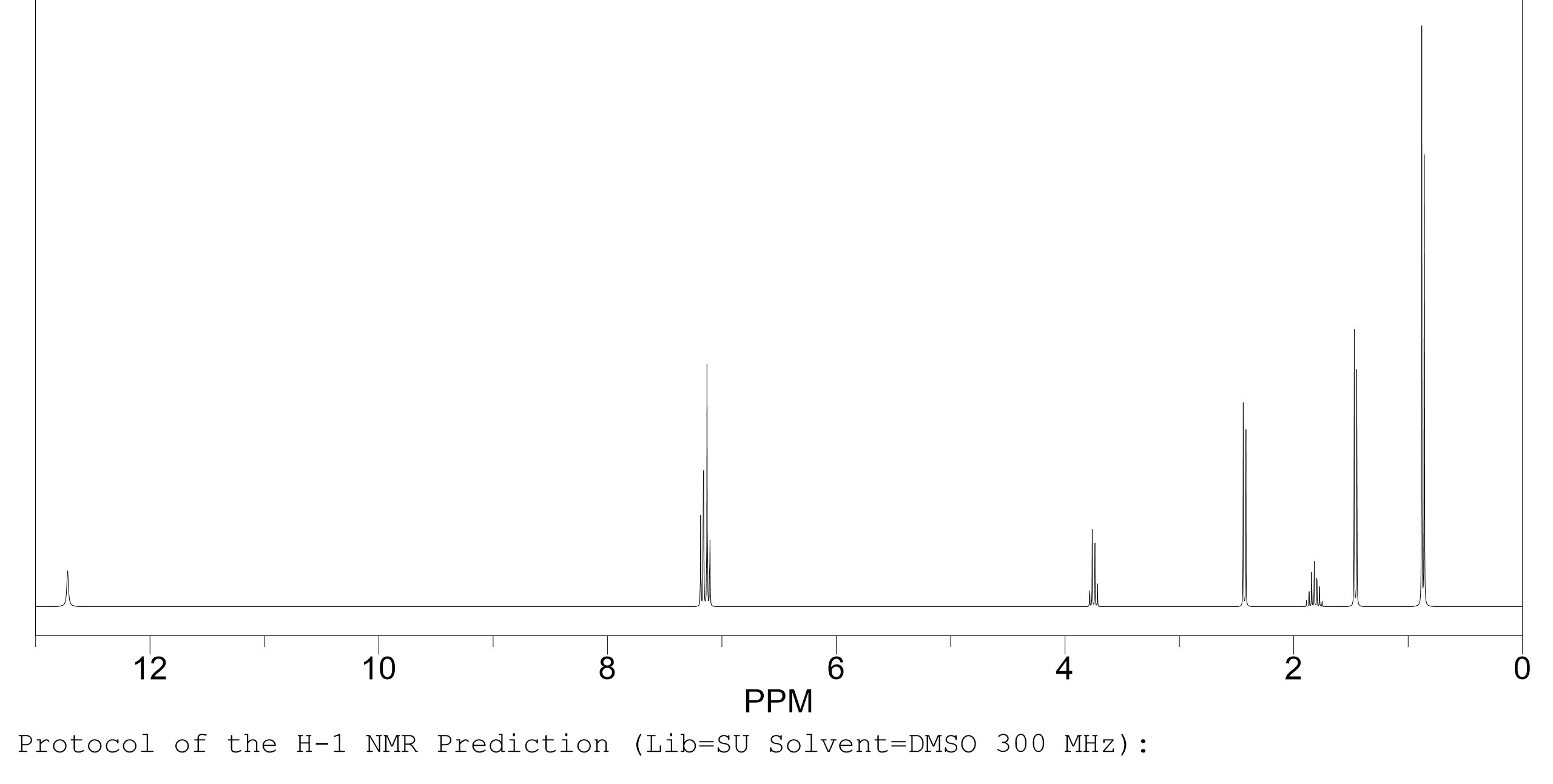
NMR-Spektrum Ibuprofen 6
Aufbau
Welche Aussagen zum Aufbau eines Kernresonanzspektrometers treffen zu?
- Ein Kernresonanzspektrometer besteht aus einem Hochfrequenzsender, Spulen, einer Messeinrichtung und einem homogenen Magnetfeld, welches von einem Magneten erzeugt wird.
- Die Sendespule steht parallel zum äußeren Magnetfeld und zu den magnetischen Momenten aller Kerne.
- Die Empfängerspule steht senkrecht zur Senderspule und zum Magnetfeld.
- Die Probelösung befindet sich in einem Glasrohr, welches außerhalb des Magnetfeldes liegt.
- 1 und 2
- 1, 2 und 3
- 1 und 3
- 1, 3 und 4
- alle
Antwort C ist korrekt!
1: Das Kernresonanzspektrometer besteht aus den genannten Komponenten.
2: Die Sendespule muss senkrecht zum äußeren Magnetfeld stehen, damit eine Quermagnetisierung der Kerne anregen kann.
3: Die Empfängerspule steht senkrecht zur Sendespule und zum Magnetfeld, damit die Spule durch die Einstrahlung von Resonanzenergie auftretende Quermagnetisierung der Kerne aufnehmen kann. Der Feldvektor der Atome dreht sich um 90°, daher ist in dieser Position die Empfängerspule angebracht.
4: Die Probelösung muss in dem Magnetfeld liegen, damit überhaupt Kernresonanz gemessen werden kann. 7
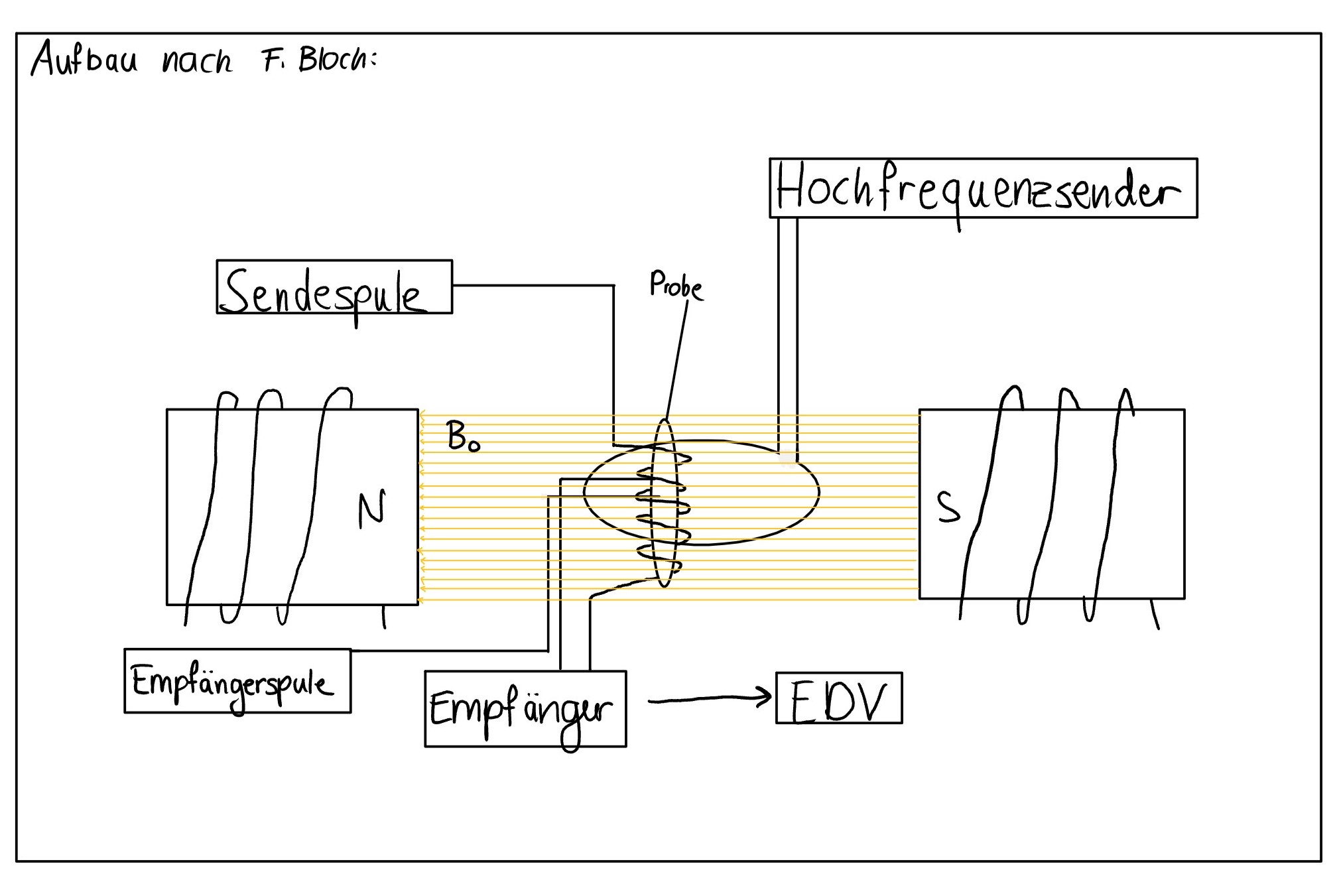
Abbildung 2: Aufbau eines Kernresonanzspektrometers8
Chemische Verschiebung
Wo liegen die chemischen Verschiebungen des vorliegenden Moleküls?
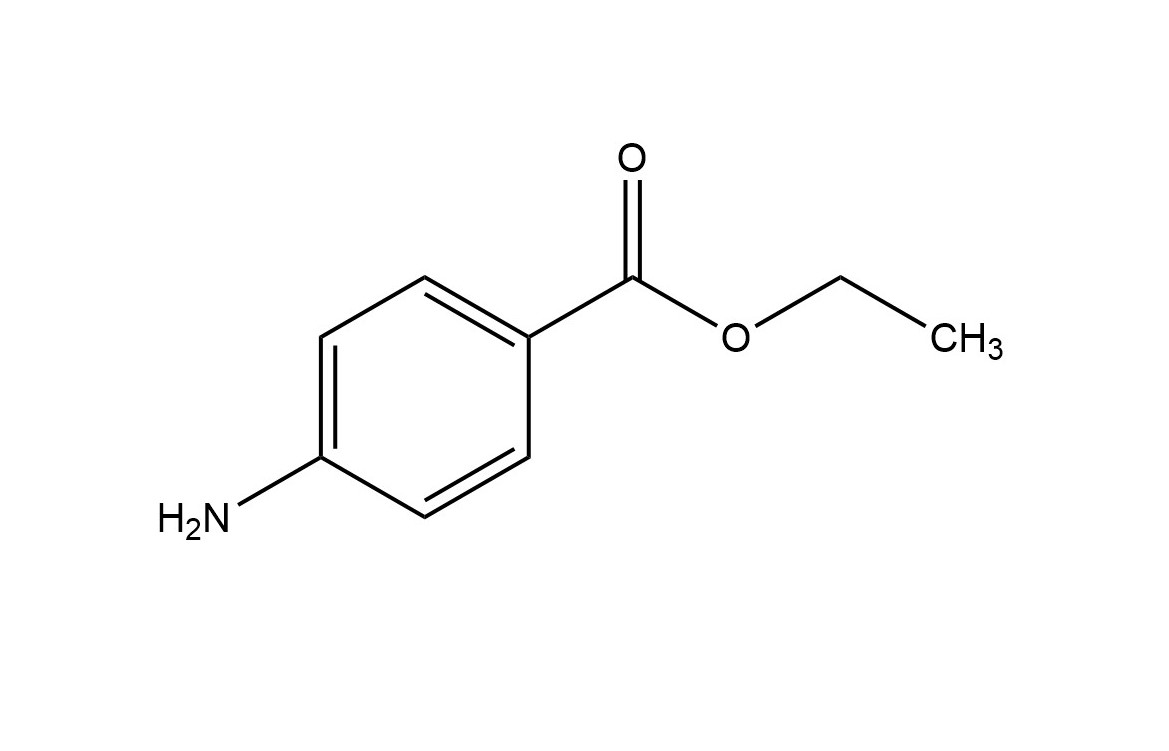
Abbildung 2: Benzocain9
- Dacheffekt bei ca. 6ppm
- Singulett als komplexes Multiplett bei 6ppm
- Aufspaltungsmuster (3:4) bei 0-2ppm
- Aufspaltungsmuster (3:2) bei 2-4 ppm
- 1 und 3
- 1,2 und 4
- 2 und 4
- 2,3 und 4
- alle
Antwort A ist korrekt!
1: Der Dacheffekt kommt bei 1,4 substituierten Aromaten vor. Zudem liegt das Signal eines Aromaten bei ungefähr 6 ppm. 10
2: Da es sich hier um einen mehrfach substituierten Aromaten handelt, entsteht kein Singulett.
3: Bei der Kopplung von CH2 und CH3 entsteht durch die n+1 Regel ein Triplett und ein Quartett. Zudem liegen Alkane bei 0-2ppm.
4: Es kommt zu keiner weiteren Kopplung. 11
Textaufgaben
Kopplung
Im Folgenden ist ein NMR-Spektrum dargestellt, welches bei einer Messfrequenz von 400 MHz vermessen wurde.
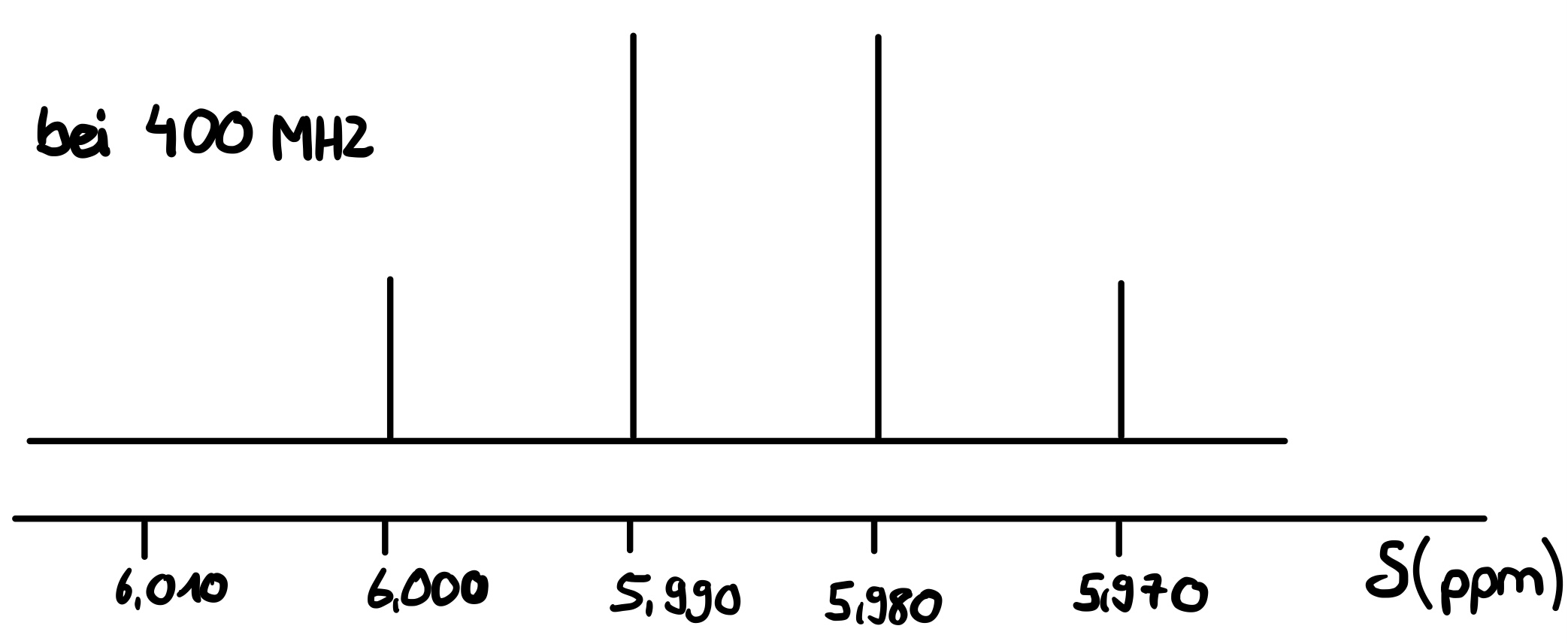
Abbildung 3: Strichspektrum12
- Wieviel Hz entspricht bei dieser Messung 1 ppm?
1ppm entspricht 400 Hz
ppm steht für parts per million, wodurch eine Skaleneinheit 1/Million entspricht. Somit entspricht 1ppm 400 Hz.
- Berechnen Sie die Kopplungskonstante des oben abgebildeten Strichspektrums.
Die Kopplungskonstante entspricht 4 Hz.
Der Abstand zwischen den Peaks entspricht 0,01 ppm. Da 1 ppm 400 Hz entspricht, entsprechen 0,01 ppm 4 Hz.
- Zeichnen Sie ein Beispielspektrum einer vicinalen CH3 und einer CH2 Gruppen, welche miteinander koppeln.
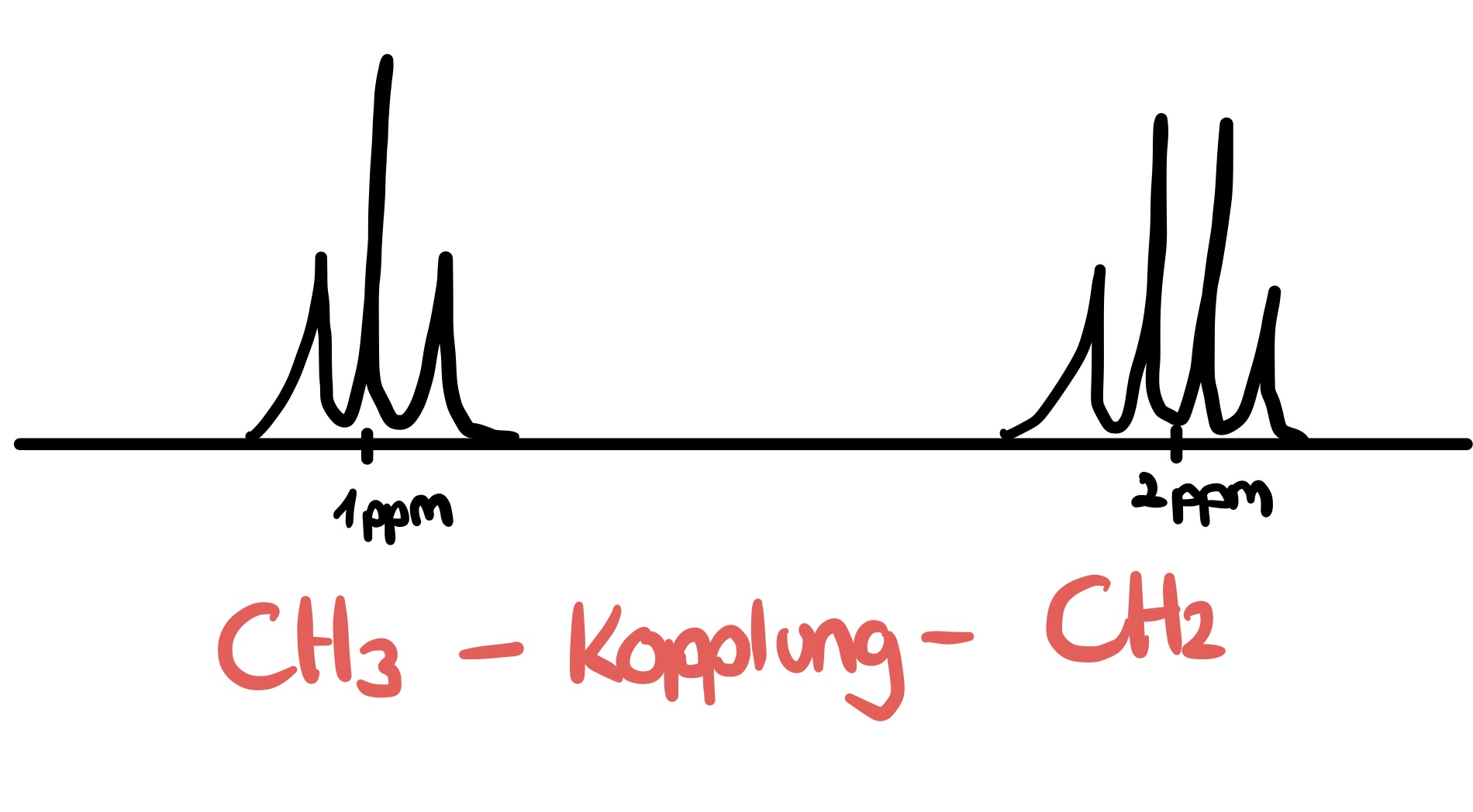
Abbildung 4: Beispielspektrum einer vicinalen CH3 und einer CH2 Gruppe13
Die Kopplungskonstante (J) gibt den Linienabstand zwischen einer Spin-Spin-Kopplung an und wird in Hz angegeben. 14
- Warum kommt es zu der Entstehung eines Dubletts, Tripletts oder Quadruplett? Was sagt die Kopplungskonstante aus?
Der Kernspin eines Wasserstoffatoms, und somit auch das daraus resultierende Magnetfeld, kann zwei Richtungen aufweisen. Das eine Magnetfeld ist dem äußeren Magnetfeld entgegengesetzt und das andere Magnetfeld ist dem äußeren Magnetfeld gleichgerichtet. Sind die Magnetfelder dem äußeren Magnetfeld entgegengesetzt kommt es zur Abschwächung des äußeren Magnetfeldes. Sind die Magnetfelder gleichgerichtet, kommt es zur Verstärkung des äußeren Magnetfeldes. Diese Beeinflussung des Magnetfeldes beeinflusst auch die benachbarten H-Atome.15 Diese Wasserstoffatome zeigen eine Signalaufspaltung, die sich auf die Kopplung zu anderen Wasserstoffkernen zurückführen lässt.16
Chemische Verschiebung
- Was versteht man unter dem Anisotropieeffekt und wo tritt dieser insbesondere auf?
Anisotropie bezeichnet den Effekt, der besagt, dass der Einfluss von chemischen Bedingungen (z.B.: pH) auf die chemische Verschiebung benachbarter Atome nicht in alle Richtungen gleich groß ist. Dieser Effekt tritt insbesondere an C-C-Doppelbindungen, Aromaten, sowie Carbonyl-Verbindungen auf. Am Aromaten wird ober- und unterhalb des Rings ein Magnetfeld erzeugt, welches dem äußeren Magnetfeld entgegengerichtet ist (Abschirmkegel). Es kommt daher zur Abschirmung, weshalb die Signale gebundener Gruppen ins hohe Feld verschoben sind. Außerhalb des Abschirmkegels, also in einer Ebene mit den Aromaten, ist das erzeugte Magnetfeld dem Äußeren gleichgerichtet. Infolgedessen kommt es zur Entschirmung, weshalb Signale der gebundenen Gruppen ins tiefe Feld verschoben sind. 17 18
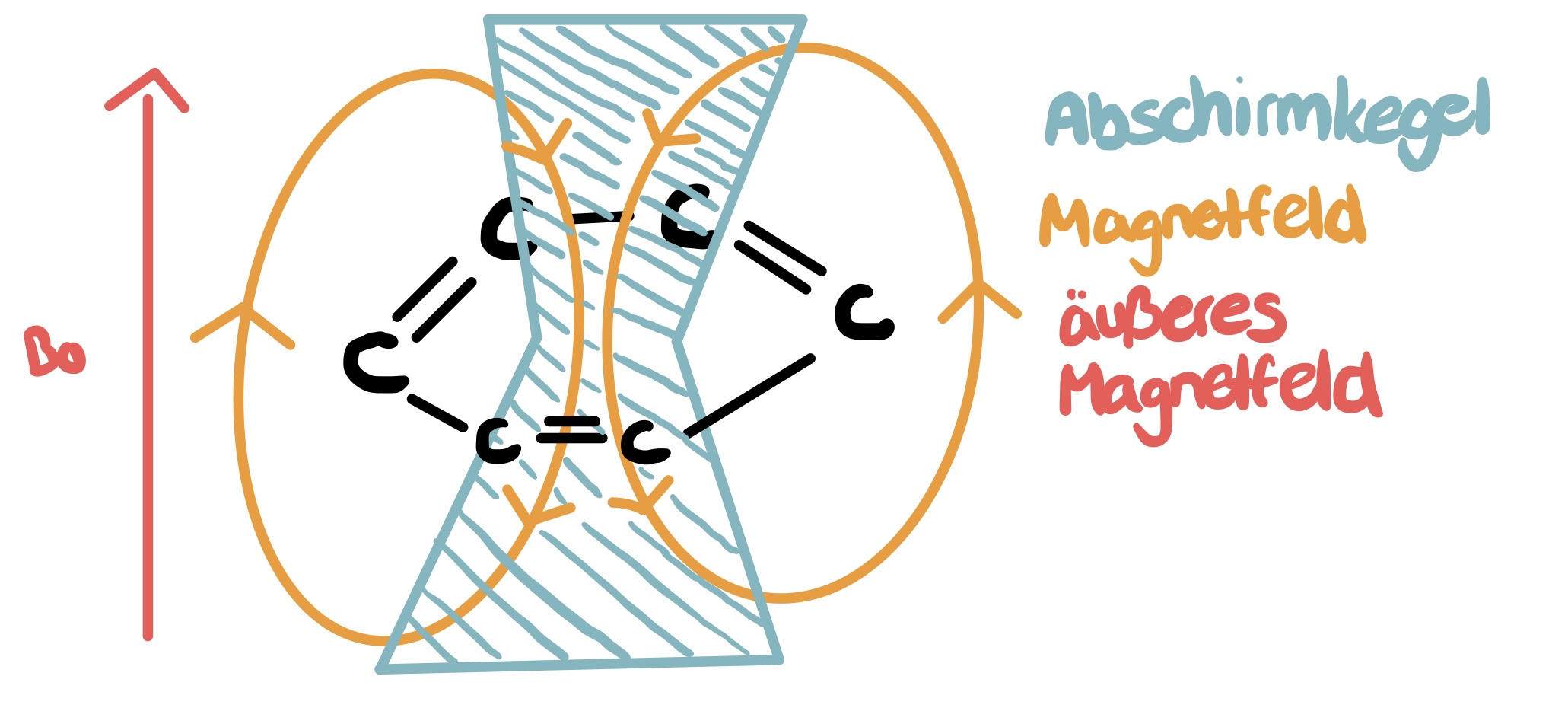
Abbildung 5: Anisotropieeffekt19
- Welche Atome in der Nachbarschaft führen bedingt durch den induktiven Effekt zur Entschirmung? Nennen Sie Beispiele!
Elektronegative Heteroatome in der Nachbarschaft von Wasserstoffkernen verringern dort die Elektronendichte, wodurch es zur Entschirmung kommt. Dadurch wird das Signal in den höheren ppm-Bereich verschoben. Dies bezeichnet man dann als Tieffeldverschiebung. Beispiele dafür sind: Cl, Br, O, S, N. 20
- Wie verschiebt sich das Signal, wenn das Molekül eine Hydroxygruppe enthält?
Die Hydroxygruppe hat ein freies Elektronenpaar und übt damit einen +M-Effekt aus. Dadurch wird die Elektronendichte der Wasserstoffkerne in der Nachbarschaft erhöht. Dies führt zu einer Abschirmung und damit zu einer niedrigeren Resonanzfrequenz (Hochfeldverschiebung). 21
- Wieso liegt die chemische Verschiebung einer Carbonsäure weit im tiefen Feld (ca. 12 ppm)?
Dies geschieht durch den starken Elektronenzug der Sauerstoffatome und der vorhandenen Doppelbindungen. 22
Einzelnachweise
1 vgl. https://www.internetchemie.info/chemie-lexikon/daten/n/nmr%20aktive%20kerne.php Stand:23.05.2022 17:02 Uhr ⇑
2 vgl. https://www.chemie.de/lexikon/Chemische_Verschiebung.html Stand:23.05.2022 17:02 Uhr ⇑
3 vgl. Dominik, Steinhilber, Wurglics(2013): Instrumentelle Analytik kompakt 3.Auflage, Wissenschaftliche Verlagsgesellschaft, Stuttgart; S. 160 ⇑
4 Eigene Zeichnung von Mareike Ellmann mit chemDraw, 15.06.2022 ⇑
5 vgl. Skript zum Seminar von Dr. Oliver Orban: NMR, Sommersemester 2022: Signalaufspaltung Seite 44 ⇑
6 Erstellt von Mareike Ellmann mit chemDraw, am 15.06.2022 ⇑
7 vgl. Rücker,G., Neugebauer, M.&Willems, G.G.(2013): Instrumentelle Pharmazeutische Analytik:5. überarbeitete Auflage. Stuttgart, Germany: Wissenschaftliche Verlagsgesellschaft Stuttgart. Seite 247 ⇑
8 Eigene Zeichnung von Mareike Ellmann mit oneNote, inspiriert vom NMR-Skript S.21, 15.06.2022 ⇑
9 Eigene Zeichnung von Mareike Ellmann mit chemDraw, 15.06.2022 ⇑
10 vgl. Skript zum Seminar von Dr. Oliver Orban: NMR, Sommersemester 2022: Kopplungsmuster an Aromaten Seite 54 ⇑
11 vgl. Skript zum Seminar von Dr. Oliver Orban: NMR, Sommersemester 2022: Chemische Verschiebung Seite 38 ⇑
12 Eigene Zeichnung, von Lara Kiese mit GoodNotes, am 15.06.2022 ⇑
13 Eigene Zeichnung von Lara Kiese mit GoodNotes, am 15.06.2022 ⇑
14 vgl. Skript zum Seminar von Dr. Oliver Orban: NMR, Sommersemester 2022: Spin-Spin-Kopplung Seite 43 ⇑
15 vgl. Skript zum Seminar von Dr. Oliver Orban: NMR, Sommersemester 2022: Spin-Spin-Kopplung/Signalaufspaltung Seite 44 ⇑
16 vgl. Skript zum Seminar von Dr. Oliver Orban: NMR, Sommersemester 2022: Spin-Spin-Kopplung Seite 43 ⇑
17 vgl. Skript zum Seminar von Dr. Oliver Orban: NMR- 2, Sommersemester 2022: Chemische Verschiebung Seite 11 ⇑
18 vgl. Dominik, Steinhilber, Wurglics(2013): Instrumentelle Analytik kompakt 3.Auflage, Wissenschaftliche Verlagsgesellschaft, Stuttgart; S. 146 ⇑
19 Eigene Zeichnung von Lara Kiese mit GoodNotes, am 15.06.2022 ⇑
20 vgl. Skript zum Seminar von Dr. Oliver Orban: NMR- 2, Sommersemester 2022: Chemische Verschiebung Seite 9 ⇑
21 vgl. Skript zum Seminar von Dr. Oliver Orban: NMR- 2, Sommersemester 2022: Chemische Verschiebung Seite 12 ⇑
22 vgl. Skript zum Seminar von Dr. Oliver Orban: NMR, Sommersemester 2022: Chemische Verschiebung Seite 39 ⇑

