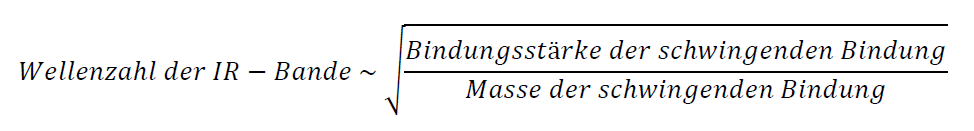Infrarot-Spektroskopie
Übung
IR-Spektroskopie
SoSe 2022
Abgabedatum
20.06.2022
Expertengruppe 01
Carina Busse
Chelsea Jones
Zara Khalil
Sandra Holtmüller
Inhaltsverzeichnis
Multiple Choice (MC) Fragen
IR-Spektroskopie
Welche Aussage ist richtig? Bei der MIR - Spektroskopie...
- kommt es zur Anregung von Oberschwingungen.
- können polymorphe Substanzen eine Verunreinigung vortäuschen.
- wird die Transflexion gemessen.
- stört Wasser die Messung nicht.
- sind Stoffe mit einer Änderung der Polarisierbarkeit IR-aktiv.
Antwort B ist korrekt.
- Bei der NIR-Spektroskopie kommt es zur Anregung von Oberschwingungen.
- Polymorphe Substanzen unterscheiden sich untereinander deutlich im Fingerprintbereich. Dies kann wie eine Verunreinigung aussehen.
- Bei der NIR-Spektroskopie misst man unter anderem die Transflexion, während bei der MIR-Spektroskopie die Transmission gemessen wird.
- Durch Wasser in der Probe entstehen sogenannte Wasserbanden, die andere wichtige Banden überdecken können.
- Stoffe sind bei einer Änderung der Polarisierbarkeit Raman-aktiv und bei einer Änderung des Dipolmoments IR-aktiv.
Molekülschwingungen
Welche Aussage über Molekülschwingungen ist falsch?
- Dem Hook‘schen Gesetz nach ist die Kraftkonstante k ein Maß für die Stärke der chemischen Bindung zwischen den Atomen.
- Die Schwingungsfrequenz ist umso größer, je fester die jeweilige Bindung ist.
- Die Schwingungsfrequenz ist umso kleiner, je kleiner die Massen der schwingenden Atome sind.
- Bei vergleichbaren Massen schwingender Atome liegen die Anregungsenergien für Valenzschwingungen bei größeren Wellenzahlen als für Deformationsschwingungen.
- Ein Molekül kann nur dann IR-Strahlung absorbieren, wenn der Übergang in ein höheres Schwingungsniveau mit einer Änderung seines elektrischen Dipolmomentes verbunden ist.
Antwort C ist korrekt.
Das Hook`sche Gesetz lautet: K = -k * x
- K = rücktreibende Kraftk = Kraftkonstantex = Auslenkung zur Zeit t
Die Schwingungsfrequenz lässt sich durch folgenden Zusammenhang beschreiben:
Die Schwingungsfrequenz ist also umso kleiner, je größer die Massen der schwingenden Atome sind. Sie führen also zu Absorptionsbanden bei kleinen Wellenzahlen.
5
6
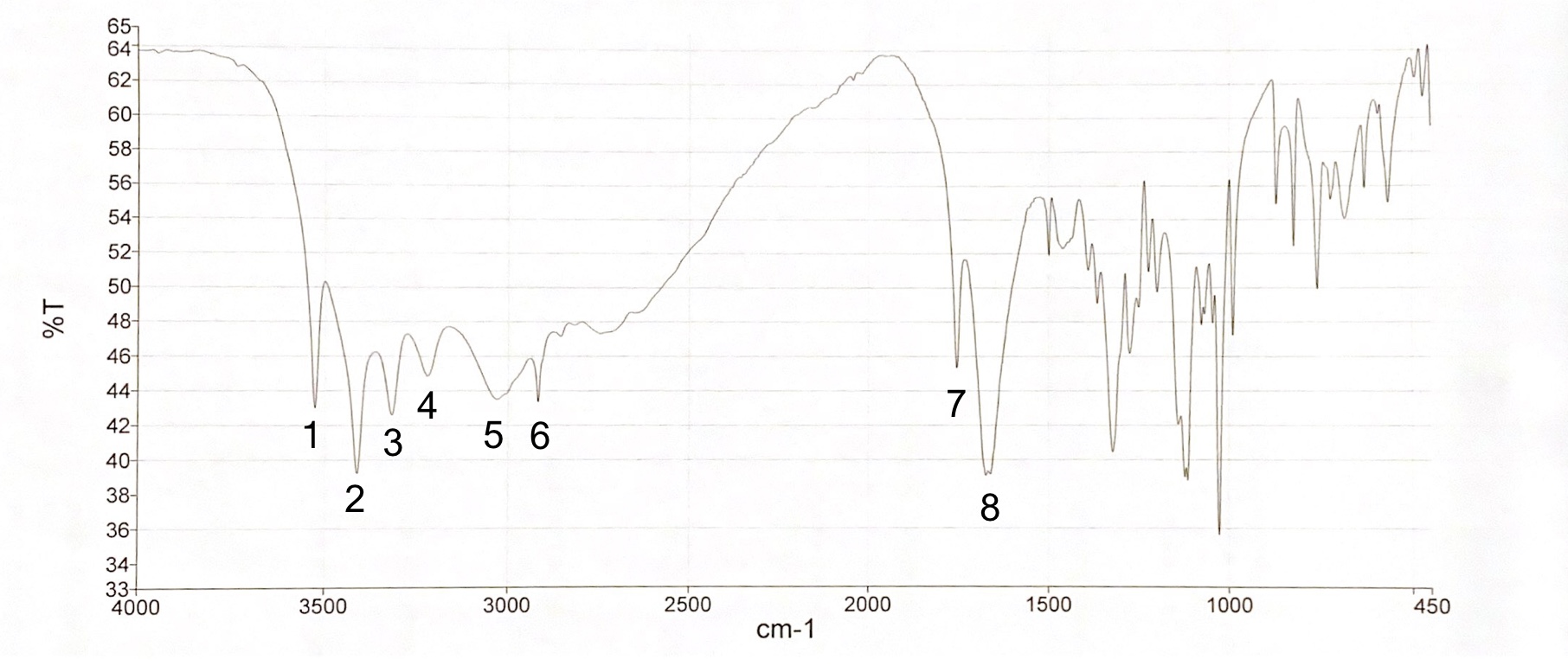
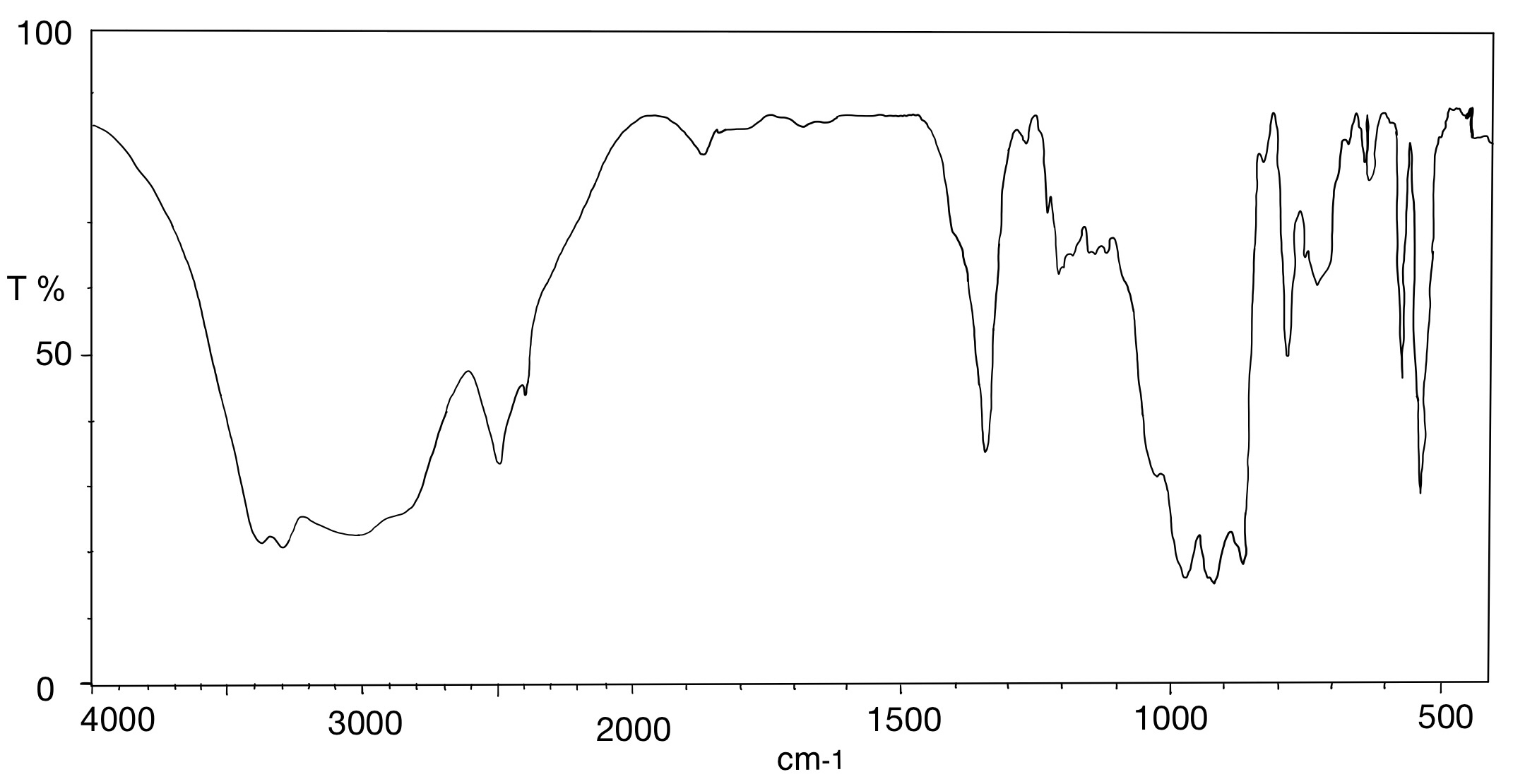
IR-Spektrum von Ascorbinsäure
Abgebildet ist das IR-Spektrum von Ascorbinsäure. Welche Aussagen treffen zu?
- Die Bande 1 ist auf die Lactonstruktur zurückzuführen.
- Die Banden 1 bis 5 sind alle auf OH-Valenzschwingungen zurückzuführen.
- Ascorbinsäure besitzt fünf Hydroxylgruppen.
- Die Bande 8 ist auf eine C=C Valenzschwingung zurückzuführen.
- Ascorbinsäure besitzt vier Hydroxylgruppen.
- nur 1
- nur 1 und 3
- nur 2 und 3
- nur 2, 3 und 4
- nur 2, 4 und 5
Antwort E ist korrekt.
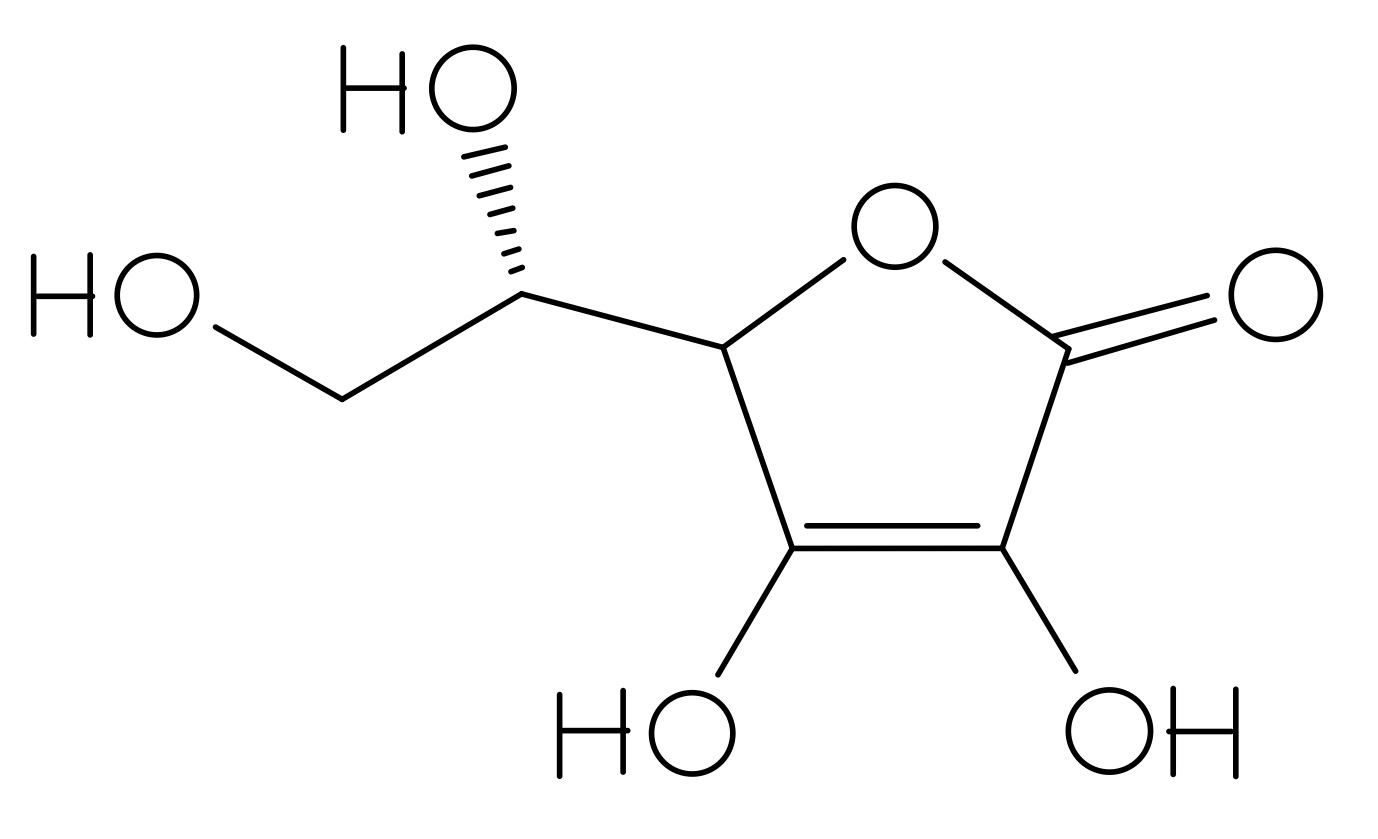
Zyklische Ester zeigen sich im IR-Spektrum meist als intensive Bande bei ca. 1760 cm-1 (Bande 7). Hydroxylgruppen hingegen sind in einem Bereich von 3600 cm-1 bis 2800 cm-1 zu finden (Bande 1 bis 5). Ascorbinsäure besitzt vier Hydroxylgruppen, nicht fünf (siehe Abbildung 03), die sich in den Banden 1 bis 5 wiederfinden. Bande 8 ist auf die C=C-Valenzschwingung einer Alkenstruktur zurückzuführen, Bande 6 resultiert aus einer C-H-Valenzschwingung eines gesättigten Kohlenwasserstoffs.
Dispersives IR-Spektrometer
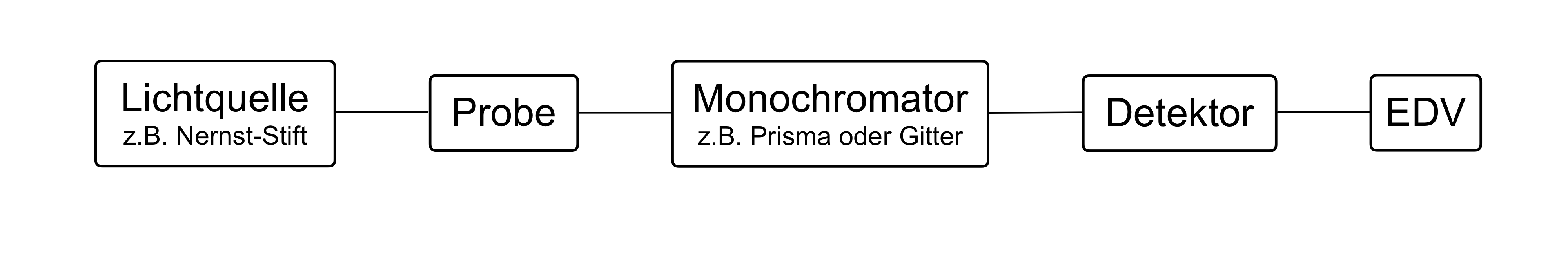
Was kann zum Aufbau eines dispersiven IR-Spektrometers im MIR-Bereich verwendet werden?
- Nernst-Stift
- Wolfram-Lampe
- Quarzglas-Küvette
- Prisma- oder Gitter-Monochromator
- Michelson-Interferometer
- nur 1
- nur 1 und 4
- nur 3 und 5
- nur 1, 3 und 4
- 1, 2, 4 und 5
Antwort B ist korrekt.
- Im MIR-Bereich kann als Lichtquelle der Nernst-Stift (Glühkörper aus Zirkoniumoxid und Yttriumoxid) verwendet werden.
- Wolfram-Lampen können nur im NIR- und VIS-Bereich angewendet werden, nicht im MIR-Bereich.
- Quarzglasküvetten können hier nicht verwendet werden, da Quarzglas für IR-Strahlung undurchlässig ist.
- Prisma- und Gitter-Monochromatoren können verwendet werden, da sie zur Aufspaltung elektromagnetischer Strahlung in einzelne Wellenlängen geeignet sind.
- Das Michelson-Interferometer kann alle Wellenlängen gleichzeitig analysieren und wird nur für Fourier-Transform-Geräte verwendet, nicht für dispersive Geräte.
Fingerprint-Bereich
Welche Aussagen zum Fingerprint-Bereich sind richtig?
- Die Banden im IR-Spektrum basieren auf Gerüstschwingungen.
- Der Fingerprint-Bereich liegt bei 1700 cm-1 bis 600 cm-1.
- Eine Zuordnung zu funktionellen Gruppen ist meist nicht möglich.
- Epimere lassen sich nicht im Spektrum unterscheiden.
- Es kann zu C-H-Deformationsschwingungen kommen.
- nur 1, 2 und 5
- nur 2, 3 und 4
- nur 1, 3 und 5
- nur 1, 3, 4 und 5
- 1 bis 5 (alle)
Antwort C ist korrekt.
- Die Banden entstehen durch Gerüstschwingungen, an denen fast alle Atome beteiligt sind.
- Der Fingerprint-Bereich erstreckt sich von 1500 cm-1 bis 500 cm-1.
- Es können meist keine funktionellen Gruppen zugeordnet werden. Dies geschieht anhand eines charakteristischen Bereiches bei 5000 cm-1 bis 1500 cm-1, bei dem Banden bestimmte Bindungsstrukturen zugeordnet werden können.
- Epimere lassen sich durch kleine Abweichungen im Fingerprint-Bereich unterscheiden.
- Im Bereich von 900 cm-1 bis 650 cm-1 kann es zu C-H-Deformationschwingungen durch disubstituierte Alkene kommen.
Textaufgaben
KBr-Pressling von Spironolacton
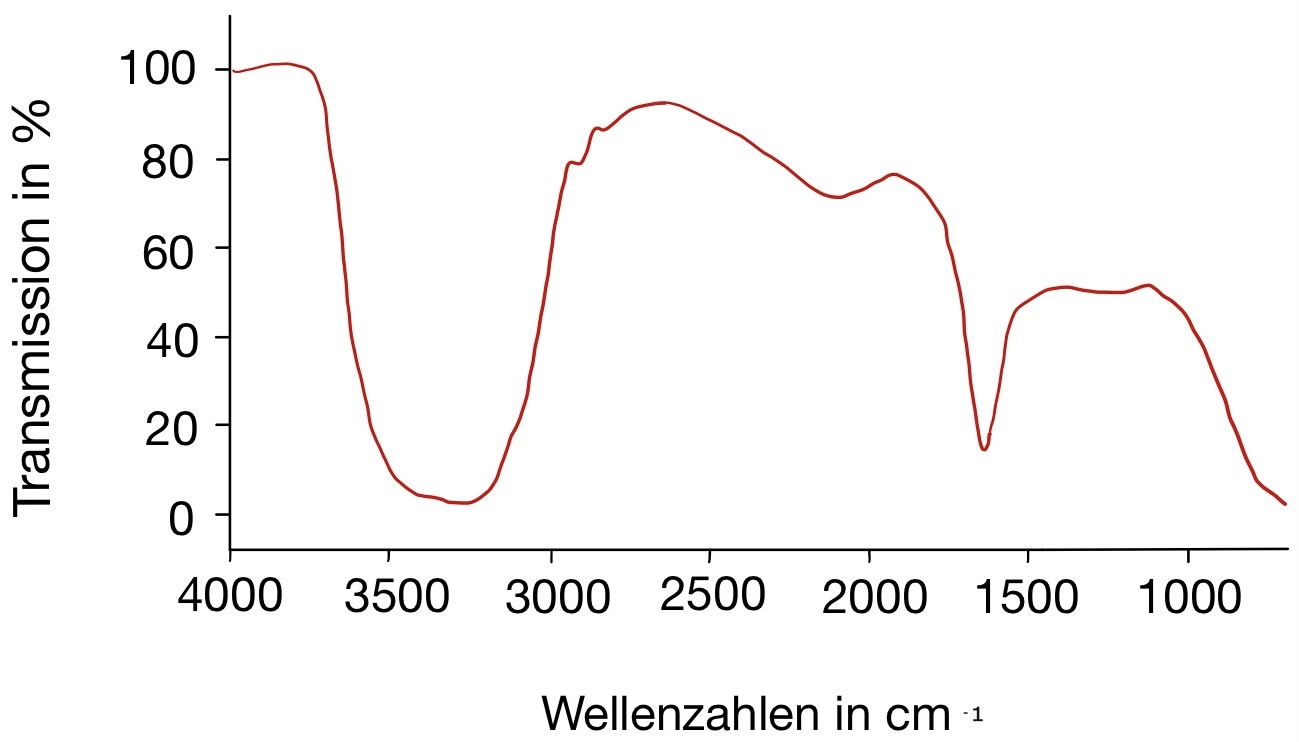
Abgebildet sind zwei IR-Spektren des Arzneimittels Spironolacton. Spironolacton gehört zu den Kalium-sparenden Diuretika und ist beispielsweise bei der Behandlung von Ödemen, Aszites, Hypertonie und Herzinsuffizienz indiziert. Durch eine kompetitive Bindung von Spironolacton an den Aldosteron-Rezeptor kommt es zu einer erhöhten Ausscheidung von Natrium und Wasser und einer verminderten Ausscheidung von Kalium.
 |  |
| Abbildung 05: IR-Spektrum 1 von Spironolacton 14 | Abbildung 06: IR-Spektrum 2 von Spironolacton 15 |
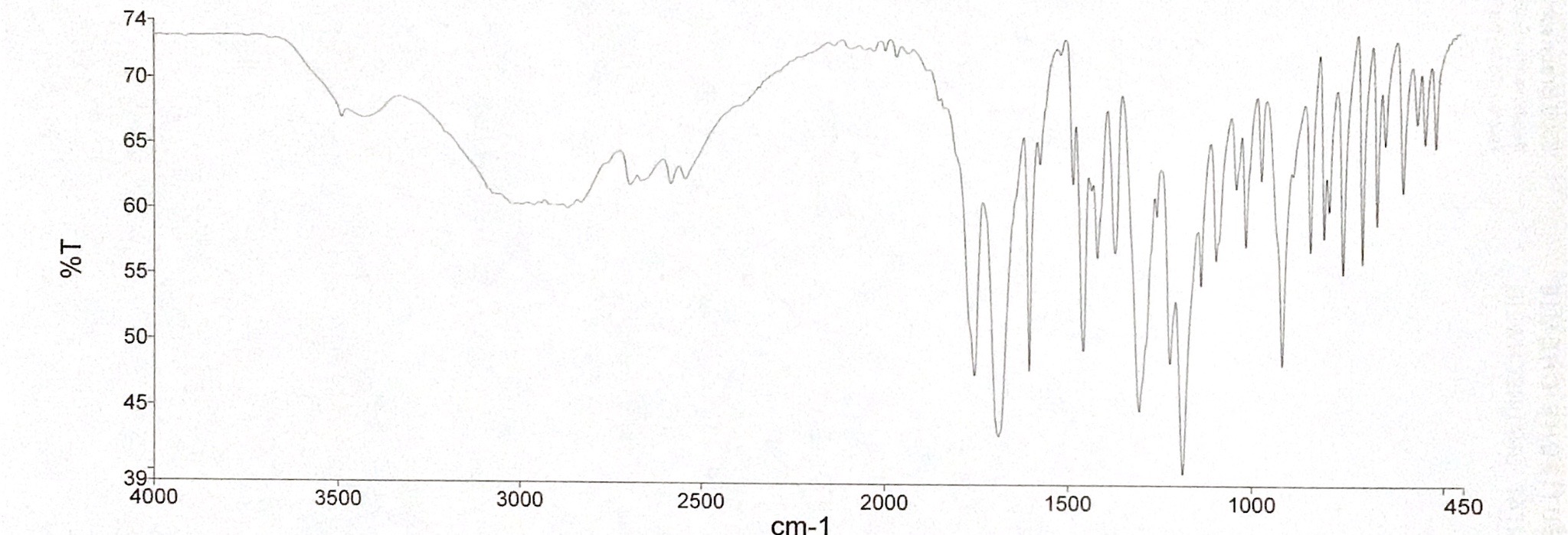
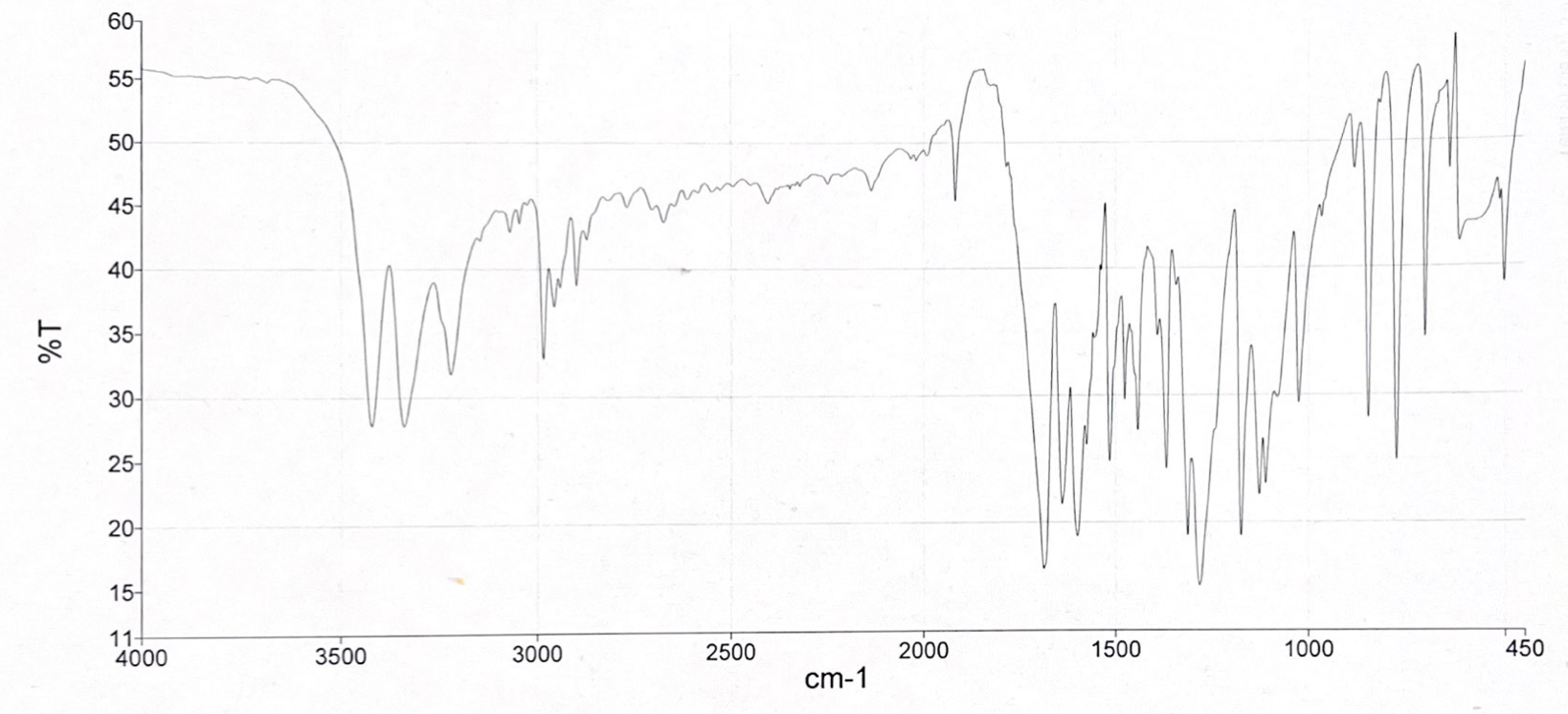
- Die Spektren wurden mit einem KBr-Pressling aufgenommen. Was fällt Ihnen beim Vergleich der beiden Spektren auf? Wodurch kann diese Veränderung auftreten?
Die Auswertung des Spektrums 1 wird durch eine Wasserbande erschwert. Das dazugehörige IR-Spektrum von Wasser ist in Abbildung 07 zu sehen. Es ist zu erkennen, dass eine breite und eine spitze Bande im Bereich von 3400 cm-1 bis 1650 cm-1 auftreten. Da Kaliumbromid hygroskopisch ist, wird es am in einem Trockenschrank oder Exsikkator aufbewahr und erst direkt vor der Verwendung aus diesem entnommen. Zudem kann Wasser in der Probensubstanz zu einer Wasserbande führen. Hier könnte dementsprechend das Kaliumbromid oder der Arzneistoff feucht geworden sein, sodass es zu einer Wasserbande im IR-Spektrum kam.
16
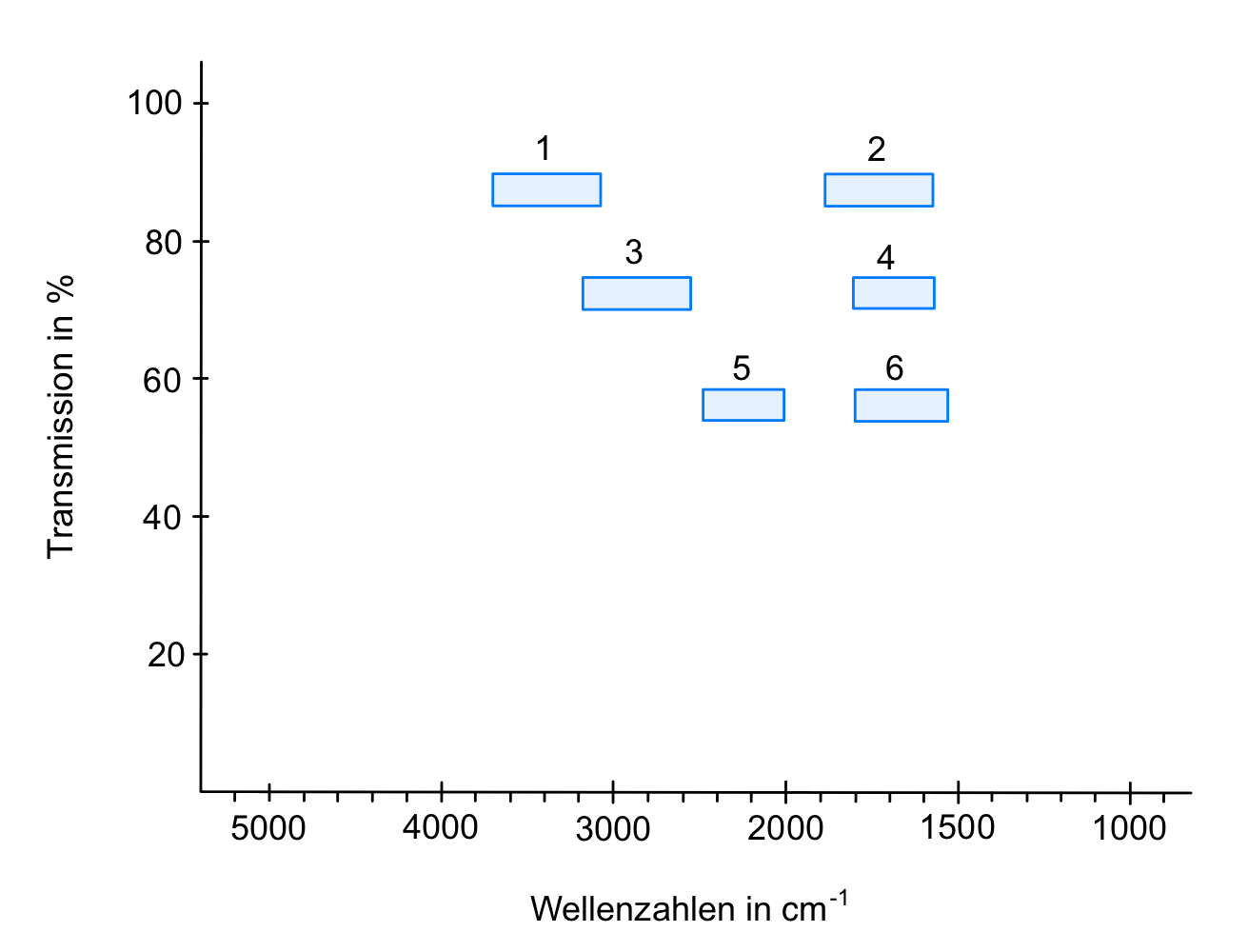
- Ordnen Sie die Strukturmerkmale den Zahlen 1 bis 6 zu und geben Sie an, um welche Art von Schwingungen es sich dabei handelt.
- OH- und NH-Valenzschwingungen
- C=O-Valenzschwingungen
- C-H-Valenzschwingungen
- C=N-Valenzschwingungen
- C≡C- und C≡N-Valenzschwingungen
- C=C-Valenzschwingungen
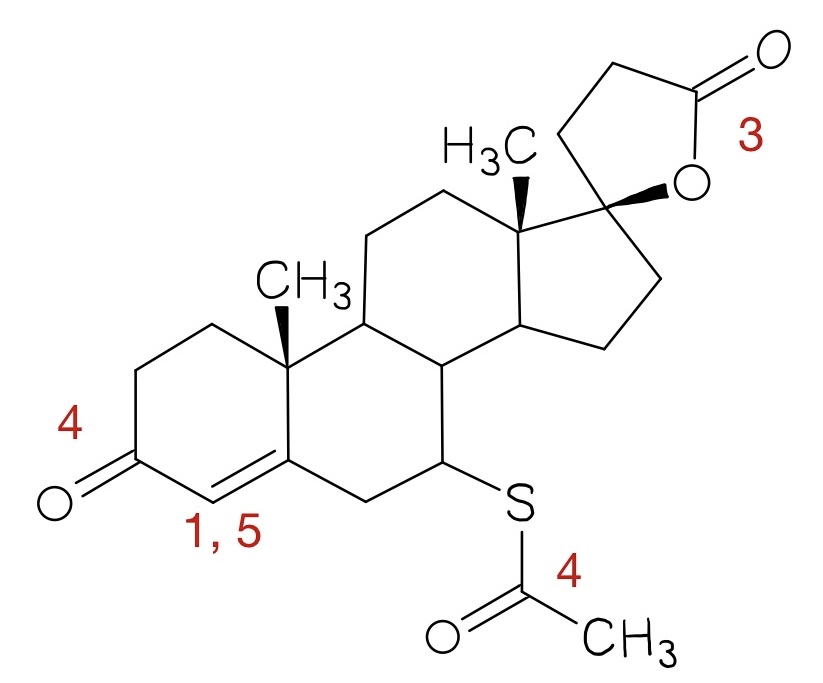
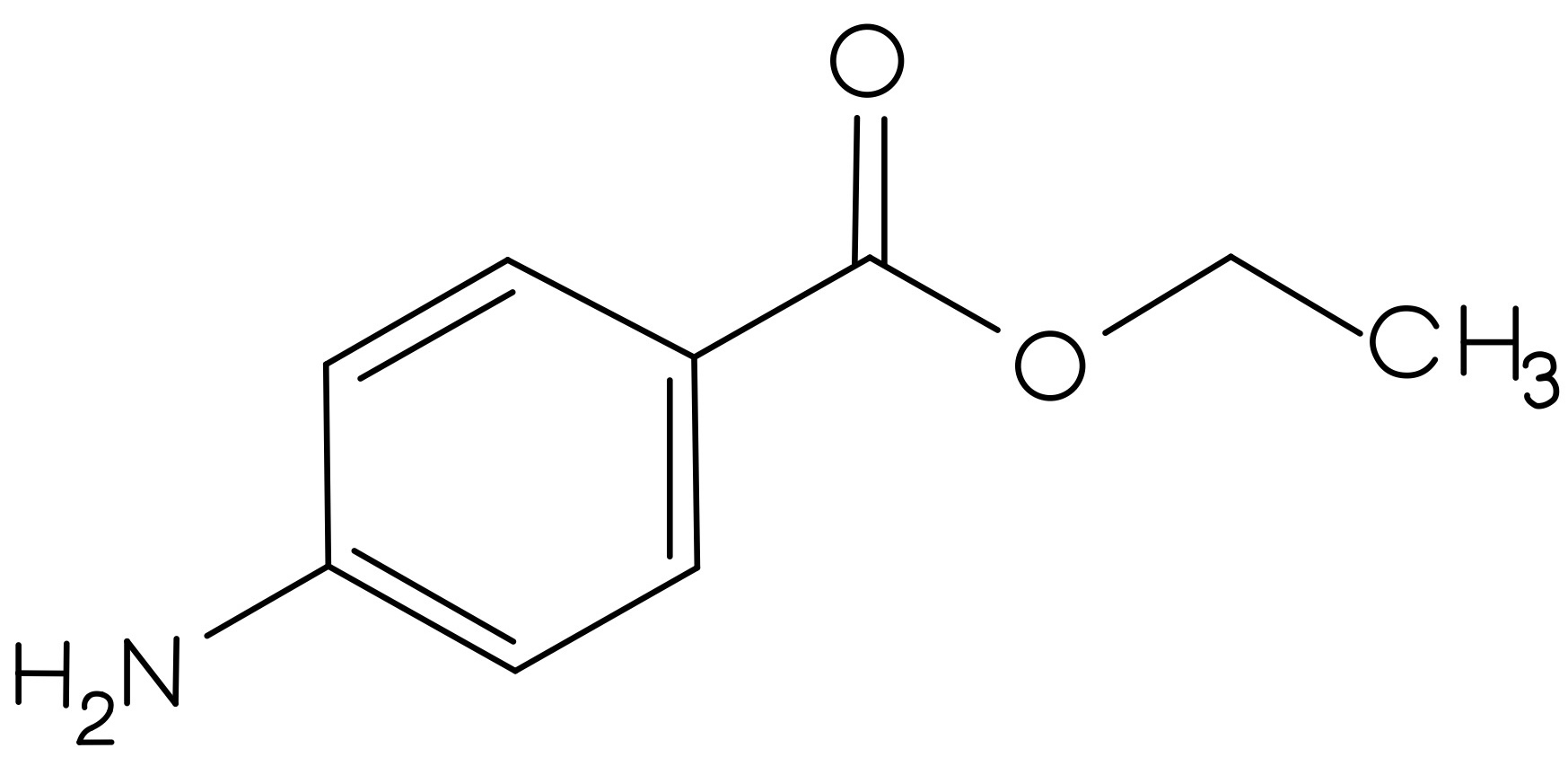
- Welche Strukturmerkmale könnte der Arzneistoff Spironolacton anhand der bezifferten Banden des IR-Spektrums 2 (Abbildung 06) aufweisen?
- C-H-Valenzschwingung eines Alkens
- C-H-Valenzschwingung eines Alkans
- C=O-Valenzschwingung des Lactonrings
- C=O-Valenzschwingung der Thioacetyl-Gruppe (1691 cm-1) und der Carbonylfunktion (1673 cm-1)
- C=C-Valenzschwingung eines Alkens
- Beschreiben Sie den Vorgang der Herstellung eines KBr-Presslings zur Aufnahme eines IR-Spektrums anhand der Vorgaben des Arzneibuches. Erläutern Sie außerdem bei welcher Beschaffenheit der Pressling verwendet werden kann.
Die Probensubstanz muss in Pulverform vorliegen. Es werden dabei circa 1 bis 2 mg der Probe in einem Achat-Mörser mit 300 bis 400 mg Kaliumbromid sorgfältig verrieben und anschließend in die Pressform gefüllt. Das Pulver wird mit Hilfe des Presswerkzeugs bei Drücken von 800 MPa bzw. 8000 bar einige Minuten lang gepresst. Ist der Pressling frei von Rissen, homogen und transparent, so kann er verwendet werden. Das Arzneibuch schreibt zudem vor, dass die Transmission bei 2000 cm -1 mindestens 75 % betragen muss.
23
24
- Die KBr-Methode wird im Transmissions-Modus der IR-Spektroskopie verwendet. Welche weiteren Möglichkeiten der Aufnahmetechnik gibt es? Erläutern Sie diese.
Die Messung von IR-intransparenten Proben erfolgt durch diffuse Reflexion. Dabei wird die Probe ohne Vorbereitung mit polychromatischer Infrarot-Strahlung bestrahlt. Es kommt sowohl zur Reflexion der Strahlen als auch zur Absorption eines gewissen Anteils, sodass es zu Molekülschwingungen in der Probe kommt. Die nicht absorbierten Strahlen werden reflektiert und registriert. Nach mathematischer Umformung wird dieses Reflexionsspektrum in ein Absorptionsspektrum umgewandelt.
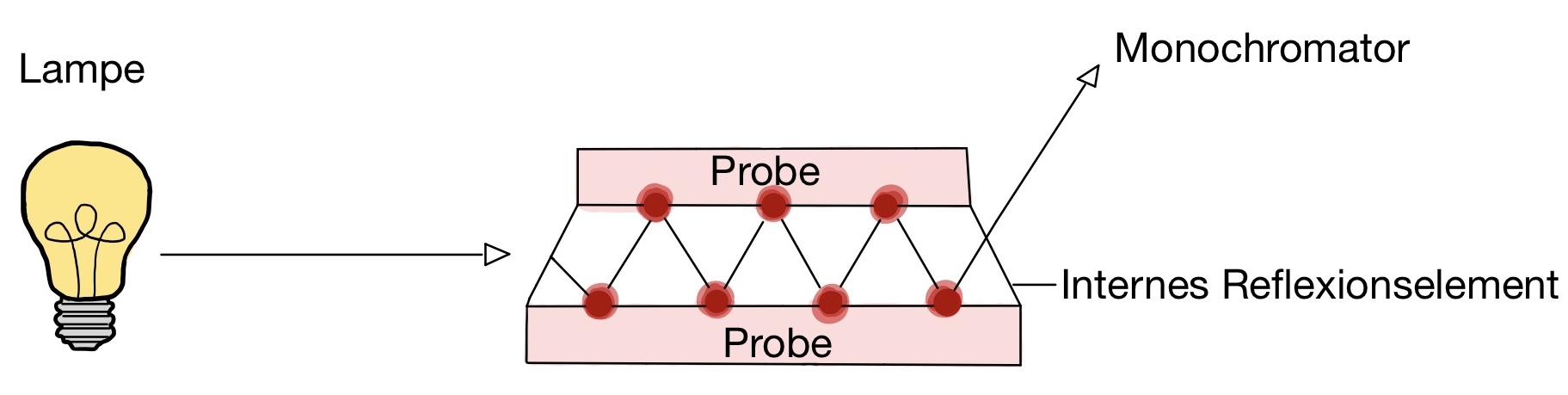
Die ATR-Technik (abgeschwächte Totalreflexion) basiert auf dem Prinzip der Totalreflexion und wird für Kunststoffe und viskose Substanzen verwendet. Die IR-intransparente Probe wird ober- und unterhalb einer Scheibe, dem Internen Reflexionselement aufgetragen, welches aus einem Material mit höherem Brechungsindex, wie z.B. Diamant besteht. Die IR-Strahlung wird durch die Probe als optisch dünneres Medium total reflektiert, wobei der Lichtstrahl zu einem geringen Anteil auch absorbiert wird. Dieser Lichtstrahl dringt durch die optisch dichtere Diamantscheibe erneut zur Probe durch und wird wieder total reflektiert. Durch das abgeschwächte total reflektierte Licht kann ein Absorptionsspektrum erstellt werden.
25
- Nennen Sie jeweils zwei Vor- und Nachteile der KBr-Methode.
| Vorteile | Nachteile |
|---|---|
| Es handelt sich um eine einfache Technik. | Alkalihalogenide sind hygroskopisch, sodass es schnell zur Bildung von Wasserbanden kommen kann. |
| Man benötigt nur wenig Analysensubstanz für einen Pressling. | Alkalihalogenide sind sehr polar, eine Reaktion mit der Probensubstanz ist möglich. |
| Sie ist zur qualitativen Bestimmung geeignet. | Sie ist nicht zur quantitativen Bestimmung geeignet, da der Pressling nicht an allen Stellen eine gleichmäßige Schichtdicke aufweist. |
| Die Signalintensität kann durch Erhöhung der Analysensubstanz im Pressling verbessert werden. | Bei Vermessung von halogenidhaltigen Substanzen könnte es zu einem Halogenidaustausch kommen. |
Identitätsprüfung und Fourier-Transform-Gerät
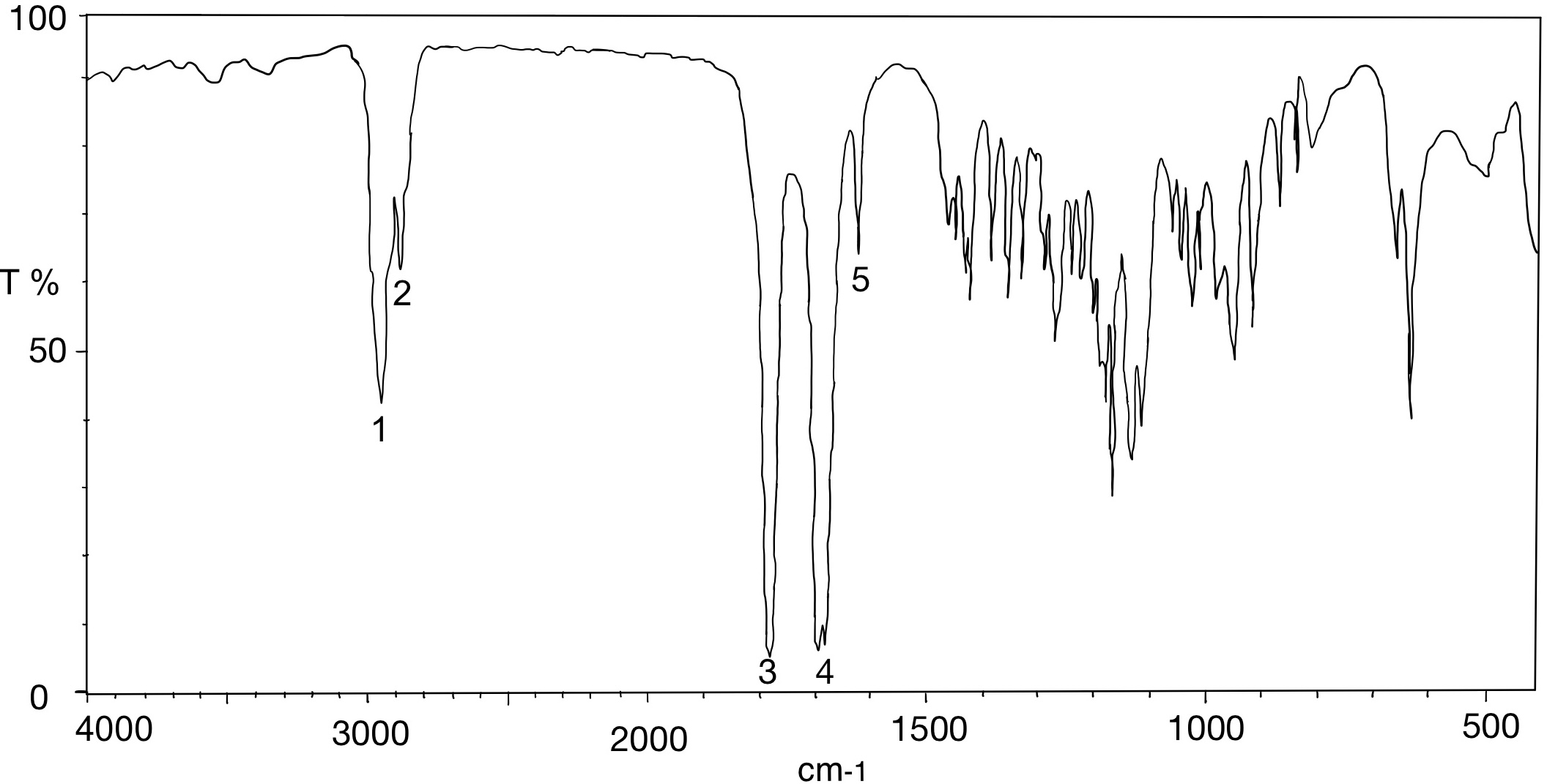
Der Vorrat an Acetylsalicylsäure, Benzocain, Ibuprofen und Paracetamol war knapp, deswegen wurden diese neu bestellt. Es wurden allerdings nur zwei Feststoffe geliefert. Bei der ersten Substanz handelt es sich um ein Analgetikum, leider fehlt auf diesem Gefäß die genaue Bezeichnung des Stoffes. In dem anderen Behälter soll Benzocain enthalten sein. Als Identitätsprüfung soll von jeder gelieferten Substanz ein IR-Spektrum aufgenommen werden. Nach der ersten Aufnahme ging das Messgerät kaputt, sodass nur das gelieferte Analgetikum bestimmt werden konnte.
- Um welches Analgetikum handelt es sich? Begründen Sie Ihre Entscheidung, indem Sie die funktionellen Gruppen den Banden zuordnen.
Um die Strukturformeln der Analgetika zu erhalten, klicken Sie auf den Button!
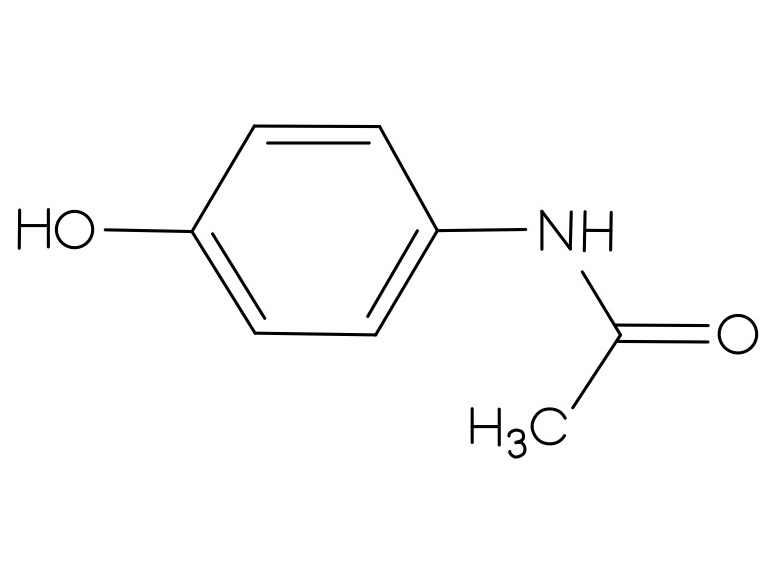 | 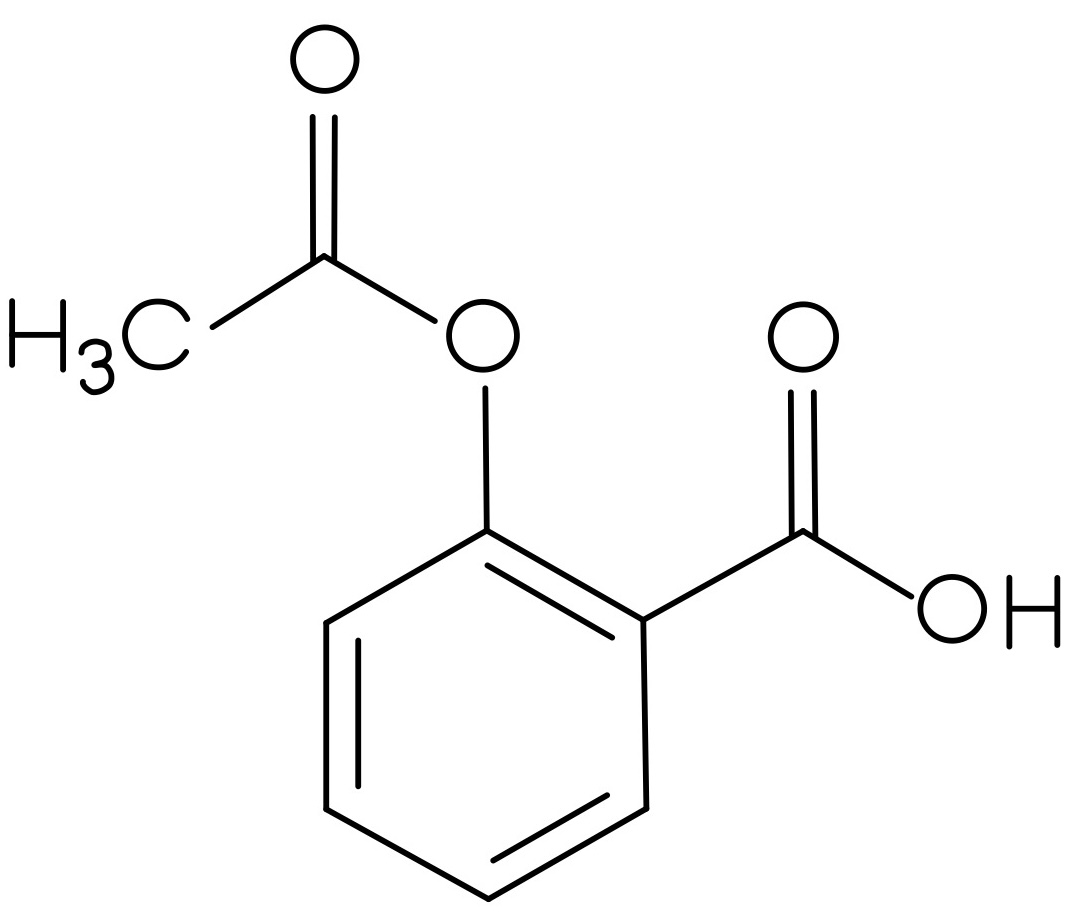 | 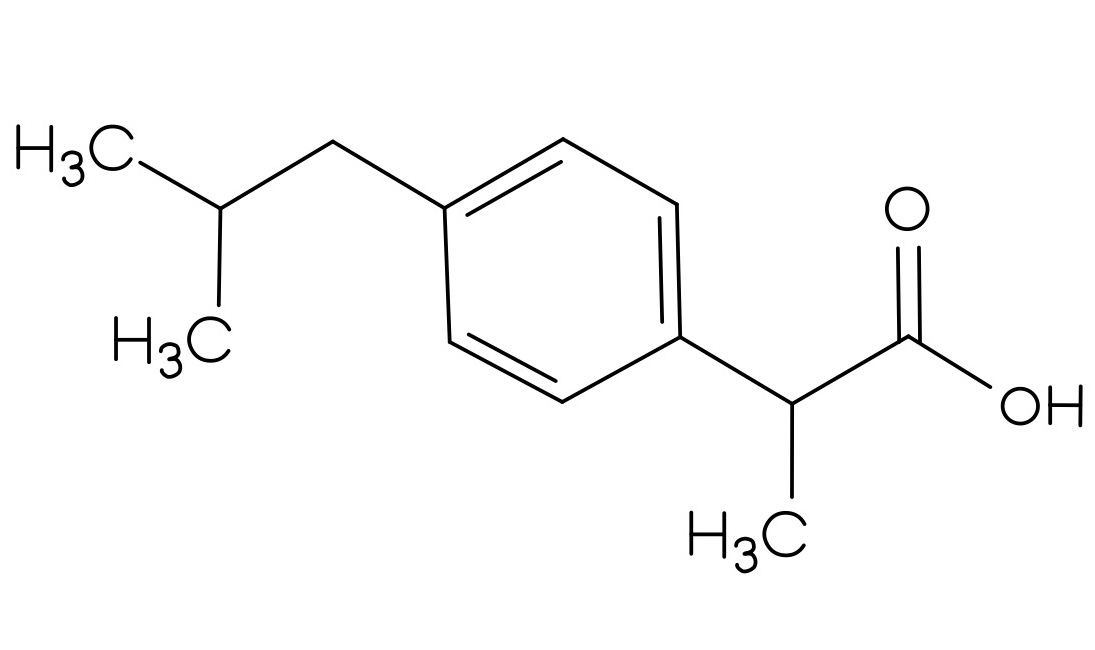 |
| Abbildung 12: Struktur Analgetikum 1 30 | Abbildung 13: Struktur Analgetikum 2 31 | Abbildung 14: Struktur Analgetikum 3 32 |
Hierbei handelt es sich um Acetylsalicylsäure (Struktur 2).
Es treten von 3300 cm-1 bis 2500 cm-1 O-H- und C-H-Valenzschwingungen auf, bei ca. 1760 cm-1 tritt die C=O-Valenzschwingung des Esters auf. Zusätzlich ist bei 1700 cm-1 die C=O-Valenzschwingung der Carbonsäure sichtbar. Die C=C-Valenzschwingungen des Aromaten lassen sich bei 1600 cm-1 ausmachen.
Weitere Analgetika wären Paracetamol (Struktur 1) und Ibuprofen (Struktur 3). Paracetamol hat eine markante, spitze Bande bei ca. 3400 cm-1, die auf die N-H-Valenzschwingung zurückzuführen ist. Ibuprofen hat bei ca. 3000 cm-1 eine spitz zulaufende O-H-Bande. Diese Banden sind im gegebenen Spektrum nicht sichtbar.
33
34
- Welche charakteristischen Banden sind bei welchen Wellenzahlen (außerhalb des Fingerprint-Bereiches) für Benzocain zu erwarten?
Es treten von 3500 cm-1 bis 3300 cm-1 N-H-Valenzschwingungen auf und bei knapp unter 3000 cm-1 sind C-H-Valenzschwingungen zu erkennen. Bei ca. 1650cm-1 tritt die C=O-Valenzschwingung des Esters auf. Die C=C-Valenzschwingungen des Aromaten lassen sich bei 1600 cm-1 bis 1500 cm-1 ausmachen.
36
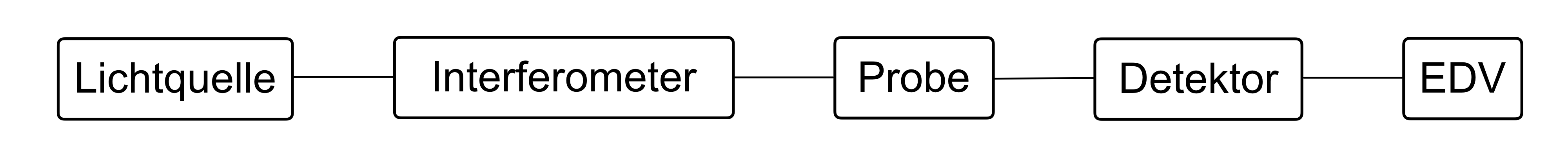
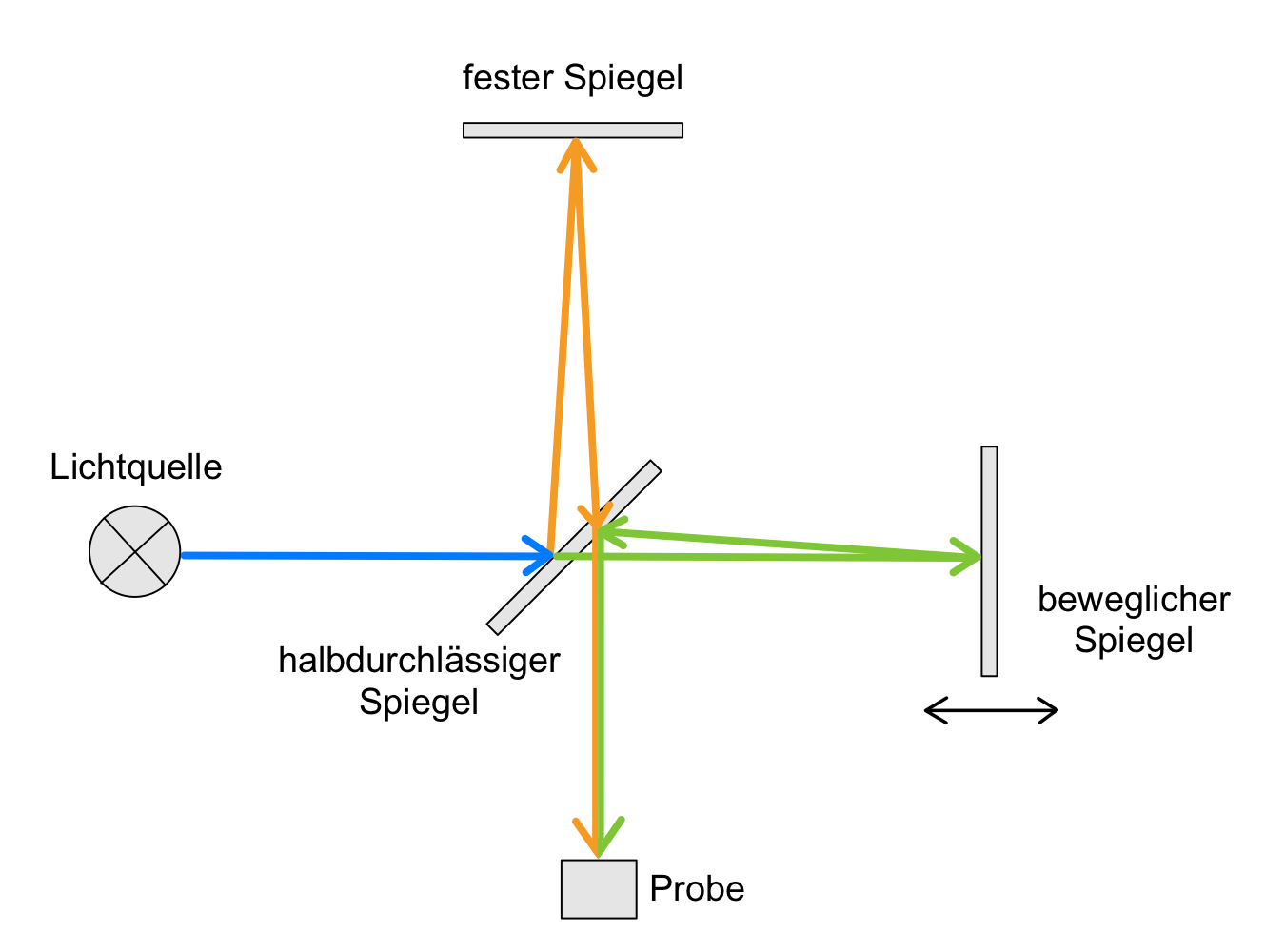
- Das IR-Spektrum wurde mit Hilfe des Fourier-Transform-Gerätes aufgenommen. In Abbildung 17 sehen Sie den schematischen Aufbau dieses Gerätes. Benennen Sie die bezifferten Bestandteile und erklären Sie die Funktionsweise von Nummer 2.
In Fourier-Transform-Spektrometern wird die Probe mit der gesamten Strahlung des MIR-Bereiches bestrahlt, sodass die Absorption bei allen für die Probe charakteristischen Wellenlängen gleichzeitig erfolgt. Hierfür verwendet man Interferometer, meist das Michelson-Interferometer, dessen schematischer Aufbau in Abbildung 19 zu sehen ist. Zunächst wirft eine Lichtquelle polychromatisches Licht auf einen Strahlungsteiler, hier ein halbdurchlässiger Spiegel und wird in zwei gleich intensive Strahlen aufgeteilt. Die eine Hälfte des Strahls wird auf einen festen Spiegel um 90° reflektiert. Die andere Hälfte durchdringt den Strahlungsteiler, trifft auf einen beweglichen Spiegel und wird ebenfalls reflektiert. Die gesamte reflektiert Strahlung wird nun wieder auf den halbdurchlässigen Spiegel zurückgeworfen, sodass wieder ein Teil reflektiert und ein Teil durchgelassen wird. Nach dieser Reflexion überlagern sich die zwei Wellen und es kommt zur Interferenz. Wie die Strahlen interferieren hängt von ihrer Phasendifferenz ab. Die Strahlen werden nun auf die Probe geworfen. Die aus der Probe austretende Lichtintensität wird als Funktion der Zeit registriert. Man erhält ein Interferogramm, welches in ein normales Spektrum umgewandelt werden kann.
40
41
- Nennen Sie vier Vor- und zwei Nachteile des Fourier-Transform-Gerätes.
| Vorteile | Nachteile |
|---|---|
| Das gesamte Spektrum wird gleichzeitig aufgenommen, deshalb ist die Messzeit verkürzt. | Komplexe mathematische Transformationen sind zur Auswertung nötig. |
| Durch eine interne Kalibrierung ist eine höhere Präzision möglich. | Probe und Referenz werden nacheinander vermessen, da es sich hierbei in der Regel um ein Einstrahlmessgerät handelt. |
| Durch eine höhere Empfindlichkeit können kleinere Probenmengen verwendet werden. | - |
| Störungen durch Wasserdampf und CO2 aus der Luft werden kompensiert. | - |
| Durch den Wegfall des nötigen Spaltes erreicht eine größere Lichtmenge den Detektor. | - |
Weitere Vorteile die nicht im Skript erwähnt, aber zum weiteren Verständnis noch hinzugefügt wurden:
- Die Lichtausbeute wird durch die im FT-Gerät verwendeten kreisförmigen Apparaturen deutlich verbessert und somit auch das Signal-Rausch-Verhältnis.
- Durch Verwendung des Interferometers wird das Spektrum nicht kontinuierlich in Abhängigkeit von der Wellenlänge aufgenommen. Es werden alle Wellenlängen gleichzeitig als Momentaufnahme erfasst, dadurch erhöht sich das Signal-Rausch-Verhältnis.
- Durch die Verwendung eines Helium-Neon-Lasers als Referenz ist eine höhere Frequenzgenauigkeit erreichbar. Dadurch ergibt sich die Möglichkeit, geringfügige Unterschiede zwischen zwei Spektren durch Differenzbildung sehr präzise zu ermitteln.
Einzelnachweise
1 Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 54, 66 ⇑
2 Seminarskript: „Instrumentelle Analytik-NIR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 12 ⇑
3 Seminarskript: „Instrumentelle Analytik-Raman-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 10 ⇑
4 Erstellt von Expertengruppe 01 Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 11 ⇑
5 Rücker/Neugebauer/Willems (2013), Instrumentelle pharmazeutische Analytik (5. Aufl.), S. 184, Stuttgart ⇑
6 Ehlers (2016), Analytik II (12. Aufl.), S. 435ff, Stuttgart ⇑
7 Aufgenommen von Expertengruppe 01 ⇑
8 Gezeichnet von Expertengruppe 01, basierend auf „Strukturformeln Instrumentelle Analytik", Dr. Thomas Kellner, Version 2 - 15.06.2021 ⇑
9 Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 61, 63 ⇑
10 http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/3/anc/vitamin_c/strukturaufklaerung.vlu/Page/vsc/de/ch/3/anc/vitamin_c/3_strukturaufkl/aufgabe_ir/aufgstrukir_m87te0102.vscml.html, zuletzt abgerufen: 26.05.2022, 13:32 Uhr ⇑
11 Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 19, 21, 28, 34 ⇑
12 Gezeichnet von Expertengruppe 01 Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 18 ⇑
13 Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S.43,51 ⇑
14 Aufgenommen von Expertengruppe 01 ⇑
15 Gezeichnet von Expertengruppe 01, basierend auf https://www.chemicalbook.com/SpectrumEN_52-01-7_IR1.htm, zuletzt abgerufen: 29.05.2022, 16:28 Uhr ⇑
16 Kommentar zu Ph. Eur. 10.3/2.02.24.00 IR-Spektroskopie ⇑
17 Gezeichnet von Expertengruppe 01, basierend auf http://www.chemgapedia.de/vsengine/tra/vsc/de/ch/3/anc/ir_raman_spektroskopie1.tra/Vlu/vsc/de/ch/3/anc/ir_spek/ir_probenvorbereitung.vlu.html, zuletzt abgerufen: 16.06.2022, 13:22 Uhr ⇑
18 Gezeichnet von Expertengruppe 01 basierend auf Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 56 ⇑
19 Seminarskript:„ Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 56 ⇑
20 Gezeichnet von Expertengruppe 01 basierend auf 
21 Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 57 ⇑
22 Kelidari et al. "Formulation optimization and in vitro skin penetration of spironolactone loaded solid lipid nanoparticles" (05.03.2015) ⇑
23 Ph. Eur. 10.3/2.02.24.00 IR-Spektroskopie ⇑
24 Rücker/Neugebauer/Willems (2013), Instrumentelle pharmazeutische Analytik (5. Aufl.), S. 192f., Stuttgart ⇑
25 Rücker/Neugebauer/Willems (2013), Instrumentelle pharmazeutische Analytik (5. Aufl.), S. 192f., Stuttgart ⇑
26 Gezeichnet von Expertengruppe 01, basierend auf Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 27 ⇑
27 Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 26 ⇑
28 https://qd-europe.com/de/de/produkt/wissenswertes-ueber-kbr-presslinge/, zuletzt abgerufen: 29.05.2022, 16:47 Uhr ⇑
29 Aufgenommen von Expertengruppe 01 ⇑
30 Gezeichnet von Expertengruppe 01, basierend auf „Strukturformeln Instrumentelle Analytik", Dr. Thomas Kellner, Version 2 - 15.06.2021 ⇑
31 Gezeichnet von Expertengruppe 01, basierend auf „Strukturformeln Instrumentelle Analytik", Dr. Thomas Kellner, Version 2 - 15.06.2021 ⇑
32 Gezeichnet von Expertengruppe 01, basierend auf „Strukturformeln Instrumentelle Analytik", Dr. Thomas Kellner, Version 2 - 15.06.2021 ⇑
33 Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 49, 56, 64 ⇑
34 https://www.deutsche-apotheker-zeitung.de/daz-az/2020/daz-17-2020/den-schwingungen-auf-der-spur, zuletzt abgerufen: 25.05.2022, 9:30 Uhr ⇑
35 Gezeichnet von Expertengruppe 01, basierend auf „Strukturformeln Instrumentelle Analytik", Dr. Thomas Kellner, Version 2 - 15.06.2021 ⇑
36 Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 56, 64 ⇑
37 Aufgenommen von Expertengruppe 01 ⇑
38 Erstellt von Expertengruppe 01 ⇑
39 Erstellt von Expertengruppe 01, basierend auf Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 34 ⇑
40 Rücker/Neugebauer/Willems (2013), Instrumentelle pharmazeutische Analytik (5. Aufl.), S. 194f., Stuttgart ⇑
41 Ehlers (2016), Analytik II (12. Aufl.), S. 447, Stuttgart ⇑
42 Gezeichnet von Expertengruppe 01, basierend auf Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 34 ⇑
43 Seminarskript: „Instrumentelle Analytik-IR-Spektroskopie", 4.Semester, Dr. Thomas Kellner, SoSe 2022, S. 33, 42 ⇑
44 Gremlich/ Günzler (2003), IR-Spektroskopie: Eine Einführung (4. Aufl.), S. 41, 55-58, Weinheim ⇑