Gaschromatographie
Übung
Gaschromatographie
SoSe 2022
Abgabedatum
30.05.2022
Expertengruppe 12
Jule Schaarschmidt
Janosch Auer
Philipp Finkbeiner
Inhaltsverzeichnis
Multiple Choice (MC) Fragen
Beeinflussung der Gaschromatographie
Was hat Auswirkungen auf das Ergebnis einer Gas-fest-Chromatographie?
- Der pH-Wert der mobilen Phase.
- Die Affinität der stationären Phase zum Analyten.
- Der Wassergehalt des Trägergases.
- Die Wechselwirkung der mobilen Phase mit dem Analyten.
- Die Wechselwirkung der stationären Phase mit dem Analyten.
- nur 1.
- 2 und 4
- 1,2 und 4
- 2,3 und 5
- 1-5 (alle)
Antwort D ist korrekt
Bei der Gas-fest-Chromatographie wird als mobile Phase ein Inertgas (z.B. Helium oder Stickstoff) verwendet, es ist also nur ein Träger und hat keine Wechselwirkung mit dem Analyten. Dementsprechend spielt auch der pH-Wert des Trägergases eine Rolle. Das Trägergas sollte wasserfrei sein, damit es zu keiner hydrolytischen Spaltung in der stationären Phase kommt. 1
Verwendbarkeit von Detektoren
Welcher Detektor, der in der Gaschromatographie eingesetzt wird, ist blind für nicht oxidierbare Analyten?
- Der Wärmeleitfähigkeitsdetektor.
- Massenselektive Detektoren.
- Der Flammenionisationsdetektor
- Der thermionische Detektor.
- Der Elektroneneinfangdetektor.
Antwort C ist korrekt
Im Flammenionisationsdetektor befindet sich eine Knallgasflamme, die notwendigen Ionen zur Detektion werden also nur bei Verbrennung von organischen Kohlenwasserstoffgruppen erzeugt. Deshalb spricht er nur auf organische bzw. oxidierbare Substanzen an. Der Wärmeleitfähigkeitsdetektor misst die Wärmeleitfähigkeit und ist nur konzentrationsabhängig. Massenselektive Detektoren sprechen auf Ionen an, dafür werden Substanzen zuvor ionisiert. Dabei spielt es keine Rolle, ob die Probe oxidierbar ist. Der thermionische Detektor hat zwar einen ähnlichen Aufbau wie der Flammenionisationsdetektor, kann aber nur Stoffe detektieren, die Phosphor oder Stickstoff enthalten. Auch der Elektroneneinfangdetektor ist konzentrationsabhängig und ist selekiv für elektronegative Teilchen (z.B. Halogene). 2 3
Elutionsreihenfolge
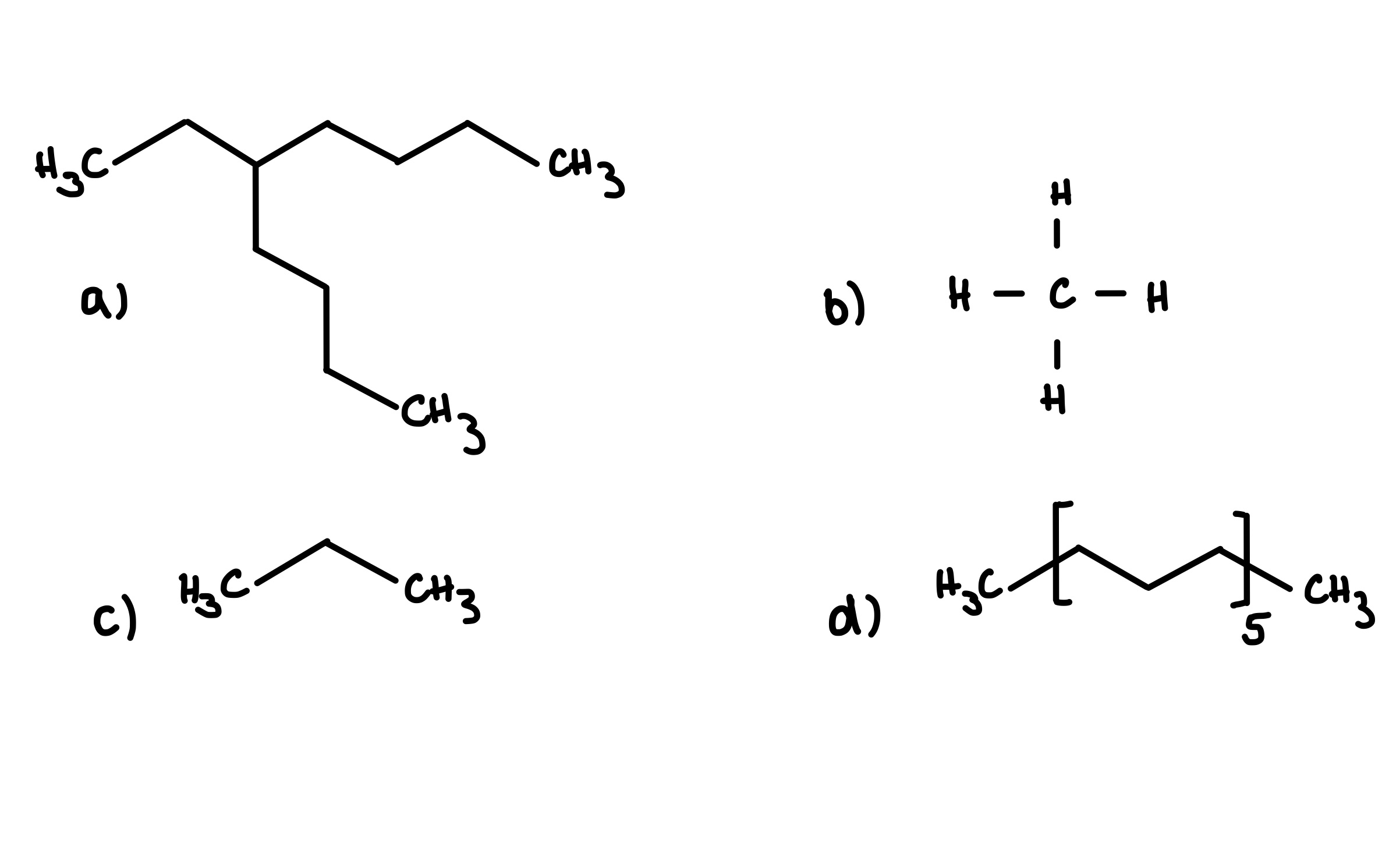
Folgenden Substanzen werden mit Methylpolysiloxan mittels GC bestimmt. Welche Elutionsreihenfolge wird erwartet?
- b-c-a-d
- a-b-c-d
- d-c-b-a
- d-a-c-b
- Dies lässt sich nicht vorhersagen.
Antwort A ist korrekt. In der homologen Reihe nimmt die Elutionszeit mit steigender Kettenlänge zu und mit Stärke der Verzweigung ab. Dementsprechend eluiert b als kleinstes Molekül als erstes und c als zweites. Verbindung a hat eine stärkere Verzweigung als d, weshalb a früher eluiert. 5
Richtigkeit von Injektionsverfahren
Im Folgenden werden Aussagen zu drei verschiedenen Injektionsverfahren der Gaschromatographie gemacht:
- Probenschleifen sind eine Möglichkeit, reproduzierbare Volumina zu untersuchen.
- Der On-Column-Injektor ist ein warmes Verfahren, das heißt der Probenraum ist beheizt.
- Die Head-Space-Analyse bietet sich an, um den Blutethanolgehalt ohne weitere Berechnungen zu bestimmen.
Welche Aussagen treffen zu?
- keine der Aussagen trifft zu.
- nur 1
- nur 1 und 2
- nur 3
- 1-3 (alle)
Antwort B ist korrekt
Der On-Column-Injektor ist kein warmes, sondern ein kaltes Verfahren. Bei der Head-Space-Analyse kann nur der Ethanolgehalt der gasförmigen Phase bestimmt werden und nicht automatisch der Gehalt der ganzen Probe. Mit dem Gehalt in der gasförmigen Phase kann dann eine Kalibriergerade erstellt werden und mittels der Standardadditionsmethode gerechnet werden. Probenschleifen stellen ein automatisches Injektionsverfahren dar, deshalb können genaue Volumina eingestellt werden und immer wieder injiziert werden. 6
Allgemeines zur Gaschromatographie
Welche Aussage zur Gaschromatographie (GC) trifft 'nicht' zu?
- Mit der GC ist eine chirale Trennung möglich.
- In gepackten Säulen können Trägermaterialien ausschließlich fest sein.
- Es ist ein Verfahren zur qualitativen und quantitativen Analytik.
- WCOT-Säulen werden auch Dünnfilmsäulen genannt.
- Ätherische Öle können analysiert werden.
Antwort B ist korrekt
Gepackte Säulen können in der Gas-fest-Chromatographie mit feinkörnigen Adsorbentien wie Kieselgel oder Ruß gefüllt sein. In der Gas-flüssig-Chromatographie wird eine Trennflüssigkeit als stationäre Phase auf auf die Feststoffe gebracht. 7 8
Textaufgaben
Trennung mit der Gaschromatographie
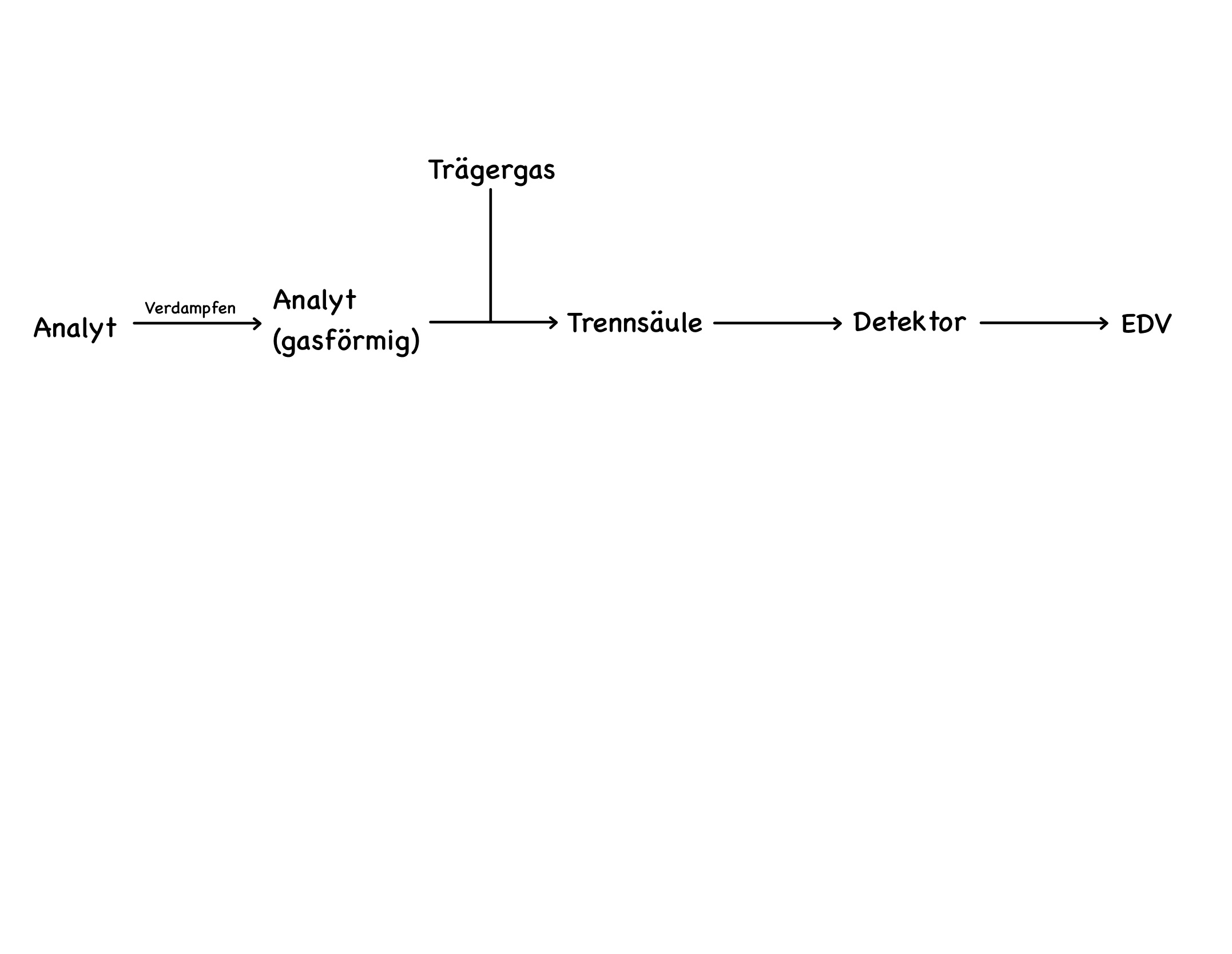
- Zeichnen Sie den Aufbau eines Gaschromatographen als Schema.
- Welchen Unterschied weisen die Chromatogramme von gleichen Substanzen auf, die auf einer gepackten Säule und auf einer Kapillarsäule getrennt wurden?
Wie lässt sich das erklären?
Einzelne Substanzen können im Chromatogramm der Kapillarsäule wesentlich genauer identifiziert werden. Beim Chromatogramm der gepackten Säule lassen sich nur Stoffgruppen eindeutig trennen. In Kapillarsäulen ist die Trenneffizienz wesentlich höher, dies hat 2 Gründe. Zum einen ist das Druckgefälle innerhalb der Kapillare niedriger, da sich das Trägermaterial nur am Rand befindet. Zum anderen können Kapillarsäulen zur Erhöhung der Trenneffizienz weit verlängert werden (je länger, desto effizienter und genauer). 11
- Nennen Sie mindestens 3 Substanzgruppen die mit der Gaschromatographie bestimmt werden können.
Einige Beispiele: Ätherische Öle, Lösungsmittel, Arzneistoffe, Stoffwechselprodukte und chirale Stoffe (Enantiomerenreinheit). 12
- Einige Stoffe eignen sich nicht zur Trennung durch Gaschromatographie. Welche Eigenschaften liegen dem zugrunde und was kann man dagegen tun?
1. Grund: Hohe Polarität des Stoffes. Abhilfe kann hier die Derivatisierung mittels Methylierung schaffen. 2. Grund: Geringe Verdampfbarkeit des Stoffes bzw. Zersetzung des Stoffes beim Verdampfen. Abhilfe kann hier die Silylierung oder Acylierung schaffen. 13
Eine simulierte Trennung mit der GC
Zur Trennung und quantitativen Auswertung eines Gasgemisches wurde eine Gaschromatographie mit anschließender optischer Analyse durchgeführt. Zusätzlich wurden Referenzsubstanzen verwendet, um das System zu kalibrieren und die Retentionszeiten zu vergleichen. In dem Gasgemisch sind folgende Substanzen enthalten: Aceton, Acetaldehyd, Formaldehyd, Ethanol und Benzol.
- In der Analyse der Probe ergaben sich die folgenden Peakflächen
Aceton: 54792 Acetaldehyd: 70078 Formaldehyd: 24763 Ethanol: 5439 Benzol: 49612.
Wie groß ist der Massenanteil der einzelnen Stoffe?
Hier muss die "100% Methode" verwendet werden. Dazu addiert man alle Peakflächen miteinander und berechnet dann lediglich den prozentualen Anteil einer Substanz. Hier erklärt am Bsp von Aceton:⚠ $54792+70078+24763+5439+49612=204684$
Das ist die Fläche unter allen Peaks zusammen. Für den Massengehalt von Aceton muss man jetzt nur noch ⚠ $54792:204684=0,2676906842$ berechnen. Der Massengehalt ist also ca
26.8%
Alle Weiteren Ergebnisse:
Acetaldehyd = 34.2%
Formaldehyd = 12.1%
Ethanol = 2.6%
Benzol = 24.2%
- Nach erstem Lauf der Chromatographie stellen Sie fest, dass die Trennung nicht optimal ist. Welche Parameter können Sie bei gleichbleibender Analyse ändern, um ein besseres Trennergebnis zu erhalten?
Im Folgenden werden einige Beispiele genannt. Es kann ein Temperaturgradient eingeführt werden. Dieser kann so eingestellt werden, dass die Retentionszeit kürzer oder länger wird und Peaks schmaler werden. In Kombination damit kann auch die Länge der Säule angepasst werden, um eine bessere Auflösung bei der Trennung zu erhalten. Bei ähnlichen Siedepunkten kann die Polarität der stationären Phase verändert werden. So können die Substanzen nicht nur nach ihren Siedepunkten, sondern auch nach ihrer Polarität getrennt werden. Sollte bei den Peaks starkes Tailing zu sehen sein, kann man die Injektionsmenge verringern, da die Säule in der GC sehr schnell überladen ist, was zu Tailing führt. 15
- Zur Ermittlung der Konzentration der Gase wurde das System mit Hilfe interner Standards kalibriert. Erklären Sie kurz, wie man ein System kalibrieren kann und wozu dies dient.
Zur Kalibrierung eines Systems kann man die Standardadditionsmethode verwenden. Hierbei vermisst man Standards unterschiedlicher Konzentrationen und erstellt aus den erhaltenen Werten Kalibriergeraden. Mit diesen kann man dann genaue Aussagen über den Gehalt der Probe treffen, wenn die Werte der Probe im Bereich der Kalibriergeraden liegen. Kalibrieren ist notwendig, um den internen Fehler des Systems auszugleichen und somit eine möglichst genaue Aussage zu treffen, die nicht durch das System verfälscht wird. 16 17
- Bei der Kalibrierung wurde jeweils eine Konzentration von 0,2 mol/L; 0,5mol/L und 1,0mol/L verwendet. Es ergaben sich die folgenden Peakflächen für die einzelnen Substanzen
| 0,2 mol/L | 0,5mol/L | 1,0mol/L | |
| Aceton | 11681,64 | 31175,94 | 63666,44 |
| Acetaldehyd | 15085,6 | 40343,5 | 82440 |
| Formaldehyd | 10019,8 | 23860 | 46927 |
| Ethanol | 2499,8 | 6014 | 11871 |
| Benzol | 10475,04 | 27619,74 | 56194,24 |
Berechnen Sie anhand dieser Angaben die Stoffmengenkonzentration der einzelnen Bestandteile der Probe. HINWEIS: Der Einfachheit halber liegen alle gemessenen Werte genau auf einer Kalibriergeraden. Es reichen also 2 Werte aus, um eine Regression durchzuführen.
Zur Lösung dieser Aufgabe muss zunächst eine Kalibriergerade aus den einzelnen Standards gebildet werden. Einfachheitshalber liegen alle Messwerte aus der Tabelle genau auf einer Geraden, also spielt es keine Rolle, welche Werte man zur Regression benutzt. Als Beispiel wird im Folgenden die Funktionsgleichung für die Kalibiriergeraden von Aceton erstellt:⚠ $y=mx+b$
Zunächst werden 2 Gleichungen mit jeweils 2 Unbekannten erstellt. Der Y-Wert ist hierbei jeweils die Peakfläche und der X-Wert die Konzentration. Im Falle von Aceton also:⚠ $I: 11681,64 = m \cdot 0,2+b$ ⚠ $II: 31175,94 = m \cdot 0,5+b$
Dieses Gleichungsystem wird nun gelöst. Hierfür wird Gleichung I nach b umgestellt und in II eingesetzt. Wir erhalten also⚠ $31175,94=0,5m + 11681,64-0,2m$
Diese Gleichung muss nun nach m umgestellt und aufgelöst werden. Das Ergebnis ist m=64981.
Nun wird der Y-Achsenabschnitt bestimmt. Hierzu nehmen wir den 3, in den anderen beiden Gleichungen noch nicht benutzten, Teil der Tabelle. Wir setzen alle bekannten Werte in die Gleichung y=mx+b ein und erhaten so:⚠ $63666,44=64981\cdot1,0+b$
Diese Gleichung nach b umstellen und auflösen. So erhalten wir am Ende folgende Kalibriergeradengleichung für Aceton:
f(x)Aceton=64981x-1314,56
Die anderen Kalibriergeraden werden auf die gleiche Weise berechnet. Die Ergebnisse lauten:
f(x)Acetaldehyd=84193x-1753
f(x)Formaldehyd=46134x+793
f(x)Ethanol=11714x+157
f(x)Benzol=57149x-954,76
Zur Berechnung der Stoffmengenkonzentration in der Probe muss lediglich die Peakfläche der Probenmessung mit der Geradengleichung der jeweiligen Substanz gleichgesetzt werden und nach X aufgelöst werden. Dies wird wieder am Besipiel von Aceton gezeigt:⚠ $54792=64981x-1314,56 | +1314,56$⚠ $56106,56=6491x | :64981$⚠ $x=0,8634302335$
In der Probe sind also ca 0,86 mol/L Aceton enthalten. Die Ergebnisse für die anderen Rechnungen lauten:
cAcetaldehyd= 0,8531706912 mol/L
cFormaldehyd= 0,5195734166 mol/L
cEthanol= 0,4509134369 mol/L
cBenzol= 0,8848231815 mol/L
Einzelnachweise
Welche Quellen wurden verwendet.
1 vgl. Skript: Seminar zur Praktikum Instrumentelle Analytik Gaschromatographie SoSe22, Katharina Beier, S.3 und S.11 ⇑
2 vgl. Skript: Seminar zur Praktikum Instrumentelle Analytik Gaschromatographie SoSe22, Katharina Beier, S.5ff ⇑
3 vgl. Skript: Seminar zur Praktikum Instrumentelle Analytik Einführung Massenspektrometrie SoSe22, Finja Krebs, S. 23ff ⇑
4 Eigene Abbildung von Janosch Auer ⇑
5 vgl. Skript: Seminar zur Praktikum Instrumentelle Analytik Gaschromatographie SoSe22, Katharina Beier,S.30 und S.32 ⇑
6 vgl. Skript: Seminar zur Praktikum Instrumentelle Analytik Gaschromatographie SoSe22, Katharina Beier, S.5ff ⇑
7 vgl. Skript: Seminar zur Praktikum Instrumentelle Analytik Gaschromatographie SoSe22, Katharina Beier, S.6f ⇑
8 vgl. Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; Kapitel 19.2.2 ⇑
9 Eigene Abbildung von Jule Schaarschmidt ⇑
10 vgl. Skript: Seminar zur Praktikum Instrumentelle Analytik Gaschromatographie SoSe22, Katharina Beier, S.4 ⇑
11 vgl. Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; Kapitel 19.2.2 ⇑
12 vgl. Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; Kapitel 19.5 ⇑
13 vgl. Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Auflage 5; Kapitel 19.3.3 ⇑
14 Eigene Aufgabe und eigene Werte von Philipp Finkbeiner ⇑
15 vgl.https://www.analytik.ethz.ch/vorlesungen/biopharm/Trennmethoden/AnalytischeChemie_Skript_4_GC.pdf, letzter Abruf 29.05.2022, 20:00 Uhr ⇑
16 vgl. Skript: Seminar zur Praktikum Instrumentelle Analytik Gaschromatographie SoSe22, Katharina Beier, S.44 ⇑
17 vgl.https://de.wikipedia.org/wiki/Standard-Additionsverfahren, letzter Abruf 18.06.2022, 14:30 Uhr ⇑
18 Eigene Aufgabe und eigene Werte von Philipp Finkbeiner ⇑