Dünnschichtchromatographie
Titelblatt
Übung
DC-Dünnschichtchromatographie
SoSe 2022
Abgabedatum
20.06.2022
Expertengruppe 10
Julius Hanselle
Julius Kahl
Felix Breitung
Inhaltsverzeichnis
Alle Lösungen sind eingeblendet. Alle Lösungen ausblenden
Multiple Choice (MC) Fragen
Detektion von Analysesubstanzen
Welche Aussage bezüglich der Detektion von Analysesubstanzen auf der DC-Platte trifft zu?
- Der Analysesubstanz können Stoffe zugemischt werden, die unter einer UV-Lampe bei 850 nm zu Eigenfluoreszenz neigen.
- Bei der Lumineszenzminderung werden Indikatoren der DC-Oberfläche zugemischt, welche die Oberfläche abdunkeln, sodass die Substanzen als helle Flecken zu sehen sind.
- Die Indikatoren im Rahmen der Lumineszenzminderung können entweder zur Fluoreszenz oder Phosphoreszenz angeregt werden.
- Werden der Analysesubstanz fluoreszierende Substanzen beigemischt, leuchten die Flecken selbst nach Ende der Bestrahlung kurzfristig weiter.
- Für die Analysenauswertung eignet sich eine Infrarot-Lampe.
Antwort C ist korrekt.
850nm befinden sich nicht im UV- Bereich, die Strahlung kann stattdessen eine Wellenlänge von 366nm haben (A).
Die Indikatoren im Rahmen der Lumineszenzminderung hellen die Oberfläche auf, sodass die Proben als dunkle Flecken erscheinen (B).
Die Indikatoren sind in der Lage zu fluoreszieren bzw. zu phosphoreszieren (C).
Es leuchten nur Substanzen nach Ende der Bestrahlung, wenn phosphoreszierende Stoffe beigemischt werden (D).
Zur Auswertung wird ausschließlich UV-Spektroskopie verwendet, da IR-Strahlung nicht zur Fluoreszenz oder Phosphoreszenz anregt (E).
Vorbereitung einer Dünnschichtchromatographie
Welche Aussagen bezüglich der Vorbereitung einer Dünnschichtchromatographie treffen zu?
- Die mobile Phase wird auch als Sorbens bezeichnet.
- Kieselgel wird sehr häufig als stationäre Phase verwendet.
- Die Unregelmäßigkeit der Kieselgel-Körner verbessert die Retention der Substanzen.
- Kieselgel kann mit verschiedenen Chlorsilanen zu einer Umkehrphase modifiziert werden.
- Cellulose kann als Sorbens eingesetzt werden.
- nur 1 und 3
- nur 2, 3 und 5
- nur 2, 4 und 5
- nur 1, 2, 4 und 5
- 1 bis 5 (alle)
Antwort C ist korrekt.
Die stationäre Phase wird als Sorbens bezeichnet, die mobile Phase heißt auch Eluent (1).
Kieselgel wird in der Dünnschichtchromatographie sehr häufig als stationäre Phase eingesetzt (2).
Kieselgel-Körner müssen möglichst gleichmäßige Oberflächen und Größen haben, um die Retention zu verbessern (3).
Die Modifikation von Kieselgel mit Chlorsilanen zu einer Umkehrphase findet in den zwei Schritten Silanisierung und Endcapping statt. Die Silanisierung von Kieselgel führt dazu, dass die Oberfläche unpolarer wird. Beim Endcapping werden die letzten freien Hydroxylgruppen durch kürzere Chlorsilane besetzt und die Oberfläche somit noch unpolarer gemacht (4). 2
Cellulose kann in der Dünnschichtchromatographie als stationäre Phase eingesetzt werden (5).
Entwicklung der DC-Platte
Welche Aussagen bezüglich der Entwicklung der DC-Platte treffen zu?
- Der
⚠ $ R_f $-Wert gibt das Verhältnis zwischen Laufstrecke der Analysensubstanz und DC-Plattenlänge wieder. - Die Entwicklung der DC-Platte kann mit oder ohne vorheriger Kammersättigung erfolgen.
- Der Abstand zwischen Startlinie und Boden der DC-Platte beträgt in der Regel 1 mm.
- Ist die Probe nicht vom Startpunkt gewandert, kann ein Fehler die falsche Wahl der mobilen Phase sein.
- Als Verbesserung zum
⚠ $ R_f $-Wert gibt der⚠ $ R_{st} $-Wert das Verhältnis zwischen der Laufstrecke der Analysensubstanz und der Laufstrecke des Standards wieder.
- nur 4
- nur 1 und 3
- nur 1, 4 und 5
- nur 2, 4 und 5
- 1 bis 5 (alle)
Antwort D ist korrekt.
Der ⚠ $ R_f $-Wert gibt das Verhältnis zwischen Laufstrecke der Analysensubstanz und Fließmittelfront an (1).
Auch wenn die Kammersättigung vor der Entwicklung einer DC-Platte empfohlen wird, kann dies auch ohne Kammersättigung erfolgen (2).
Der Abstand zwischen Startlinie und Boden beträgt meist 1cm, da die Analyse nicht in die mobile Phase reichen darf (3).
Bei einer polaren Probe auf Kieselgel darf die mobile Phase nicht zu unpolar sein, da sonst die Wechselwirkungen zwischen Probe und stationärer Phase nicht unterbrochen werden. Andererseits fließt die Probe bei einer zu stark polaren mobilen Phase mit der Fließmittelfront (4).
Der ⚠ $ R_{st} $-Wert berechnet sich durch den Quotienten aus Laufstrecke der Analysensubstanz und der Laufstrecke des Standards und minimiert äußere Einflüsse (5).
Elutrope Reihe
Welche Reihenfolge ist korrekt bezüglich der Polarität der mobilen Phase in aufsteigender Reihenfolge?
- Hexan < Aceton < Acetonitril < Wasser
- Acetonitril < Hexan < Wasser < Aceton
- Wasser < Aceton < Acetonitril < Hexan
- Acetonitril < Aceton < Hexan < Wasser
- Hexan < Acetonitril < Aceton < Wasser
Antwort E ist korrekt
Hexan hat die geringste Polarität (höchste Lipophilie), während Wasser die höchste Polarität hat (geringste Lipophilie). Aceton ist aufgrund der Carbonylverbindung polarer als Acetonitril. 7 8
Allgemeine Frage zur Trennung
Welche Aussage bezüglich der Trennung trifft nicht zu?
- Die Dünnschichtchromatographie wird auch als inneres Chromatogramm bezeichnet.
- Dünnschichtchromatographie eignet sich auch zur Trennung von Enantiomeren.
- Die Geschwindigkeit des Fließmittels der mobilen Phase nimmt im Laufe der Trennung ab.
- Lösemittel können mithilfe des Lösungsmitteldreiecks anhand der drei Kategorien H-Akzeptor, H-Donator und H-Brückenbindungen unterteilt werden.
- Für eine Dünnschichtchromatographie kann Aluminiumoxid als stationäre Phase verwendet werden.
Antwort D ist korrekt
Der Analyt verbleibt nach Auftrennung im chromatographischen System und wird dort erfasst. Im Gegensatz dazu wird z.B. die HPLC als äußeres Chromatogramm bezeichnet, da der Analyt das chromatographische System nach der Trennung verlässt und im anschließenden Detektor erfasst wird. (A).
Zum Beispiel ist reine Cellulose optisch aktiv und kann daher Enantiomere trennen (B).
Die Flussgeschwindigkeit des Fließmittels ist anfangs noch hoch und sinkt aufgrund von Kapillarkräften mit zunehmender Höhe der Fließmittelfront (C).
Lösemittel können mithilfe des Lösungsmitteldreiecks anhand der drei Kategorien H-Akzeptor, H-Donator und Dipol-Wechselwirkung unterteilt werden (D).
Aluminiumoxid kann als stationäre Phase verwendet werden, da es wie Kieselgel zu den ionisch-polaren Adsorbenzien gehört (E).
Textaufgaben
Einfluss der Polarität auf die Retention
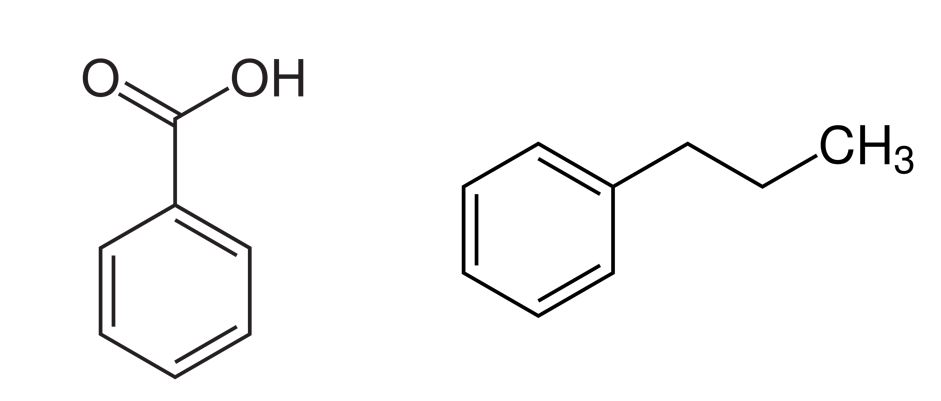
- Welche Struktur wird den höheren
⚠ $ R_f $-Wert haben? (Kieselgel; Laufmittel: Toluen)
Die Strukturen sind unterschiedlich stark polar.
Die stationäre Phase Kieselgel ist polar. Daher werden Strukturen, die polare funktionelle Gruppen haben, mit dem Kieselgel wechselwirken und langsamer auf der DC-Platte wandern (niedriger ⚠ $ R_f $-Wert). Benzoesäure hat eine Carboxygruppe als funktionelle Gruppe, die sehr polar ist. Der ⚠ $ R_f $-Wert wird niedrig sein. n-Propylbenzol hat eine aliphatische Propylgruppe, die lipophil ist und daher nicht mit dem Kieselgel wechselwirken wird (hoher ⚠ $ R_f $-Wert). Das unpolare Fließmittel Toluol hat eine hohe Elutionskraft auf das unpolare n-Propylbenzol. 14 15
- Wie verändert sich der
⚠ $ R_f $-Wert, wenn RP-18 als stationäre Phase und Methanol als mobile Phase gewählt wird?
Hier liegt eine Umkehrphase als stationäre Phase vor, die jetzt unpolar ist und damit mit unpolaren Substanzen wechselwirken kann. Daher weist nun die Substanz eine höhere Retention vor, die unpolarer ist und dies ist n-Propylbenzol (niedriger ⚠ $ R_f $-Wert). Benzoesäure hingegen ist polar und wandert mit dem polaren Fließmittel Methanol mit und hat damit einen hohen ⚠ $ R_f $-Wert. 16 17
- An beide Strukturen wird eine Hydroxygruppe angehängt. Welchen Effekt hat die zusätzliche Gruppe auf den
⚠ $ R_f $-Wert? (Kieselgel; Laufmittel: Toluen)
Eine Hydroxygruppe ist polar und kann mit polaren stationären Phasen wie Kieselgel wechselwirken. Bei beiden Strukturen wird dies zu einem niedrigeren ⚠ $ R_f $-Wert führen, da die Retention zunimmt und die Substanzen weniger stark wandern werden. 18
- Bitte ordnen Sie die beiden oben abgebildeten Strukturen sowie Phenol und Benzoesäuremethylester in die Elutionsreihe nach steigendem
⚠ $ R_f $-Wert ein (Kieselgel; Laufmittel: Toluen).
Die Elutionsreihe nach steigendem ⚠ $ R_f $-Wert: Benzoesäure < Phenol < Benzoesäuremethylester < n-Propylbenzol. Phenol ist ein Benzenring mit einer polaren Hydroxygruppe und wird daher mit der stationären Phase stärker wechselwirken als Benzoesäuremethylester. 19 20
Rechenaufgabe
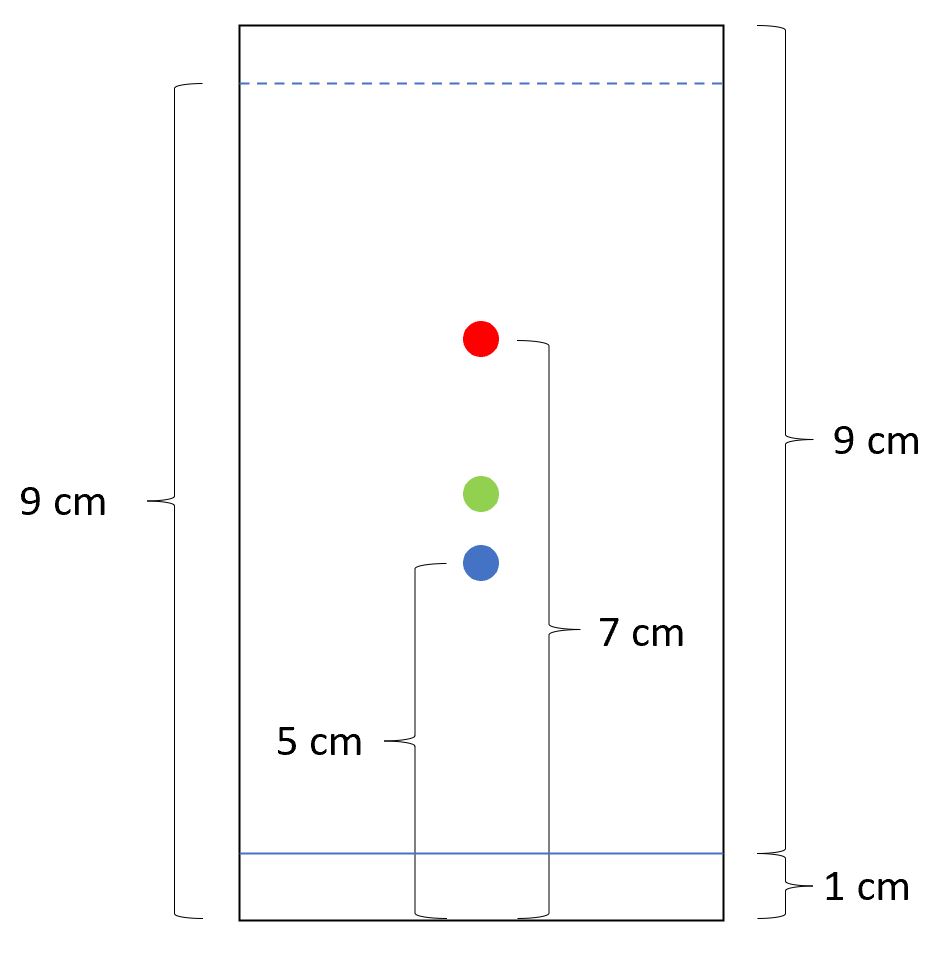
DC-Platte: Analysensubstanzen (rot und blau); Standard (grün); stationäre Phase: RP-18; Laufmittel: Methanol 21
- Bitte vervollständigen Sie den folgenden Lückentext:
Die blaue Substanz hat einen _______ ⚠ $ R_{st} $-Wert als die rote Substanz. Dies liegt daran, dass die blaue Substanz _______ ist als die rote Substanz und daher stärker mit der unpolaren _______ Phase wechselwirkt. Würde Kieselgel als Sorbens eingesetzt werden und Toluol als mobile Phase, dann würde die blaue Substanz _______ fließen als die rote Substanz.
- Wieso kann es sinnvoll sein, den
⚠ $ R_{st} $-Wert anstelle des⚠ $ R_f $-Wertes zu berechnen?
Da eine Standardsubstanz eingesetzt wird, liefert der ⚠ $ R_{st} $-Wert eine systemunabhängige und reproduzierbare Aussage. Der ⚠ $ R_{st} $-Wert ist weniger anfällig gegenüber beispielsweise Temperaturschwankungen oder Luftfeuchtigkeit als der ⚠ $ R_f $-Wert. Daher ist die Aussage des ⚠ $ R_f $-Wertes schlecht auf andere Chromatographien übertragbar, wenn diese nicht unter den exakt gleichen Bedingungen durchgeführt wurden. 23
- Bitte berechnen Sie die
⚠ $ R_f $-Werte für beide Substanzen sowie den⚠ $ R_{st} $-Wert für die blaue Substanz. Der⚠ $ R_{st} $-Wert für die rote Substanz beträgt⚠ $ \left(\frac{4}{3}\right) $.
⚠ $ R_f $-Wert blau: ⚠ $ \left(\frac{4}{8}\right) = 0,5 $
⚠ $ R_f $-Wert rot: ⚠ $ \left(\frac{6}{8}\right) = 0,75 $
⚠ $ R_{st} $-Wert rot: ⚠ $ \left(\frac{4}{3}\right) $ -> Strecke Standard: ⚠ $ \left(\frac{6}{\left(\frac{4}{3}\right)}\right) = 4,5 $
⚠ $ R_{st} $-Wert blau: ⚠ $ \left(\frac{4}{4,5}\right) = \left(\frac{8}{9}\right) $ 24
- In einem weiteren Schritt wurde die DC-Platte um 90° gedreht und mit derselben stationären und mobilen Phase erneut chromatographiert. Die rote Analysensubstanz ist nun auf der gleichen Höhe wie die blaue. Was kann ein möglicher Grund sein?
Ein möglicher Grund kann die Instabilität der roten Analysesubstanz sein, die über einen gewissen Zeitraum auftreten kann. Der Fleck der roten Analysensubstanz hätte bei normaler Stabilität höher sein müssen als der Fleck der blauen Substanz. 25
- Bei einer Substanz, die saure oder basische Eigenschaften hat, ist eine Schwanzbildung zu erkennen. Wie heißt dieses Phänomen? Was sind mögliche Konsequenzen?
Beim Tailing verschwimmen Substanzflecken, da dissoziierte Teile des Analyten im Fließmittel eine andere Elution aufweisen als nicht dissoziierte Teile. Die Trennung wird ungenau. Durch die Zugabe von 1-2% eines Modifiers zum Fließmittel kann die Dissoziation verhindert werden. Bei sauren Analysensubstanzen eignet sich beispielsweise Essigsäure oder Ameisensäure als Zusatz, bei basischen Analysensubstanzen eignet sich konzentrierte Ammoniaklösung oder Diethylamin. 26
Einzelnachweise
1 vgl. Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Kapitel 21.1.2 ⇑
2 vgl. Skript: HPLC, Sebastian Bendas; Folie 59 ⇑
3 vgl. Skript: HPLC, Sebastian Bendas ⇑
4 vgl. Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Kapitel 21.2 ⇑
5 vgl. Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Kapitel 21.2 ⇑
6 vgl. Skript: Dünnschichtchromatographie, Prof. Dr. Hermann Wätzig und Sami Eldeeb ⇑
7 vgl. Skript: Dünnschichtchromatographie, Prof. Dr. Hermann Wätzig und Sami Eldeeb ⇑
8 vgl. Skript: Reaktionsmechanismen der Arzneistoffsynthese und -analytik; Kapitel 2, Prof. Dr. Konrad Kunick ⇑
9 vgl. Skript: HPLC, Sebastian Bendas ⇑
10 vgl. Quantitative Dünnschichtchromatographie; Spangenberg; Kapitel 3.4.9, 2.2 und 3.4.1 ⇑
11 vgl. Skript: Dünnschichtchromatographie, Prof. Dr. Hermann Wätzig und Sami Eldeeb ⇑
12 Wikipedia: Benzoesäure; https://de.wikipedia.org/wiki/Benzoes%C3%A4ure; aufgerufen am 15.05.2022 um 15:05 Uhr; Author: NEUROtiker ⇑
13 Wikipedia: n-Propylbenzol; https://de.wikipedia.org/wiki/N-Propylbenzol; aufgerufen am 16.05.2022 um 15:20 Uhr; Author: Chem Sim 2001 ⇑
14 vgl. Skript: HPLC, Sebastian Bendas ⇑
15 vgl. Skript: Dünnschichtchromatographie, Prof. Dr. Hermann Wätzig und Sami Eldeeb ⇑
16 vgl. Skript: HPLC, Sebastian Bendas ⇑
17 vgl. Skript: Dünnschichtchromatographie, Prof. Dr. Hermann Wätzig und Sami Eldeeb ⇑
18 vgl. Quantitative Dünnschichtchromatographie; Spangenberg; Kapitel 2.2 ⇑
19 vgl. Quantitative Dünnschichtchromatographie; Spangenberg; Kapitel 2.2 ⇑
20 vgl. Skript: HPLC, Sebastian Bendas ⇑
21 Eigene Darstellung von Felix Breitung; erstellt am 16.05.2022 mit Powerpoint ⇑
22 vgl. Skript: Dünnschichtchromatographie, Prof. Dr. Hermann Wätzig und Sami Eldeeb ⇑
23 vgl. Skript: Dünnschichtchromatographie, Prof. Dr. Hermann Wätzig und Sami Eldeeb ⇑
24 vgl. Skript: Dünnschichtchromatographie, Prof. Dr. Hermann Wätzig und Sami Eldeeb ⇑
25 vgl. Skript: Dünnschichtchromatographie, Prof. Dr. Hermann Wätzig und Sami Eldeeb ⇑
26 vgl. Instrumentelle pharmazeutische Analytik; Rücker, Neugebauer, Willems; Kapitel 21.1.2 ⇑