Konduktometrie
Titelblatt
Anwendungsbeispiel
Konduktometrie
WiSe 2022/23
Abgabedatum
09.01.2023
Expertengruppe 11
Pauline Schumacher
Zeqije Miftari
Karl Grabe
Affaf Ezzedine
Anwendungsbeispiel der Konduktometrie aus dem Europäischen Arzneibuch.
Prüfung auf Reinheit von Niedermolekularem Heparin mit der Konduktometrie
Inhaltsverzeichnis
Alle Lösungen sind eingeblendet. Alle Lösungen ausblenden
Stoffcharakterisierung
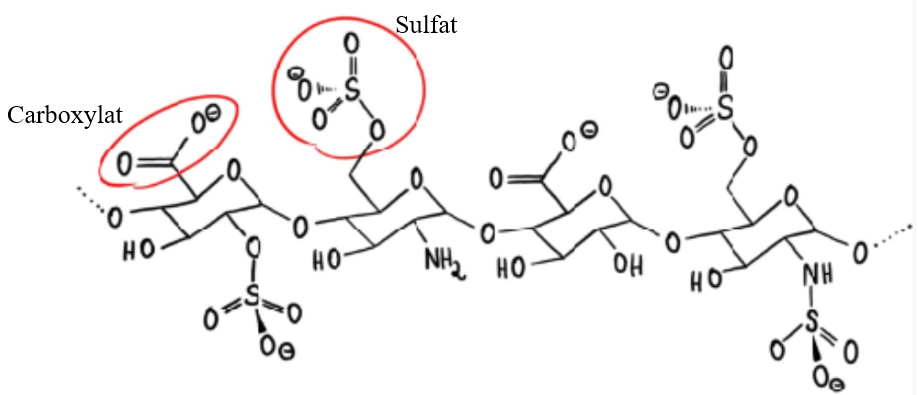
Abb.1: Strukturformel Heparin 1
Niedermolekulare Heparine sind Salze sulfatierter Glycosaminoglycane 2, die zur Gruppe der Antikoagulanzien gehören und aus dem Dünndarm von Schweinen gewonnen werden3. Sie besitzen ein hohes Bestreben mit dem im Körper befindlichen Antithrombin einen Komplex zur Blockierung des Gerinnungsfaktors Xa zu bilden. Niedermolekulare Heparine sind körpereigene Polysaccharide, besitzen im Vergleich zu anderen Heparinen kürzere Kohlenhydratketten und liegt meist als ein weißes bis graues, hygroskopisches Pulver vor. Sie finden Anwendung zur Prophylaxe und Therapie bei thromboembolischen Erkrankungen (z.B. nach Verletzungen oder Operationen) aufgrund ihrer thrombozytenaggregationshemmenden Wirkung. Heparin kann nur parenteral, also intravenös oder subkutan, verabreicht werden, da eine Resorption durch den Magen-Darm-Trakt nicht möglich ist 4. Während der Behandlung mit Heparin sollten keine weiteren Antikoagulanzien wie z.B. Phenprocoumon (Marcumar® ) oder Thrombozytenaggregationshemmer wie Acetylsalicylsäure (Aspirin® ) eingenommen werden, da es sonst zu einer Wirkverstärkung kommt, sowie zur erhöhten Blutungsneigung.
Versuchsdurchführung
Allgemeines zur Prüfung mittels Konduktometrie

Abb.3: Titrationsaufbau 5

Abb.2: Konduktometer 6
Zur Prüfung auf Reinheit von Sulfat- und Carboxylat-Ionen kann laut des Arzneibucheintrags die Konduktometrie verwendet werden (siehe Strukturformel, Abbildung 1). Es werden mittels einer Simultantitration von Hydrogensulfat (stark sauer) und einer Carbonsäure (schwach sauer) die Carboxylat- und Sulfationen quantifiziert (HSO4-= 1,92; COOH = 4,75) 7 . Während der Titration wird die Veränderung des Widerstandes und der daraus resultierenden Leitfähigkeit der Elektrolyten in Lösung gemessen, wobei sich die Gesamtleitfähigkeit der Ionen permanent ändert. Daraus kann man Rückschluss auf die Konzentration nehmen und diese aufgrund dessen berechnen. Es handelt sich um eine Methode ohne elektrochemische Elektrodenreaktion, anders als bei der Amperometrie oder Voltametrie 8. Die Messung erfolgt mit einer angelegten Wechselspannung und oberflächenvergrößerten Elektroden, da so keine Polarisationsspannung entsteht, die eine Messung des Leitwerts bzw. Widerstandes verhindert. Zudem ist es möglich die Messzelle mithilfe von Lösungen bekannter Leitfähigkeit zu kalibrieren, z.B. mit Kaliumchloridlösung 9. Dieses ist allerdings nicht von entscheidender Bedeutung, da es bei der Erkennung der Äquivalenzpunkte nur auf das Verhältnis der Leitfähigkeitswerte ankommt. Zusätzlich ist der Einsatz eines Ionenaustauschers notwendig, um mögliche freie anionische Verunreinigungen zu entfernen, welche die Ausbeute verfälschen könnten 10.
Durchführung der Prüfung auf Reinheit von Sulfat- und Carboxylationen
Das niedermolekulare Heparinsalz wird abgewogen und mit demineralisiertem Wasser verdünnt, welches ständig mit Helium entgast werden muss, um eine Carbonatbildung aus CO2 zu verhindern. Ein Kationenaustauscher wird eingesetzt, um die freien Protonen zu überführen. Anschließend wird mit Natriumhydroxid (0,05mol/l) titriert und weiterhin die Lösung mit Helium entgast. Als Indikator dient die Änderung des Leitvermögens, welches von der Anzahl der Ionen, der Ladungszahl und der Wanderungsgeschwindigkeit abhängig ist. Bei der Durchführung ist darauf zu achten, dass immer eine konstante Temperatur herrscht und verdünnte Probenlösungen verwendet werden, da nur in verdünnten Lösungen ein linearer Zusammenhang zwischen Konzentration der enthaltenen Ionen und der Leitfähigkeit hergestellt werden kann und es zu möglichst wenig Wechselwirkungen zwischen den Ionen kommt 11. Da der Verlauf der Titration von Ionen beeinflusst wird, ist der Verlauf von Art, Konzentration und Dissoziationsverhalten der Elektrolyte abhängig 12. Daher sollte die Titration nicht mit konzentrierter Natriumhydroxidlösung durchgeführt werden, damit sich die Konzentration während des Verlaufes nicht zu stark ändert.
Auswertung
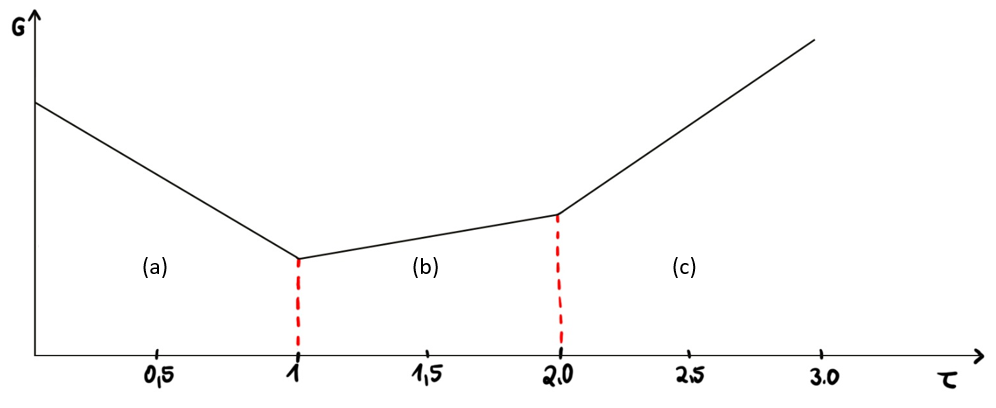
Abb.4: Titrationskurve einer Simultanbestimmung von schwacher und starker Säure 13
Der erste Äquivalenzpunkt beschreibt den Verbrauch an Maßlösung für Hydrogensulfat (a), woraus sich die Massenkonzentration berechnen lässt 14. Das Hydrogensulfat reagiert zunächst in Wasser zu Sulfat- und Oxonium-Ionen, die dann mit der Natriumhydroxid-Maßlösung neutralisiert werden (s. 1.3.2. Reaktionsgleichungen). Dabei ist ein Abfall der Leitfähigkeit zu beobachten, die nach dem ersten Äquivalenzpunkt wieder ansteigt. Nach dem ersten Äquivalenzpunkt wird die Carbonsäure (b) erfasst, die ebenfalls mit der Natriumhydroxid-Maßlösung neutralisiert wird. Allerdings startet hier die Leitfähigkeit etwas niedriger und steigt bis zum zweiten Äquivalenzpunkt schwach an. Nach dem zweiten Äquivalenzpunkt ist ein Überschuss an Natriumhydroxid (c) vorhanden, weshalb der Leitwert einen höheren Anstieg aufweist als bei der Erfassung der Carboxylat-Ionen. Der Verbrauch für die Titration der Carboxygruppe setzt sich aus der Differenz an Maßlösung zwischen dem 1. und 2. Äquivalenzpunkt zusammen 15. Am Ende der Titration wird das Molverhältnis von Carboxylat- und Sulfationen berechnet. Wie in der Monographie gefordert muss dieses mindestens 1,8 betragen, damit die Substanz den Arzneibuchanforderungen entspricht.
Interpretation/ Bedeutung und Eignung
Die Konduktometrie ist ein geeignetes Verfahren zur Prüfung auf Reinheit von Sulfat- und Carboxylat-Ionen, da hier auch schwache Protolyte, wie die Carboxygruppe, in verdünnten Lösungen erfasst werden können. Hier liegen eine schwache und eine starke Säure vor, die als Gemisch mit hoher Empfindlichkeit simultan bestimmt werden können 16. Allerdings können ionische Verunreinigungen das Ergebnis verfälschen, was durch einen zusätzlichen Ionenaustauscher zur Bindung freier Anionen vermieden werden kann 17. Eine Simultantitration ist möglich, da die pks-Werte eine größere Differenz als 3 besitzen 18. Die Hydroxidionen weisen einen Tunneleffekt auf, wobei sie während der Titration nicht selber wandern, sondern lediglich die Ladung weiterreichen. Dies erfolgt aufgrund ihrer hohen Grenzionenäquivalentleitfähigkeit und da sie anders als andere Ionen keine Solvathülle besitzen 19.
Reaktionsgleichungen 20 und Formeln21
Reaktionsgleichungen
HSO4- + H2O → SO42- + H3O+
SO42- + H3O++ 3OH- → SO42-+3 H2O
COOH + OH- → COO- + H2O
Formeln
⚠ $$ G= \frac{1}{R} ⚠ $$
⚠ $$ R= \frac{U - U_P}{I} ⚠ $$
⚠ $$ R= ρ\cdot \frac{L}{S} ⚠ $$
⚠ $$ κ= \frac{1}{ρ} ⚠ $$
⚠ $G:$Leitwert (in reziprok Ohm (Ω-1)oder Siemens (S))
⚠ $R:$elektr. Widerstand (in Ohm (Ω) oder reziprok Siemens (S-1)
⚠ $U:$Spannung
⚠ $U_P:$Polarisationsspannung
⚠ $I:$Stromstärke
⚠ $ρ:$spez. Widerstand
⚠ $L:$Länge
⚠ $S:$Querschnitt
⚠ $κ:$Leitfähigkeit (in S ⋅ cm-1)
Übungsaufgaben
Multiple Choice Fragen
Aufgabe 1
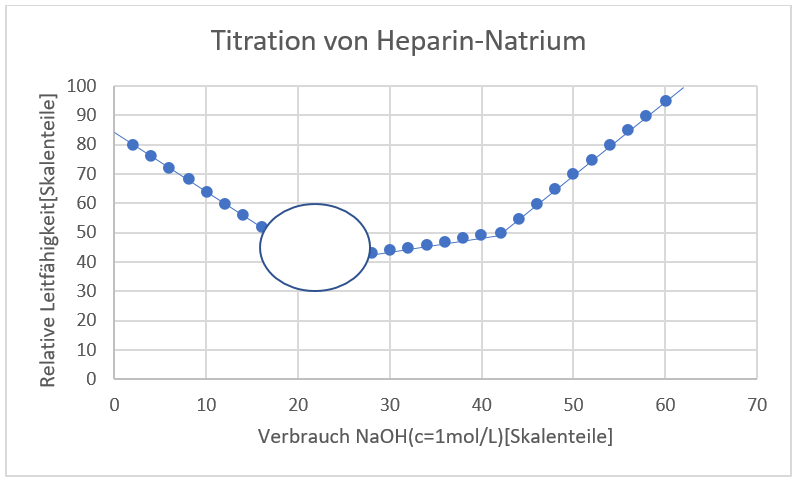
Welchen Verlauf der Titrationskurve erwarten Sie am ersten Äquivalenzpunkt?
(Hinweis: die Lösung wurde mit Helium entgast)
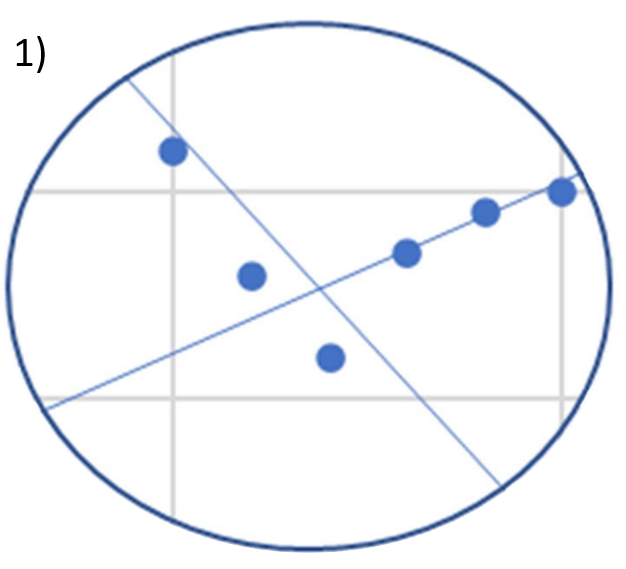
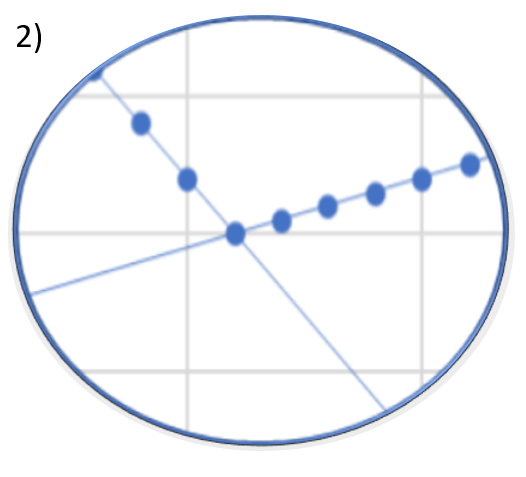
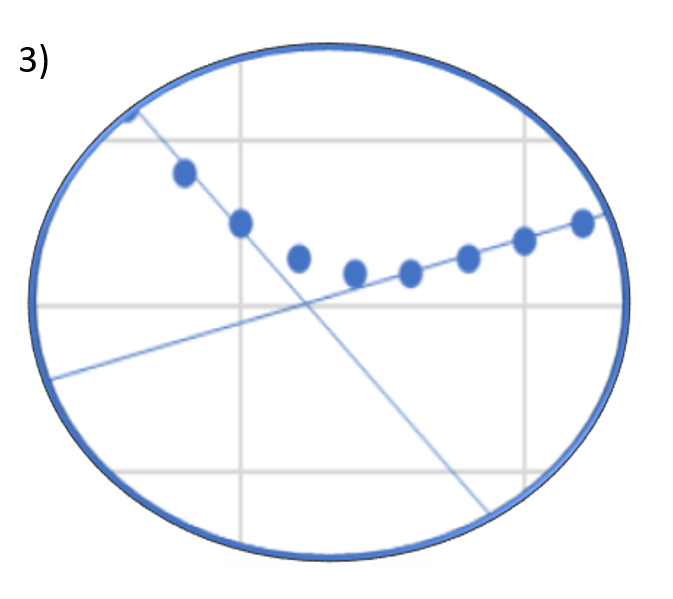
- Lösung 1
- Lösung 2
- Lösung 3
Antwort C ist korrekt
Die Titrationskurve 1) könnte erreicht werden, wenn der Rührfisch zwischenzeitlich aus- und wieder eingeschaltet wurde. Die Titrationskurve 2) kennen wir auch aus unserem Praktikumsversuch Konduktometrie. Die Lösung wurde nicht entgast und eventuell vorhandenes Carbonat, entstanden aus dem CO2 aus der Luft, verfälscht die Leitfähigkeit am Äquivalenzpunkt nach oben.
Aufgabe 2
Es wurde Heparin-Natrium mit einer Simultantitration titriert, um enthaltene Ionen zu quantifizieren.
Abgebildet ist eine Titrationstabelle und der dazugehörige Graph (s. Aufgabe 2.b)
a) In welcher Reihenfolge werden die Carboxy-und Hydrogensulfatgruppen titriert?
- Zuerst werden die Carboxy-, dann die Hydrogensulfatgruppen titriert.
- Es werden zuerst die Hydrogensulfat-, dann die Carboxygruppe titriert.
- Die Reihenfolge der Bestimmungen hängt von der Konzentration ab.
Antwort B ist korrekt
Hydrogensulfat ist die stärkere Säure (kleinerer pKs-Wert: 1,92 < ≈4,75)) und wird so als stärkerer Protolyt zuerst bestimmt23.
b) Bestimmen Sie das Molverhältnis der funktionellen Gruppen!
CML=0,1mol/L
FML=1,040
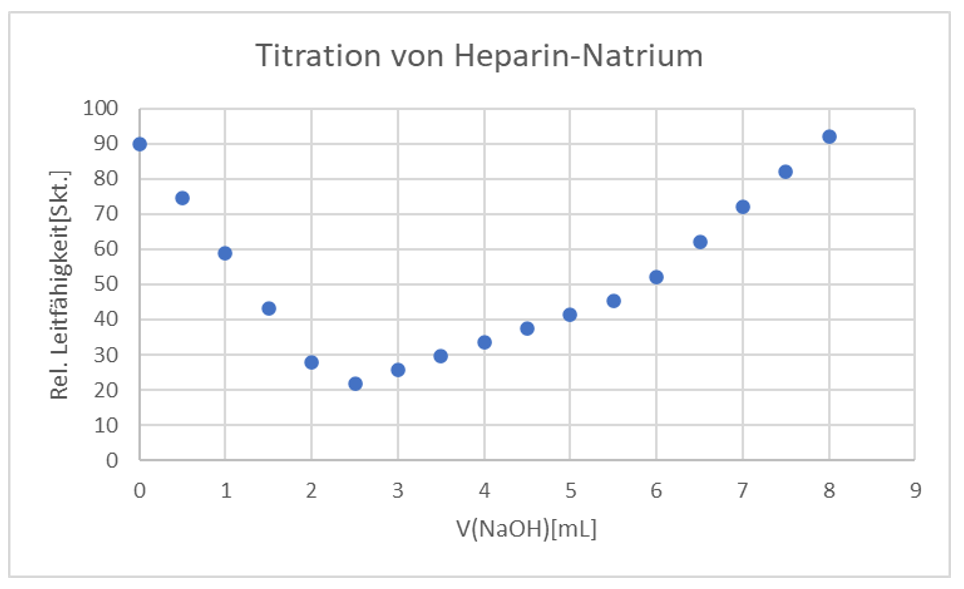
| V(NaOH) in mL | rel. Leitf. (Skt) |
|---|---|
| 0 | 90,000 |
| 0,5 | 74,444 |
| 1 | 58,889 |
| 1,5 | 43,334 |
| 2 | 27,778 |
| 2,5 | 21,944 |
| 3 | 25,833 |
| 3,5 | 29,722 |
| 4 | 33,611 |
| 4,5 | 37,500 |
| 5 | 41,389 |
| 5,5 | 45,278 |
| 6 | 52,220 |
| 6,5 | 62,220 |
| 7 | 72,220 |
| 7,5 | 82,220 |
| 8 | 92,220 |

c. Entspricht das Heparin-Natrium den Anforderungen des Arzneibuchs?
Nein, da 1,556 kleiner 1,8 ist.
Textaufgaben
Aufgabe 1
Nennen Sie die Vor- und Nachteile der Konduktometrie zur Gehalts-/Reinheitsbestimmung. Bewerten Sie die Eignung der Konduktometrie zur Bestimmung des Molverhältnisses von Sulfat-und Carboxylat-Ionen
Beispiellösung:

Aufgabe 2: Vergleich zur Potentiometrie
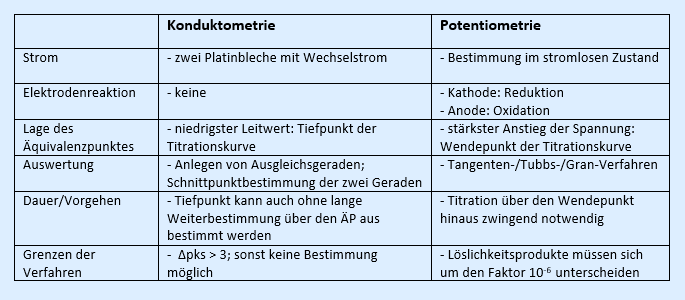
Vergleichen Sie das Verfahren der Konduktometrie mit dem der Potentiometrie (z.B. in Hinsicht auf den Aufbau, das Vorgehen, die Auswertung oder die Grenzen der Verfahren):
Beispiellösung:
Zusatzaufgaben
Ordnen Sie die Faktoren/Reaktionsbedingungen ihrem Einfluss auf den Leitwert bei einer konduktometrischen Bestimmung zu!
Aufgabe 1a
Vor dem 1.ÄP

Faktoren: starkes Rühren, hochkonzentrierte Maßlösung, hohe Ladungszahl der bestimmten Ionen, niedrige Ladungszahl der bestimmten Ionen, hohe Wanderungsgeschwindigkeit, niedrige Ionenbeweglichkeit, hohe Temperatur, großflächige/großporige Elektroden, stark dissoziierende Ionen

.
Aufgabe 1b
Nach dem 1.ÄP

Faktoren: starkes Rühren, hochkonzentrierte Maßlösung, hohe Ladungszahl der bestimmten Ionen, niedrige Ladungszahl der bestimmten Ionen, hohe Wanderungsgeschwindigkeit, niedrige Ionenbeweglichkeit, niedrige Temperatur, hohe Temperatur, großflächige/großporige Elektroden, stark dissoziierende Ionen der Probe

Aufgabe 2
Ordnen Sie zu, an welchem Punkt der Titration welche Ionenzusammensetzung vorliegt.
25
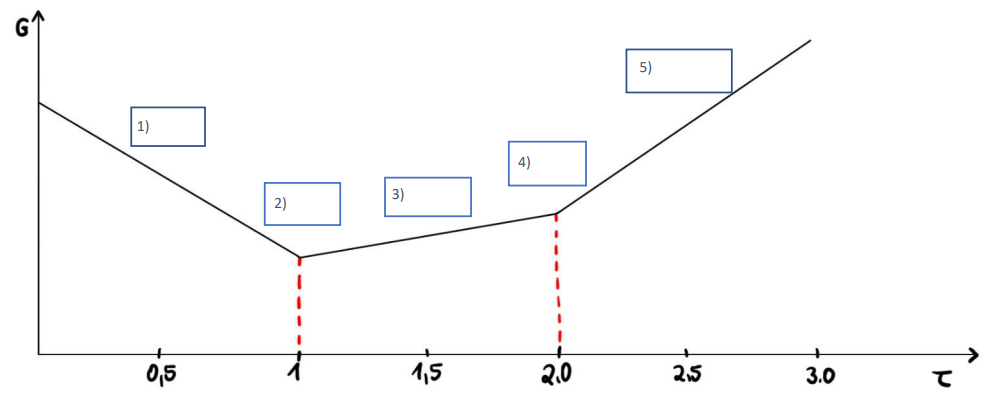
- OH- / COO- / SO42-
- SO42- / H3O+
- COO- / SO42-
- COO- / SO42-
- SO42-
1) B
2) E
3) C / D
4) C / D
5) A
Erläuterung: Zunächst wird die Probe in demineralisiertem Wasser suspendiert. Der stärkere Protolyt, das Hydrogensulfat, erzeugt mit dem Wasser ein H3O+- Ion und wird dabei selbst zu Sulfat umgesetzt. Es liegen also das Sulfat- und H3O+- Ion parallel vor (1). Mit Zugabe der Natriumhydroxidlösung werden die H3O+- Ionen zu Wasser umgesetzt. Am ersten Äquivalenzpunkt sind also nur Sulfationen für die Leitfähigkeit von Bedeutung (2). Mit weiterer Zugabe von NaOH wird nun die Carbonsäure umgesetzt. So entsteht das Carboxylat-Anion (3). Die Konzentration der Carboxylat-Anionen steigt stetig, bis die Carboxygruppen vollständig umgesetzt wurden. Am zweiten Äquivalenzpunkt sind also nur noch die Anionen der deprotonierten Säuren verantwortlich für die Leitfähigkeit der Lösung (4). Nun wird Natriumhydroxid im Überschuss hinzugegeben. Die OH- - Ionen im Überschuss sorgen für den starken Anstieg der Leitfähigkeit. Es liegen also Carboxylat-Ionen und Hydroxidionen in der Lösung neben den immer noch vorhanden Sulfationen vor (5). Natürlich sind zu jedem Zeitpunkt auch Natrium/Calcium-Ionen(Gegenionen zu den Heparin-Anionen) vorliegend und erhöhen die Leitfähigkeit der Lösung. Da sich ihre Konzentration allerdings während der gesamten Titration nicht ändert, sind sie hier nicht aufgeführt.
Quellen
1 Eigene Darstellung von Affaf Ezzedine erstellt am 28.11.2022 ⇑
2 Arzneibuchmonographie am 28.11.2022 um 13:35 ⇑
3 https://www.aerzteblatt.de/nachrichten/78100/Forscher-synthetisieren-veganes-Heparin#:~:text=Heparin%20wird%20heute%20noch%20auf,nach%20der%20BSE%2DEpidemie%20aufgegeben Zugriff: am 28.11.2022 15:11 Uhr ⇑
4 https://www.gelbe-liste.de/wirkstoffe/Heparin_225 Zugriff: am 28.11.2022 15:11 Uhr ⇑
5 Foto von Karl Grabe erstellt am 10.11.2022 ⇑
6 Foto von Pauline Schumacher erstellt am 18.11.2022 ⇑
7 https://www.gr.ch/DE/institutionen/verwaltung/ekud/ahb/bks/ausbildung/fachschaften/chemie/Schuelermaerial/pks-tabelle.pdf Zugriff am 08.01.2023 ⇑
8 Analytik 2,Eberhard Ehlers,10.Auflage, Deutscher Apotheker Verlag 2002 Zugriff: am 24.11.2022 15:11 Uhr ⇑
9 Einführung in die instrumentelle Analytik Skript, Dr. Orban, TU Braunschweig Zugriff: am 24.11.2022 15:11 Uhr ⇑
10 Arzneibuchmonographie Zugriff am 24.11.2022 15:11 Uhr ⇑
11 Einführung in die instrumentelle Analytik Skript, Dr. Orban, TU Braunschweig Zugriff am 24.11.2022 15:11 Uhr ⇑
12 Analytik 2,Eberhard Ehlers,10.Auflage, Deutscher Apotheker Verlag 2002 Zugriff am 24.11.2022 15:11 Uhr ⇑
13 Eigene Darstellung von Affaf Ezzedine erstellt am 28.11.2022 ⇑
14 Praktikumsskript Instrumentelle Analytik, Dr. Kellner, TU Braunschweig Zugriff: am 25.11.2022 10:11 Uhr ⇑
15 Praktikumsskript Instrumentelle Analytik, Dr. Kellner, TU Braunschweig Zugriff: am 25.11.2022 10:11 Uhr ⇑
16 Instrumentelle pharmazeutische Analytik, 3.Auflage, Rücker, Neugebauer, Willems, Wissenschaftliche Verlagsgesellschaft mbH Stuttgart 2001 Zugriff am 25.11.2022 10:11 Uhr ⇑
17 Arzneibuchmonographie Zugriff am 25.11.2022 10:11 Uhr ⇑
18 Praktikumsskript Instrumentelle Analytik, Dr. Kellner, TU Braunschweig Zugriff am 25.11.2022 10:11 Uhr ⇑
19 Praktikumsskript Instrumentelle Analytik, Dr. Kellner, TU Braunschweig Zugriff am 25.11.2022 10:11 Uhr ⇑
20 Einführung in die instrumentelle Analytik Skript, Dr. Orban, TU Braunschweig am 25.11.2022 12:45 Uhr ⇑
21 Einführung in die instrumentelle Analytik Skript, Dr. Orban, TU Braunschweig am 25.11.2022 12:45 Uhr ⇑
22 Grafiken von Karl Grabe erstellt am 25.11.2022 ⇑
23 https://studyflix.de/chemie/pks-wert-1642 am 25.11.2022 12:45 Uhr ⇑
24 Grafiken von Karl Grabe erstellt am 25.11.2022 ⇑
25 Grafiken von Karl Grabe erstellt am 25.12.2022 ⇑