Raman-Spektroskopie
Titelblatt
Bericht der Expertengruppe für
Raman-Spektroskopie
SoSe 2021
Abgabedatum
21.06.2021
Über-/Expertengruppe 12
Jan-Niclas Kittner
Christopher Kasselmann
Todor Atanasov
Dalal Basal
Raik Sperling
Omar Elmahdy
Raman-Spektroskopie
Inhaltsverzeichnis
Einleitung
Die Raman-Spektroskopie ist eine Methode der Schwingungsspektroskopie und beruht auf der inelastischen Streuung von Licht. Also der Emission von elektromagnetischer Strahlung mit veränderter Frequenz gegenüber der Anregungsfrequenz. Sie wurde 1928 erstmals von dem indischen Physiker C.V. Raman experimentell nachgewiesen. Über die Messung der sogenannten Raman-Streuung lassen sich qualitative und quantitative Untersuchungen sowie Strukturaufklärungen durchführen. 1
Grundlagen
Bei Bestrahlung einer Probe mit intensivem monochromatischen Licht wird ein Teil des Lichts an den Molekülen gestreut. 0,01% des Anregungslichts wird dabei als elektromagnetische Strahlung der gleichen Energie durch eine elastische Streuung von den Photonen an den Molekülen abgestrahlt, dies ist die Rayleigh-Streuung. Nur ein Anteil von 10-3% bis 10-6% der gesamten eingestrahlten Photonen verändert über inelastische Streuung an den Molekülen seine Energie, es handelt sich um die Raman-Streuung. Der Betrag der Frequenzverschiebung ist dabei in beide Richtungen gleich groß (Raman-Verschiebung). Erhöht sich die Frequenz, spricht man von der Anti-Stokes-Streuung. Bei dem größeren Anteil der Raman-Streuung verringert sich aber die Frequenz, es handelt sich um die Stokes-Streuung. Aufgrund der allgemein geringen Intensität verwendet man bei Messungen mit der Raman-Spektroskopie die Stokes-Streuung.
Zum Auftragen und Auswerten in einem Raman-Spektrum werden die Wellenzahldifferenzen des Anregungslichtes und der Stokes-Streuung verwendet. Da diese Verschiebungen charakteristisch für die untersuchten Moleküle sind, lassen sich qualitative Informationen unter Einbezug der Moleküleigenschaften gewinnen. Relevant sind dabei auch Aggregatzustand und z.B. die Kristallmodifikation oder Partikelgröße der Probe. Quantitative Bestimmungen sind aufgrund der direkten Proportionalität von Signalintensität und Konzentration zueinander möglich. 2 3 4
Physikalische Betrachtung
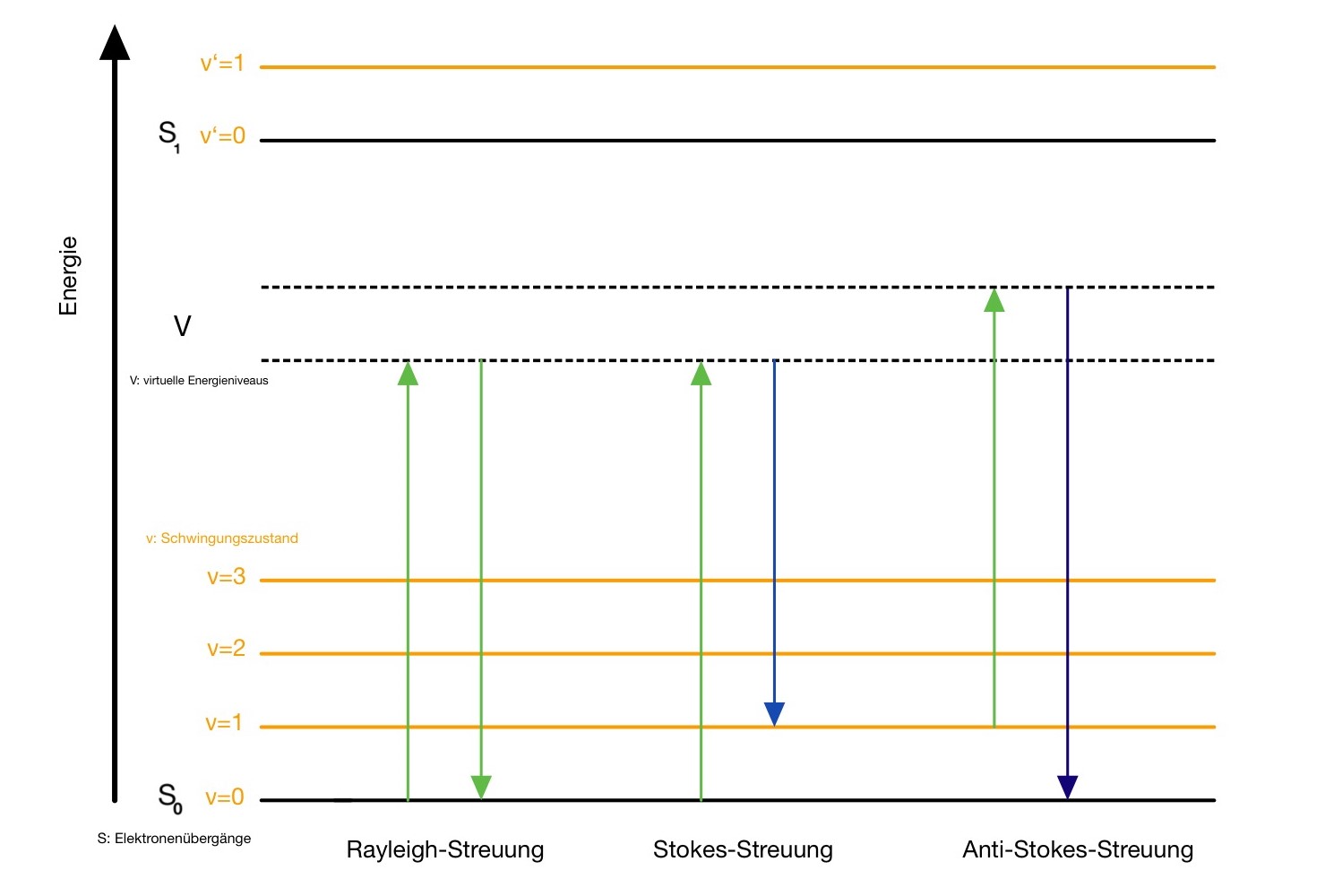
Physikalisch betrachtet handelt es sich bei der Raman-Streuung um einen Zwei-Photonen-Prozess. Das erste Photon überträgt seine Energie auf ein Molekül und hebt dieses so in ein virtuelles Energieniveau (V) an (Abb. 1). Energetisch befindet sich dieses Niveau zwischen dem Grundzustand (S0 ) und dem ersten angeregten Elektronenzustand (S1 ). Dabei ist das virtuell Energieniveau aber nicht gequantelt. Deshalb können Moleküle innerhalb dieses Bereichs einen beliebigen, von der Anregungsfrequenz abhängigen, Energiezustand annehmen. Im üblichen Fall der Rayleigh-Streuung kehrt das Molekül durch Aussendung eines zweiten Photons entsprechend der Anregungsfrequenz wieder in den Grundzustand zurück. Deutlich seltener kommt es zum Absinken in einen schwingungsangeregten Grundzustand (S0 , ν=1). Das ausgesendete Photon ist energieärmer als das Anregungsphoton und hat entsprechend eine geringere Frequenz, weshalb es der Stokes-Streuung angehört.
Kommt es zu einer Anregung aus einem bereits angeregten Schwingungszustand (S0 , ν=1) und darauffolgendem Absinken in den Grundzustand (S0 , ν=0), so hat das ausgesendete Photon eine größere Energie und Frequenz als das Anregungsphoton. Es handelt sich um die Anti-Stokes-Streuung.
Bei Raumtemperatur befindet sich der überwiegende Anteil der Moleküle im nicht angeregten Grundzustand. Deshalb ist die Wahrscheinlichkeit für eine Stokes-Streuung deutlich höher, als für eine Anti-Stokes-Streuung. Dies spiegelt sich auch in der Intensität wider. 6 7 8
Chemische Betrachtung
Damit es an Molekülen zur Raman-Streuung kommen kann, muss diese einen Teil des eingestrahlten Lichts absorbieren und es danach auch wieder emittieren können.
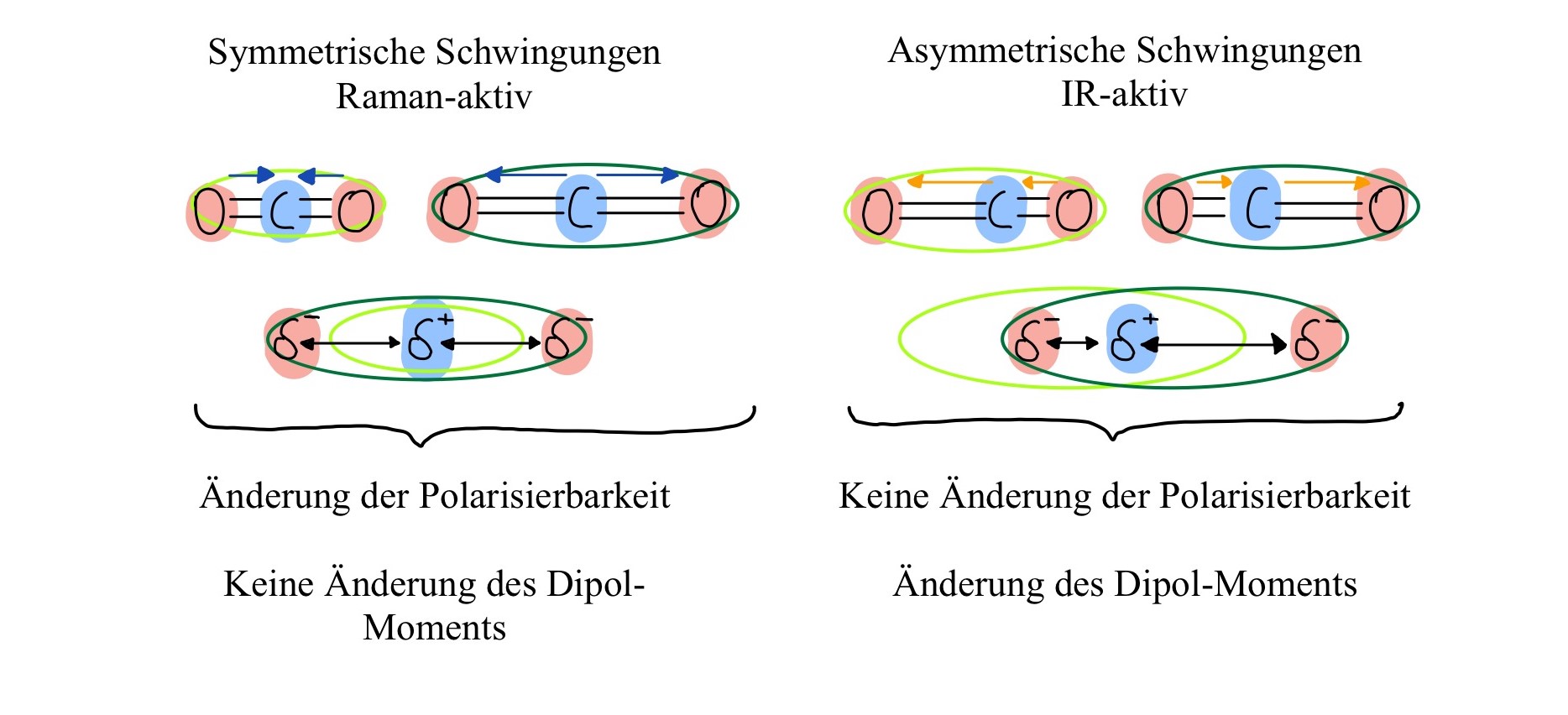
Dazu muss die Elektronenhülle der betroffenen Atomgruppe beim Schwingen ihre Polarisierbarkeit (Deformierbarkeit der Elektronenhülle) verändern, während das Dipol-Moment (Maß für die räumliche Ladungstrennung bzw. Polarität in einem Molekül10) konstant bleibt. Raman-aktiv sind damit vor allem Moleküle mit symmetrischen Valenzschwingungen (Dehnung/Stauchung einer Bindung; siehe Abb. 2) apolarer Atomgruppen, wie zum Beispiel C-H, C-C oder C=C. In Abb.2 soll die Elektronenhülle durch die grünen Ovale dargestellt sein. Deren Größe verändert sich während einer symmetrischen Schwingung, sodass sich auch die Polarisierbarkeit ändert. Denn bei einer ausgedehnten Elektronenhülle kann sich die gleiche Mengen an Ladung, im Vergleich zu einer verengten Elektronenhülle, besser bewegen. Das Molekül ist also besser polarisierbar. Der Dipol-Moment hingegen bleibt erhalten. Die beiden negativen Ladungsschwerpunkte (Sauerstoffatome; rot) bewegen sich entweder beiden auf den positiven Ladungsschwerpunkt (Kohlenstoffatom; blau) zu oder von ihm weg. So ändert sich die Ladungsverteilung insgesamt nicht. Das Dipol-Moment bleibt also konstant. 11 12 13
Vergleich mit der IR-Spektroskopie
Die IR-Spektroskopie ist ebenfalls eine schwingungsspektroskopische Methode. Mit ihr werden aber vornehmlich die Raman-inaktiven, asymmetrischen Schwingungen polarer Atomgruppen gemessen (siehe Abb.2). Deshalb bezeichnet man Raman- und IR-Spektroskopie als komplementär zueinander. Beide Methoden ergänzen sich über die unterschiedlichen angeregten Schwingungen in der Untersuchung von Substanzen, besonders zur Strukturaufklärung.
Ein großer Vorteil der Raman-Spektroskopie ist die sehr geringe Intensität der Wasserbanden. Da Wasser eine polare Verbindung ist, führt sie zu starken Störungen in der IR-, nicht doch in der Raman-Spektroskopie, sodass auch wässrige Lösungen vermessen werden können. Außerdem ist die Verwendung von Glasgeräten, wie z.B. Glasfibersonden möglich, welche in der IR-Spektroskopie für den verwendeten Strahlungsbereich undurchlässig sind. Aus diesen Gründen lassen sich Messungen in der Raman-Spektroskopie ohne Probenvorbereitungen durchführen. 14 15
Instrumenteller Aufbau
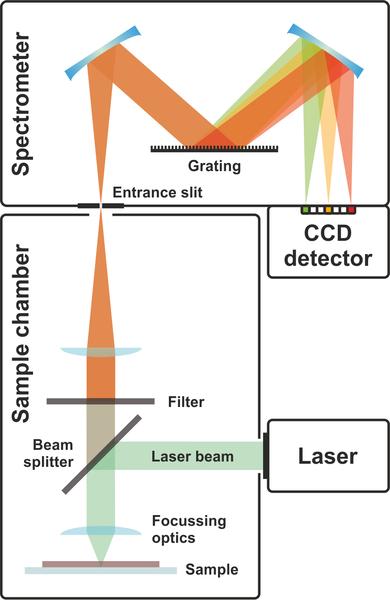
Im Allgemeinen ist das Raman-Spektrometer aus einem Laser, einem Probenraum, einem Monochromator, dem Detektor und der elektronischen Datenverarbeitung (EDV) aufgebaut (Abb. 3). Damit ist der apparative Aufbau im Vergleich zu anderen Analyseverfahren relativ aufwändig. Im Nachfolgenden wird auf die einzelnen Bauelemente genauer eingegangen17:
Monochromatische Lichtquelle
Für die Raman-Spektroskopie werden leistungsfähige, gut fokussierbare Laser verwendet. Dies garantiert, dass nur eine gut monochromatisierte Wellenlänge mit einer hohen Intensität ausgestrahlt wird, da die Raman-Streuung selbst nur eine geringe Intensität besitzt.
Die Wahl des zu verwendenden Lasers richtet sich nach der Probenbeschaffenheit. Gebräuchliche Laser sind:
Helium-Neon-Laser
Dieser Laser besteht aus einem dünnen Kapillarrohr, in welchem sich das Helium-Neon-Gasgemisch befindet. Die Enden des Rohrs sind mit zwei planparallelen Platten bedeckt, welche Licht mit einer bestimmten Polarisationsrichtung ohne Verluste durch Reflexion hindurchlassen, d.h. es gibt keinen reflektierten Strahl dieser Polarisationsrichtung.
Das dabei ausgestrahlte Licht befindet sich mit 632,8 nm (roter Wellenlängenbereich) hauptsächlich im sichtbaren Bereich. Darüber hinaus kann der Helium-Neon-Laser im NIR -und IR-Bereich kontinuierlich betrieben werden. 18
Argon-Ionen-Laser
Dieser Laser gehört zu den Edelgas-Ionen-Lasern und besteht aus einer mit Argon gefüllten, vakuumdicht verschweißten Plasmaröhre, die genau wie der Helium-Neon-Laser kontinuierlich betrieben wird. Mit ihm lassen sich die höchsten Strahlungsleistungen im sichtbaren Spektralbereich erzielen. Von den zehn verfügbaren Laserlinien werden zwei bei 488,0 nm (türkiser Wellenlängenbereich) und 514,5 nm (grüner Wellenlängenbereich) für die Raman-Spektroskopie verwendet. 19
Neodym-dotierte Yttrium-Aluminium-Granat-Laser
Der Feststofflaser wird vor allem bei Fourier-Transformations-(FT)-Raman-Geräten eingesetzt, um seine ansonst geringe Intensität auszugleichen. Gemessen wird mit einer Wellenlänge von 1064 nm, also im NIR-Bereich. Mithilfe von Frequenzvervielfachung kann der Laser auch bei Wellenlängen von 532 nm oder 266 nm verwendet werden. Das aktive Medium besteht aus einem Neodym-dotierten Yttrium-Aluminium-Granat-Kristall. Der Laser kann dabei sowohl kontinuierlich als auch impulsbetrieben sein. 20 21
LED-Laser/Laserdiode
Die meisten Laserdioden sind als Kantenemitter zu betrachten, d.h. das Licht verlässt den Kristall an dessen Bruchkante nahe der Oberfläche quer zum Strom. Diese Art von Laser zeichnet sich vor allem durch ihre Leichtigkeit, Robustheit, einfache Bedienung und ihren relativ niedrigen Preis aus. Außerdem sind diese Laser klein und handlich. Der bekannteste Vertreter ist dabei der Gallium-Arsenid-Laser. Je nach verwendetem Halbleiter werden Wellenlängen im Bereich von 800 nm ausgestrahlt. 22
Farbstofflaser
Der Farbstofflaser gehört zu den durchstimmbaren Lasern, d.h. seine Wellenlängen können innerhalb eines bestimmten Bereichs weitgehend kontinuierlich variiert werden. Das optisch aktive Medium besteht dabei aus einem speziellen Fluoreszenzfarbstoff. Je nach Farbstoff können Spektralbereiche vom UV- bis hin zum nahen IR-Bereich abgedeckt werden. 23 24
Probenhalterung
Im einfachsten Fall befindet sich die Analyse auf einem Probenteller oder in einer Glasküvette. Die Strahlung wird dann durch entsprechende Optiken aus Linsen und Spiegeln gesammelt und zum Spektrometer geleitet. Dabei unterscheidet man im Wesentlichen zwei Anordnungen: die 90°-Geometrie und die 180°-Geometrie. Ersteres findet vor allem bei Flüssigkeiten und Gasen Anwendung und dient der Minimierung von elastisch gestreutem Licht am Detektor. Letzteres wird bei Feststoffen verwendet und ist bei Faseroptik-Sonden zu finden, wodurch eine räumliche Trennung von Messort und Gerät ermöglicht wird. Es sind Vermessungen in allen Aggregatzuständen möglich, wobei bereits kleine Mengen im Pikogramm-Bereich ausreichend sind. 25
Spektralphotometer/Monochromator
Monochromatoren zerlegen polychromatisches Licht mithilfe von Gittern oder Prismen in seine spektralen Bestandteile. Letztere finden bei der Raman-Spektroskopie aufgrund des hohen Strahlungsverlustes selten Anwendung. Gitter hingegen besitzen einen sehr kleinen, vorteilhaften Aufspaltungsbereich. Man verwendet zum Beispiel Echelette-Gitter. Das sind spezielle optische Gitter, die optimiert dazu sind, eine hohe Intensität für das gebeugte Licht zu erhalten. 27
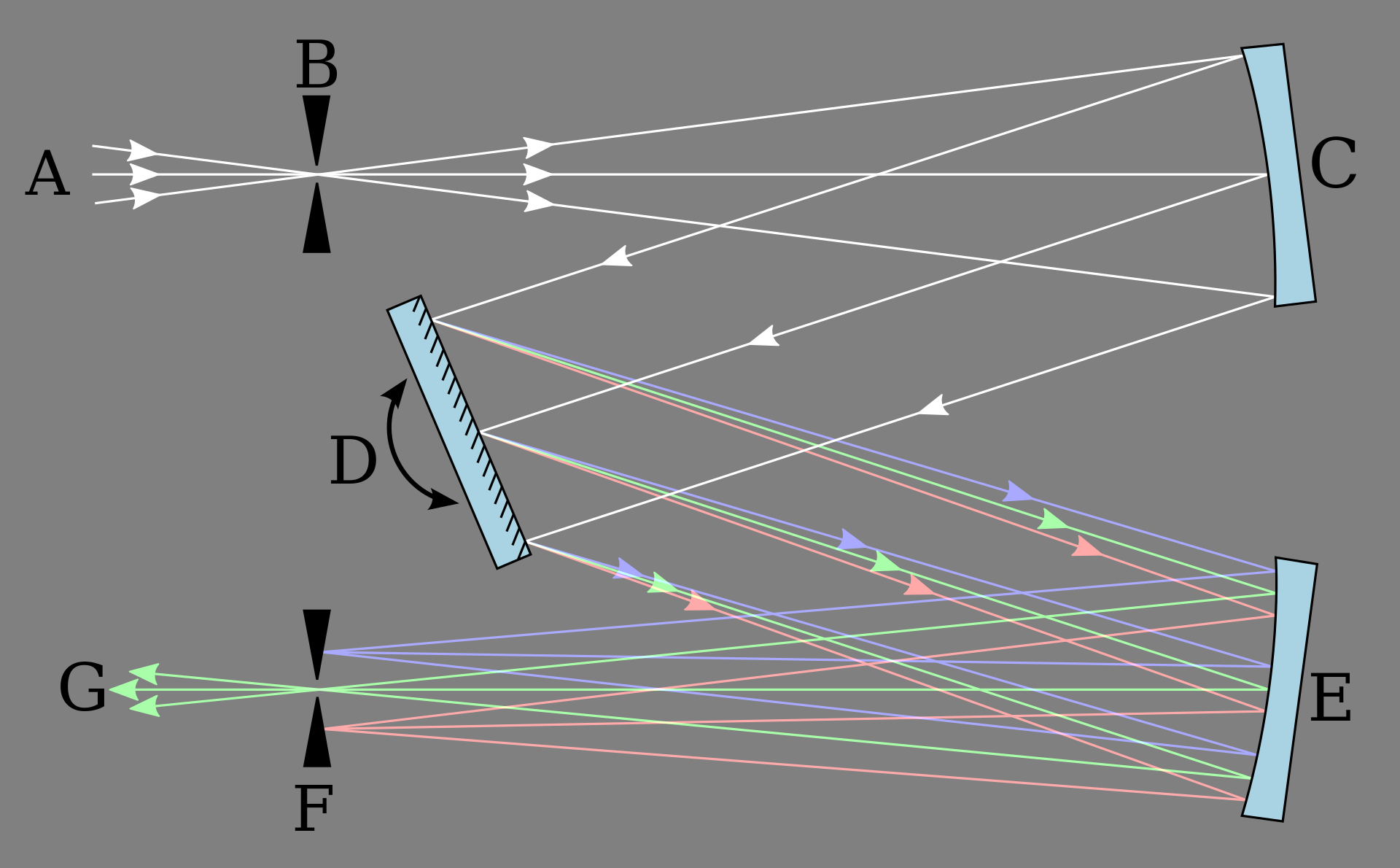
Vor dem Spektralphotometer ist ein Kerbfilter (englisch Notch-Filter) zur Unterdrückung der Rayleigh-Streuung zwischengeschaltet. Jener lässt alle Frequenzen, außer die des herausgefilterten Bereichs (±80-120 cm-1 der Anregungswellenlänge, cut-off-Bereich), durch. Ein Gittermonochromator besteht im Allgemeinen aus folgenden Bestandteilen (Abb. 4): Eingangsspalt (B), Hohlspiegel zur Parallelisierung der Strahlung (C), optisches Gitter, das die verschiedenen Wellenlängen in unterschiedlichen Winkeln reflektiert (D), Hohlspiegel zur Fokussierung auf die Brennebene (E), Ausgangsspalt (F). 28
Ein Lichtstrahl, der über einen konkaven Spiegel parallel auf ein Gitter trifft, wird durch Beugung in einzelne Wellenlängen zerlegt. Durch das Gitter gelangen nur bestimmte Wellenlängen, die von einem zweiten konkaven Spiegel gebündelt wurden, zum Ausgangsspalt.
In der Regel reicht bei der Raman-Spektroskopie ein Monochromator allein nicht aus, da noch ein zu hoher Anteil an Streulicht vorhanden ist. Stattdessen werden Doppel- oder Triplemonochromatoren verwendet, um eine höhere spektrale Auflösung zu erhalten.
Bei FT-Raman-Geräten wird hier das Interferometer eingesetzt.
Interferometerfunktion am Beispiel des Michelson-Interferometers
Über einen Strahlteiler wird der eingehende Strahl in zwei Einzelstrahlen aufgeteilt. Diese werden dann jeweils an einem Spiegel reflektiert und wieder zusammengeführt. Abhängig von ihrem Laufweg, der durch die Position der beiden Spiegel vorgegeben wird, interferieren die beiden Einzelstrahlen. Verschiebt man nur einen Spiegel, verändert sich auch der Laufweg des entsprechenden Strahls und somit das Interferenzverhalten beider Einzelstrahlen. Ein Detektor zeichnet die Intensität des Interferenzstrahls auf. Diese wird gegen die Spiegelbewegung über den Verlauf der Messung aufgetragen und es ergibt sich ein Interferogramm. Daraus kann mittels der Fourier-Transformation das eigentlich gewollte Spektrum berechnet werden.29
Detektor und EDV
In der Raman-Spektroskopie werden Halbleiterdetektoren verwendet, die auf dem Prinzip des inneren Photoeffekts beruhen. Hierbei erfolgt eine Wechselwirkung zwischen den Photonen des Streulichts und dem Detektormaterial. Dabei werden Ladungsträger vom energieärmeren Valenzband in ein energiehöheres Leitungsband gehoben. Die dafür aufgenommene Energie muss mindestens der Bandlücke, also der Energiedifferenz zwischen Valenz- und Leitungsband, bzw. der verbotenen Zone des bestrahlten Halbleiters entsprechen. 30 31 Sie sind vor allem durch ihre hohe Empfindlichkeit gekennzeichnet, weil das Streulicht von geringer Intensität ist. In modernen Geräten sind Mehrkanal-Detektoren wie z.B. ein charge-coupled device (CCD) oder Photohalbleiter-Detektoren verbaut.
Beim CCD-Element sammeln sich die Ladungsträger in Speicherzellen, dem sogenannten Potentialtopf, der wie ein Kondensator die Ladung speichert. Nach der Belichtung erfolgt das Auslesen der Ladungen durch Spannungsänderungen, indem sie Pixel für Pixel an den Rand der Detektorfläche geschoben werden und nach einer Signalverstärkung vom Computer verarbeitet werden.
Durch den multi-channel-Modus kann beim CCD-Detektor ein bestimmter Wellenzahlbereich simultan registriert werden. Dies ist auch der Grund, weshalb dieser Detektor den Photomultiplier weitgehend abgelöst hat. Die EDV - elektronische Datenverarbeitung - erfolgt wie bei der NIR-Spektroskopie durch multivariate Datenanalyse. Somit sind Spektrendatenbanken zum Vergleich unabdingbar. Sie müssen Referenzspektren enthalten, die den gesamten möglichen Variationsbereich abdecken. Dabei sind Parameter wie Hersteller, Charge, Kristallmodifikation (Polymorphie) und Partikelgröße von Bedeutung. Eine visuelle Auswertung ist nicht möglich. Die computergestützte mathematische Auswertung nach einer Zerlegung des Spektrums in Cluster erfolgt z.B. durch Hauptkomponentenanalyse. 32 33
Störeffekte
Kosmische Strahlung
Ein Störfaktor ist die kosmische Strahlung. Sie sorgt für das Auftreten unspezifischer Peaks von hoher Intensität, welche willkürlich im Spektrum positioniert sind. Diese sehr schmalen Peaks werden dabei von den empfindlichen CCD-Detektoren erfasst, welche jedoch durch ein Auswertungsprogramm sehr leicht entfernt werden können. Die Eliminierung der „cosmic spikes“ spielt eine große Rolle in der In-Prozess-Analytik.34
Fluoreszenz
Ein weiteres Problem der Raman-Spektroskopie stellt die Störung durch Fluoreszenz-Emission dar. Dabei wird vom angeregten Molekül Strahlung mit größerer Wellenlänge als die Anregungswellenlänge abgegeben. Da diese Fluoreszenzstrahlung deutliche höhere Intensität als die Raman-Streuung besitzt, überdeckt sie die Stokes-Linien im Raman-Spektrum. Diese Störquellen, hervorgerufen durch Verunreinigungen oder durch die Probe selbst, sorgen dafür, dass Raman-Messungen von farbigen Verbindungen praktisch unmöglich sind.
Eine Abhilfe stellt der Neodym-dotierte Yttrium-Aluminium-Granat-Laser dar. Durch die Verwendung von Strahlung im NIR-Bereich wird die Anregung zur Fluoreszenz verhindert. Zusätzlich ist die Gabe von Fluoreszenzlöschern wie Nitrobenzol bei flüssiger und m-Dinitrobenzol bei kristalliner Probe möglich. Des Weiteren sollten Verunreinigungen durch gängige Reinigungsverfahren, wie z.B. Destillation entfernt werden. 35 36 37
Anwendungen
Die Raman-Spektroskopie eignet sich sowohl zum qualitativen als auch quantitativen Informationsgewinn. Sie findet Anwendung in verschiedenen Gebieten. Beispiele sind Medizin, Material-, Kunst- oder Lebenswissenschaften.
Das Europäische Arzneibuch enthält eine Beschreibung der Raman-Spektroskopie (2.2.48). Dort wird u.a. die Möglichkeit zur Substanzidentifizierung oder Fälschungserkennung erwähnt. Diese finden aktuell aber in keiner Monographie Anwendung. Außerdem wird die Raman-Spektroskopie in den allgemeinen Monographien Alternative Methode zur Kontrolle der mikrobiologischen Qualität (5.1.6), Polymorphie (5.9), Kristallinität (5.16) und chemischen Bildgebung (5.24) vorgeschlagen.38
Die Raman-Spektroskopie ist off-line (Entnahme des Probenmaterials und Vermessung im Labor), at-line (Entnahme und Vermessung des Probenmaterials), on-line (Entnahme, Vermessung und Rückführung des Probenmaterials) oder in-line (Direktmessung im Produktstrom) 39, dabei schnell und nicht invasiv, zur Prozessanalytik und zur Charakterisierung von Arznei- und Hilfsstoffen sowie komplexen Gemischen anwendbar. 40
Einzelnachweise
1 Rücker/Neugebauer/Williams; Instrumentelle pharmazeutische Analytik; 5. Auflage, 2013, S. 227-235 ⇑
2 Rücker/Neugebauer/Williams; Instrumentelle pharmazeutische Analytik; 5. Auflage, 2013, S.227-235 ⇑
3 Europäisches Arzneibuch 10. Ausgabe, Grundwerk 2020 inkl. 1. Nachtrag (Monographie: 2.02.48.00) ⇑
4 Arzneibuch-Kommentar, Gesamtwerk inkl. 66 AL (Kommentar zur Monographie 2.02.48.00) ⇑
5 eigene Anfertigung von Jan-Niclas Kittner basierend auf Skript Seminar: Instrumentelle Analytik - Raman-Spektroskopie (SS21); Dr. Thomas Kellner, S. 7 und Rücker/Neugebauer/Williams; Instrumentelle pharmazeutische Analytik; 5. Auflage, 2013, S. 228 Abb. 13.19 ⇑
6 Rücker/Neugebauer/Williams; Instrumentelle pharmazeutische Analytik; 5. Auflage, 2013 S.227-235 ⇑
7 Europäisches Arzneibuch 10. Ausgabe, Grundwerk 2020 inkl. 1. Nachtrag (Monographie: 2.02.48.00) ⇑
8 Arzneibuch-Kommentar, Gesamtwerk inkl. 66 AL (Kommentar zur Monographie 2.02.48.00) ⇑
9 eigene Anfertigung von Jan-Niclas Kittner basierend auf Skript Seminar: Instrumentelle Analytik - Raman-Spektroskopie; Dr. Thomas Kellner, S. 10-12 ⇑
10 https://de.wikipedia.org/wiki/Elektrisches_Dipol-Moment ; 14.06.2021, 19:06Uhr ⇑
11 Rücker/Neugebauer/Williams; Instrumentelle pharmazeutische Analytik; 5. Auflage, 2013, S.227-235 ⇑
12 Europäisches Arzneibuch 10. Ausgabe, Grundwerk 2020 inkl. 1. Nachtrag (Monographie: 2.02.48.00) ⇑
13 Arzneibuch-Kommentar, Gesamtwerk inkl. 66 AL (Kommentar zur Monographie 2.02.48.00) ⇑
14 Arzneibuch-Kommentar, Gesamtwerk inkl. 66 AL (Kommentar zur Monographie 2.02.48.00) ⇑
15 Skript Seminar: Instrumentelle Analytik - Raman-Spektroskopie (SS21); Dr. Thomas Kellner ⇑
16 https://commons.wikimedia.org/wiki/File:Setup_Raman_Spectroscopy_adapted_from_Thomas_Schmid_and_Petra_Dariz_in_Heritage_2(2)_(2019)_1662-1683.png; 14.06.2021, 16:00Uhr ⇑
17 Rücker/Neugebauer/Williams; Instrumentelle pharmazeutische Analytik; 5. Auflage, 2013, S.231 f. ⇑
18 https://de.wikipedia.org/wiki/Helium-Neon-Laser; 03.06.2021, 9:13 Uhr ⇑
19 https://de.wikipedia.org/wiki/Argon-Ionen-Laser; 03.06.2021, 9:39 Uhr ⇑
20 http://www.chemgapedia.de/vsengine/tra/vsc/de/ch/3/anc/ir_raman_spektroskopie1.tra/Vlu/vsc/de/ch/3/anc/ir_spek/raman_geraete.vlu/Page/vsc/de/ch/3/anc/ir_spek/raman_spektroskopie/raman_geraetetechnik/ra_1_1/laser_m89ht0703.vscml.html; 03.06.2021, 9.15 Uhr ⇑
21 https://de.wikipedia.org/wiki/Nd:YAG-Laser; 03.06.2021, 9.45 Uhr ⇑
22 https://de.wikipedia.org/wiki/Laserdiode; 03.06.2021, 9.50 Uhr ⇑
23 https://www.spektrum.de/lexikon/physik/durchstimmbarer-laser/3548; 03.06.2021, 10.03 Uhr ⇑
24 https://de.wikipedia.org/wiki/Farbstofflaser; 03.06.2021, 10.04 Uhr ⇑
25 http://www.chemgapedia.de/vsengine/tra/vsc/de/ch/3/anc/ir_raman_spektroskopie1.tra/Vlu/vsc/de/ch/3/anc/ir_spek/raman_probenvorb.vlu/Page/vsc/de/ch/3/anc/ir_spek/raman_spektroskopie/ra_probenvorbereitung/ra_7_2/anordnung_m13ht0603.vscml.html; 03.06.2021, 10.34 Uhr ⇑
26 https://commons.wikimedia.org/wiki/File:Czerny-Turner_Monochromator.svg; 14.06.2021, 16:00Uhr ⇑
27 https://de.wikipedia.org/wiki/Echellegitter; 17.06.2021, 16:35Uhr ⇑
28 http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/3/anc/ir_spek/raman_geraete.vlu/Page/vsc/de/ch/3/anc/ir_spek/raman_spektroskopie/raman_geraetetechnik/ra_1_3/monochromram_m89ht0803.vscml.html; 03.06.2021, 11.07 Uhr ⇑
29 https://de.wikipedia.org/wiki/Michelson-Interferometer; 17.06.2021, 17:51Uhr ⇑
30 https://studyflix.de/ingenieurwissenschaften/photoeffekt-1695; 03.06.2021, 11.39 Uhr ⇑
31 https://de.wikipedia.org/wiki/Photoelektrischer_Effekt; 03.06.2021, 11.40 Uhr ⇑
32 http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/3/anc/ir_spek/raman_geraete.vlu/Page/vsc/de/ch/3/anc/ir_spek/raman_spektroskopie/raman_geraetetechnik/ra_1_2_2/halbleiterccd_m89ht0703.vscml.html; 03.06.2021, 11.59 Uhr ⇑
33 https://de.wikipedia.org/wiki/CCD-Sensor; 03.06.2021, 11.59 Uhr ⇑
34 Skript Seminar: Instrumentelle Analytik - Raman-Spektroskopie (SS21); Dr. Thomas Kellner ⇑
35 https://www.uni-muenster.de/imperia/md/content/physikalische_chemie/praktikum/raman_dammers__doedt.pdf; 04.06.2021, 9.21 Uhr ⇑
36 https://d-nb.info/1183623836/34; 04.06.2021, 9.41 Uhr ⇑
37 Skript Seminar: Instrumentelle Analytik - Raman-Spektroskopie (SS21); Dr. Thomas Kellner ⇑
38 Europäisches Arzneibuch 10. Ausgabe, Grundwerk 2020 inkl. 1. Nachtrag (Monographie: 2.02.48.00) ⇑
39 Skript Seminar: 08-Prozessanalytik_WS2021-Skript; Dr. Thomas Kellner, S. 8-12 ⇑
40 Rücker/Neugebauer/Williams; Instrumentelle pharmazeutische Analytik; 5. Auflage, 2013, S.234 f. ⇑
Monographie: Monographien (Fälschungen)
Arzneimittelfälschungen
Arzneimittelfälschung ist ein weltweites Problem, besonders in Entwicklungsländern. Bei einer Fälschung kann es sich um eine Abweichung der Identität oder des Gehalts einzelner Arznei- oder Hilfsstoffe oder um die Fälschung eines kompletten Arzneimittels handeln. Die WHO unterteilt gefälschte Arzneimittel in folgende Kategorien1:
- Fälschungen von Umverpackungen
- Fälschungen, die eine geringere als die deklarierte Wirkstoffmenge enthalten
- Fälschungen, die einen falschen Wirkstoff enthalten
- Fälschungen, die keinen Wirkstoff enthalten
- Fälschungen, die einen Wirkstoff minderer Qualität enthalten (nicht Ph. Eur. gemäß)
Die Erkennung gefälschter Arzneimittel ist von hoher Relevanz, da sie direkte Auswirkungen auf die Gesundheit des Anwenders haben. Bei gefälschten Arzneimitteln kann eine Wirkung vermindert sein oder ganz ausbleiben. Dies oder eine eigene toxische Wirkung kann in besonderen Fällen auch zum Tod des Anwenders führen.
Im besten Fall haben gefälschte Arzneimittel nur eine verminderte Wirkung. Sie können aber auch wirkungslos oder in schweren fällen sogar tödlich sein. 2 2006 gab es zum Beispiel in Südamerika viele Todesfälle infolge einer Vergiftung mit Diethylenglykol, nachdem das Analysezertifikat es als Glycerol mit 99,5%iger Reinheit ausgewiesen hatte. Dadurch wurde die toxische Substanz zur Herstellung von Hustensäften verwendet. 3
Abgesehen von gefälschten Arzneimitteln, die über legale Lieferketten, wie z.B. öffentliche Apotheken, an den Patienten gelangen, sind auch illegale Quellen wie nicht autorisierte Internethändler ein großes Problem. 4
Maßnahmen gegen Arzneimittelfälschungen
Um Fälschungen aufzudecken bevor sie den Patienten erreichen, sind quantitative und qualitative Untersuchungen von Arznei- und Hilfsstoffen essentiell. So können auch Verwechslungen von Stoffen oder vorsätzlich ausgetauschte Substanzen erkannt werden. Auch Substanzen korrekter Identität aber unzureichender Reinheit können durch Arzneibuchprüfungen nachgewiesen werden. In den allgemeinen Vorschriften zu Monographien (1.4) enthält das Europäische Arzneibuch einen Absatz über Potentielle Fälschungen, in dem bei Auffälligkeiten speziell auf Fälschungsgefahren hingewiesen werden kann. Ein Fehlen dieses Absatzes in einer Monographie bedeutet jedoch nicht, dass Kontrollen vernachlässigbar sind. 5
Wichtig ist eine Sicherstellung geeigneter Qualität während aller Herstellungsschritte, angefangen bei den Ausgangsmaterialien. Ebenso muss die korrekte Herkunft aller Materialen bekannt sein. Dabei sollte die gesamte Lieferkette bis zum Anwender hin nachvollziehbar erfasst werden können. Die Häufigkeit und Maßnahmen der Prüfung hängen dabei von nationalem Recht und einer Risikoanalyse im Rahmen eines Qualitätsmanagementsystems ab.
Unabhängig von den vorgegebenen Prüfungen in einer Stoffmonographie können spezielle Prüfungen mit z.B. NMR-, NIR-, Raman-Spektroskopie sowie DC/HPLC (gerade bei pflanzlichen Drogen oder daraus hergestellten Arzneimitteln) durchgeführt werden, um Fälschungen sicher auszuschließen. In einer öffentlichen Apotheke eignet sich bei vorhandenem Gerät besonders die Raman-Spektroskopie, da sie schnell und ohne Probenvorbereitung angewendet werden kann und nicht invasiv ist. So können beispielsweise Tabletten direkt in den Blisterverpackungen vermessen werden. Eine preiswertere, aber dennoch einfache und schnelle Methode, die auch in Entwicklungsländern zugänglich ist, stellt die Dünnschichtchromatographie dar, mit der besonders gut Nachweise von falscher Identität oder fehlendem Wirkstoff möglich sind.6 7
Einzelnachweise
1 Arzneibuch-Kommentar, Gesamtwerk inkl. 66 AL (Kommentar zur Monographie 1.04.00.00) ⇑
2 https://de.wikipedia.org/wiki/Medikamentenf%C3%A4lschung; 04.06.2021, 13:50 Uhr ⇑
3 https://www.deutsche-apotheker-zeitung.de/daz-az/2011/daz-38-2011/mit-der-identitaetspruefung-verfaelschungen-entdecken ; 04.06.2021, 13:05 Uhr ⇑
4 https://www.bfarm.de/DE/Arzneimittel/Arzneimittelzulassung/Arzneimittelinformationen/Arzneimittelfaelschungen/_node.html; 04.06.2021, 13:35 Uhr ⇑
5 Europäisches Arzneibuch 10. Ausgabe, Grundwerk 2020 inkl. 1. Nachtrag (Monographie: 1.04.00.00) ⇑
6 Arzneibuch-Kommentar, Gesamtwerk inkl. 66 AL (Kommentar zur Monographie 1.04.00.00) ⇑
7 https://de.wikipedia.org/wiki/Medikamentenf%C3%A4lschung; 04.06.2021, 13:50 Uhr ⇑
TU-Braunschweig Institut für Medizinische und Pharmazeutische Chemie Seminar: Instrumentelle Analytik Kontakt: tubs@t-kellner.de